Монография исследование водорослей.. Во́доросли. Аутентичного материала
 Скачать 2.99 Mb. Скачать 2.99 Mb.
|
|
Глава 6. Антикоагулянтная и фибринолитическая активность сульфатированных полисахаридов Поиск высокоэффективных заменителей гепарина среди его структурных аналогов — сульфатированных полисахаридов растительного происхождения, не теряет своей актуальности в связи с ресурсной обеспеченностью и безопасностью. Понимание механизмов антикоагулянтного действия этих соединений имеет важное практическое значение, поскольку применение антикоагулянтных препаратов требует индивидуального подхода к больному с учетом их действия на определенные звенья системы гемостаза. Несмотря на доминирующее положение гепаринов над другими антикоагулянтами прямого действия, гепаринотерапия сопряжена с риском развития ряда осложнений (в том числе возникновение кровотечений, тромбоцитопения, тромбозы, риск иммунных осложнений, остеопе-ния, в результате чего возможны переломы кости (Goodman et al., 2003 Bounameaux, 2004; Gouin-Thibault, 2005; Alvarez, 2007; Castelli, Cassinerio, 2007; Kuitunen et al., 2007), аллергические реакции, головокружение, тошнота, диарея, анорексия, временное выпадение волос (Desay, 2004; Godel, 1996). Кроме того, гепарин в высоких дозах проявляет иммунодепрес-сивные свойства, выражающиеся в угнетении формирования антитело-образующих клеток (Sztein, 1989), депрессии в системе нейтрофильных лейкоцитов (Нестерова и др., 1999). К числу недостатков относится тот факт, что гепарин образуется в метахроматических гранулах тучных клеток млекопитающих и содержится в печени, легких, кишечнике. Кроме того, гепарин является лекарственным препаратом животного происхождения, в связи с этим его использование в клинике сопряжено с риском прионовой контаминации (Зуев, 1999; Ben-Zaken et al., 2003). Недостатки гепаринотерапии стимулируют разработку новых антикоагулянтных средств, лишенных побочных эффектов этого препарата. Исходя из тех преимуществ, которыми обладают гепарины, а также с учетом его структуры (кислый сульфатированный мукополисахарид, не имеющий разветвленного полисахаридного скелета, состоящий из остатков 1,4-связанного глюкозамина и глюкуроновой кислоты, этери-фицированных серной кислотой), поиск новых антикоагулянтов прямого действия активно ведется среди сульфатированных полимеров (полисульфаты пентозана и дерматана, хиторин) и полисахаридов (фукоиданы). Особый интерес вызывают антикоагулянтная и антитромботическая активности, которые были обнаружены одними из первых в спектре биологических свойств фукоиданов. Впервые антикоагулянтная актив- 133 ность была выявлена G. Springer et al. (Springer et al., 1957) у фукоидана из бурой водоросли F. vesiculosus. Описание антикоагулянтных свойств занимает преобладающее место в спектре биологической активности фукоиданов. Их изучение проводится, в основном, в связи со структурными особенностями этих соединений. При этом, по мнению многих исследователей, степень антикоагулянтного действия фукоиданов тесно коррелирует с их структурой и функцией (Athukorala et al, 2006; Cumashi et al, 2007; Pomim, 2009; Costa et al., 2011 b). Степень антикоагулянтной активности у фукоиданов из разных видов бурых водорослей значительно варьирует от слабо выраженной, либо ее отсутствия, до высокой. Установлена связь между молекулярной массой и антикоагулянтной активностью СПС. Одни исследователи считают, что антикоа-гулянтная активность фукоиданов связана с высокой молекулярной массой (Zhang, Мао, Fang et al, 2007), другие нижним пределом для проявления этой активности считают 20 кДа (Nishino et al., 1991). Но в целом авторы заключают, что разные фракции фукоиданов имеют свой оптимум молекулярных масс для проявления антикоагулянтной активности (Nishino et al., 1999; Pomim, 2009). Установлено также, что антикоагулянтная активность фукоиданов коррелирует с содержанием сульфатов. Так, V. Grauffel et al. (Grauffel et al., 1989) исследовали эту корреляцию в отношении фукоиданов из F. vesiculosusи Pelvetiacanaliculataи установили, что, например, антитром-биновая активность фукоиданов возрастала с увеличением содержания сульфатов. Рядом авторов подтверждена эта связь на хорошо изученных фукоиданах с различным содержанием сульфатов и показано, что десульфатированные фракции фукоиданов были малоактивны в коагу-лологических тестах (Kitamura et al., 1991; Nishino, Nagumo, 1992; Croci et al., 2011). Результаты, полученные этими авторами, свидетельствуют также, что фракции, обогащенные сульфатами, но бедные по содержанию уроновых кислот, проявляют относительно высокую активность, тогда как фракции с обратным соотношением этих структурных составляющих обладают более слабой антикоагулянтной активностью. Исходя из этих данных можно считать, что потенциальные антикоагулянты — фукан-сульфаты с высокой степенью сульфатирования. С. Boisson-Vidal et al. (Boisson-Vidal et al., 2000) также отмечают, что антикоагулянтная и антитромботическая активность фракций фукоиданов из Ascophyllumnodosumувеличивалась с возрастанием молекулярной массы и содержания сульфатов. При этом фракции нативных фукоиданов, в которых природная структура не была нарушена, оказались более 134 активными в проявлении антикоагулянтного действия, чем аналогичные по молекулярным массам и степени сульфатирования фракции, но модифицированные частичным десульфатированием. Помимо этого, антикоагулянтная активность фукоиданов находится в зависимости от моносахаридного состава. Как известно, их структурными моносахаридами являются фукоза, галактоза, манноза, ксилоза в различном соотношении. Однако, эта зависимость очень неоднозначна. Так, показано, что высокое содержание фукозы (а также сульфатов) и низкое содержание других нейтральных Сахаров могут способствовать проявлению высокой антикоагулянтной активности фукоиданов (Nishino, Nagumo, 1987; Nishino et al., 1991a,b). Определенное значение для проявления антикоагулянтных свойств (даже в большей мере, чем степень сульфатирования) имеет соотношение сульфаты/общие сахара (Nishino et al., 1991a). Расчеты показали, что фукоидан, с соотношением менее 3, не является антикоагулянтом. Авторы делают заключение о возможности усиления антикоагулянтной активности фукоидана путем увеличения степени сульфатирования. В то же время Н.А. Ушакова и др.; N.A. Cumashi et al. (Ушакова и др., 2008; Cumashi et al., 2007) при проведении сравнительного исследования антикоагулянтного действия фукоиданов с разной структурой не выявили прямой зависимости от содержания в них сульфатов, фукозы и других Сахаров, а также от структуры основной цепи. Однако, большинство исследований свидетельствует о том, что для проявления антикоагулянтных свойств важными являются величина молекулярной массы, количество и расположение сульфатных групп, а также моносахаридный состав. Изучение механизмов антикоагулянтной активности сульфатирован-ных полисахаридов и связи со структурой этих соединений проводится, как правило, в сравнительном аспекте по отношению к гепарину. Механизм антикоагулянтного действия гепарина заключается в торможении активности тромбина, который катализирует превращение фибриногена в фибрин и некоторые другие реакции в системе гемостаза. Антитромбиновая активность гепарина зависит от наличия плазменного белка антитромбина III (AT III). AT III является а-2-глобулином с молекулярной массой 65 кДа, синтезируется в печени и в избыточном количестве имеется в плазме крови. При связывании гепарина с AT III в молекуле последнего происходят конформационные изменения, которые позволяют ему быстрее соединяться с активным центром тромбина и других сериновых протеаз (факторы IXa, Xa, XIa и ХПа свертывания, калликреин и плазмин). Таким образом, гепарин тормозит тромбооб- 135 разование, способствуя инактивации тромбина его физиологическим ингибитором AT III. В присутствии гепарина инактивация тромбина антитромбином III ускоряется примерно в 1000 раз. Несколько меньшее значение для проявления антикоагулянтного действия гепарина имеет «кофактор гепарина II» (НС II), второй гепаринзависимый ингибитор тромбина, отличающийся от AT III, который нейтрализует тромбин лишь при высоких концентрациях гепарина в плазме крови (Hirsh et al., 2001; Samama et al., 1996). Механизм антикоагулянтного и антитромботического действия ге-паринов зависит от их молекулярной массы. Как НФГ, так и НМГ образуют комплексы с плазменным AT III. Однако, если комплекс НФГ-антитромбин в равной степени ингибирует тромбин (фактор Па) и фактор Ха, а также слабее другие ферментные факторы свертывания крови (фактор Хагемана, факторы IX, XI, XII и др.), то у НМГ преобладает анти-Ха активность (Lin et al., 2001; Hoppensteadt et al., 2003). Вариация отношения активностей анти-Ха/анти-Па составляет от 1,5-2,5 (Certoparin, Parnoparin, Tinzaparin) до 3,6—6,1 (Reviparin) (Boneu, 2000). Чем выше этот показатель, тем более значителен антитромботический эффект и менее выражено антикоагулянтное и геморрагическое действие препарата (Koch et al., 2001). Механизмы антикоагулянтного действия фукоиданов и гепарина имеют ряд различий. Так, М.Я. Розкин с соавт. (Розкин и др., 1991), исследуя фукоиданы из ряда бурых водорослей, показали, что их антикоагулянт-ный эффект реализуется путем непосредственного взаимодействия с факторами свертывания крови (и с тромбином) и обусловлен ингиби-рованием активности факторов внутреннего пути свертывания крови — XI, XII и VIII, притом, что активность факторов протромбинового комплекса (внешнего пути свертывания) — II, V и VII и X достоверно не изменяется. В отличие от механизма действия гепарина AT III в этом процессе участия не принимает. В связи с этим авторы предполагают возможным использование фукоиданов с подобным механизмом действия для эффективной антикоагулянтной терапии у больных с врожденным или приобретенным дефицитом AT III. Немаловажная роль в реализации механизмов антикоагулянтной активности фукоиданов принадлежит тромбину. Так, показано, что фукоидан из Е vesiculosusактивирует НС II invitroи invivo, при этом антитромбиновая активность фукоидана in vivo опосредуется НС II, а не AT III. В данном случае подавление активности тромбина происходит опосредованно (Church et al., 1989) Преимущественная роль НС II по сравнению с AT III в механизме антикоагулянтной активности 136 фукоидана из S. cichorioidesпоказана также SJ. Yoon et al. (Yoon et al, 2007). Установлено, что фукоидан из Eckloniakuromeв значительной степени подавлял тромбинообразование как по внутреннему, так и по внешнему путям свертывания, при этом влияние по внутреннему пути было более выражено (Nishino et al., 1999). Кроме того, отмеченный фукоидан также ингибировал образование протромбин-активиру-ющего комплекса (протромбиназы). Таким образом, механизм действия фукоидана из Е. kuromeзаключается в ингибирующем эффекте на тромбинообразование путем блокирования протромбиназы и предотвращения образования Ха фактора по внутреннему пути свертывания в дополнение к его антитромбиновой активности. Именно этому механизму принадлежит ведущая роль в угнетении фукоиданом тромбинообразования по сравнению с его эффектом на антитромби-новую активность через НС II плазмы (Nishino et al., 1999). По данным F. Trento et al. (Trento et al., 2001) фукоиданы из Е vesiculosusи A. nodosumпроявляли высокую антикоагулянтную активность invivo, которая выражалась в дозозависимом подавлении у кроликов тромбооб-разования при внутривенном введении фукоиданов. Авторы связывают антикоагулянтный механизм действия фукоиданов с угнетающим воздействием на тромбин и связанные с ним факторы свертывания как на начальном, так и на последующем этапах свертывания. Высокую анти-тромбиновую активность показали фукоиданы из Saccharinaangustata, Pelvetiacanaliculata(Grauffel et al., 1989; Kitamura et al., 1991). При этом низкомолекулярные фракции фукоидана из P. canaliculataингибировали активность тромбина как через НС II, так и посредством активации AT III, что свидетельствует о значении структурных особенностей в реализации механизма антикоагулянтного действия. A. Cumashi et al., M. Pereira et al. показали, что фукоиданы с разветвленной структурой ингибируют активность тромбина путем прямого воздействия, а с линейной - опосредованно через НС II и AT III (Pereira et al., 1999; Cumashi et al., 2007). Таким образом, большая часть фукоиданов ингибирует тромбин в отсутствие AT III, что отличает их от гепарина, хотя у ряда этих полисахаридов антикоагулянтная активность значительно возрастает в присутствии AT III. V. Doctor et al. (Doctor, 1995; Minix, 1997), T. Nishino et al. (Nishino et al., 2000) отмечают, что фукоидан из Е. kuromeэффективнее гепарина усиливает фибринолиз, потенцируя тканевой и урокиназный активаторы плазминогена in vitro. Механизм этого эффекта заключается в связывании фукоидана с плазминогеном и индуцировании структурных изменений чувствительности плазминогена к действию активаторов плазминогена, что предполагает наличие у фукоидана фибринолити- 137 ческой активности. Это свойство позволяет рассматривать фукоиданы как потенциальное средство для рассасывания тромбов. Дальнейшие исследования показали, что нативный фукоидан из этого вида водоросли увеличивал активность плазминогена invitro, а дополительно сульфатированный фукоидан - ингибировал или не оказывал влияния на этот процесс (Lang et al., 2004; Hall et al., 2006). Таким образом, сульфатированные полисахариды из бурых водорослей, сочетающие в себе свойства антикоагулянтов, ингибиторов тромбина, фибринолитиков, перспективны для клинического использования и представляют альтернативу гепарину. Приведенные данные свидетельствуют о том, что фукоиданы обладают разносторонней фармакологической активностью и с успехом могут быть использованы для создания новых БАД к пище и лекарственных препаратов. Наши исследования касались механизмов антикоагулянтного действия фукоиданов, выделенных из бурых водорослей Охотского моря Е evanescensи S. cichorioidesв тестах invitroи invivo(Кузнецова и др., 2003; Дрозд и др., 2006). При изучении влияния фукоиданов из F. evanescens(I) и S. cichorioides(II) на показатели свертывания крови (нормальной плазмы здоровых доноров) в базовых коагуляционных тестах invitroвыявлено дозозависимое увеличение времени свертывания по показателям АПТВ- ТВ- и ПВ-тестов. Пролонгирование показателей АПТВ- и ПВ- тестов свидетельствует об эффективном влиянии фукоиданов I и II на механизмы внутреннего и в меньшей степени — внешнего — путей свертывания. Значительное удлинение ТВ, характеризующего конечный этап свертывания или превращение фибриногена в фибрин под воздействием тромбина, свидетельствует о влиянии фукоиданов на этот процесс и предполагает воздействие на тромбин. В связи с этим нами исследована ингибиторная активность фукоиданов по отношению к тромбину (фактору Па) и к фактору Ха. В частности, проведен анализ специфических антикоагулянтных активностей фукоиданов: удельной антитромбиновой (alia) активности и удельной активности против фактора Ха (аХа). Способность антикоагулянтных препаратов к торможению активности фактора Па (тромбина) и активности Ха является их важной характеристикой, особенно в отношении средств, применяемых для профилактики тромбообразования. При исследовании invitroбыли установлены следующие показатели ин-гибиторной активности фукоиданов по отношению к тромбину (фактору Па): от 22±7 до 29±6 ЕД/мг для фукоидана из Е evanescens(I) и от 43±8 до 49±8 ЕД/мг для фукоидана из S. cichorioides(II), по отношению к активи- 138 рованному фактору X (Ха): от 28±7 до 66±10 ЕД/мг для I и от 31±8 до 83±7 ЕД/мг для П. Отношение aXa/alla составило 1,3—2,3 для I и 0,7—1,7 для II, что является показателем терапевтического эффекта и свидетельствует о перспективности практического применения исследуемых фукоиданов в качестве антикоагулянтных и антитромботических средств. Дальнейшее исследование механизмов антикоагулянтного действия фукоиданов, а именно изучение возможности прямого антитромбино-вого действия фукоидана из F. evanescensили способности тормозить самосборку фибрин - мономера проводили путем оценки его влияния на свертывание очищенного препарата фибриногена тромбином. При анализе полученных нами результатов установлено отсутствие антикоагулянтного эффекта под влиянием фукоидана в диапазоне концентраций от 1 до 1000 мкг/мл, что характерно и для внесения в такую тест-систему гепарина. Это позволило нам предположить, что прямым антитромби-новым действием фукоидан не обладает, а его антикоагулянтное действие обусловлено активацией AT III, т.е., как и гепарин, фукоидан не является прямым ингибитором тромбина, а действует опосредованно, через какой-либо компонент плазмы. Для проверки данного предположения было предпринято исследование антикоагулянтного действия фукоидана в присутствии AT III и без него с использованием тест-системы с хромогенным субстратом, специфичным по отношению к тромбину. Результаты данного исследования показывают, что оптическая плотность в смеси фукоидана в концентрации 100 или 1000 мкг/мл, тромбина и хромогенного субстрата, не содержащей AT III, близка к оптической плотности в контроле, где вместо фукоидана вносили буферный раствор. Близкие к контролю значения оптической плотности были обнаружены в смеси тромбина, хромогенного субстрата и гепарина. Т.е., показатели поглощения в пробах под влиянием фукоидана и гепарина являются сопоставимыми. Это свидетельствует об отсутствии самостоятельного (без AT III) антикоагулянтного действия фукоидана. Снижение оптической плотности (в сравнении с контролем) смеси фукоидана в концентрациях 100 или 1000 мкг/мл, тромбина, хромогенного субстрата и AT III было сопоставимым с таким же снижением в смеси гепарина, тромбина, хромогенного субстрата и AT III, различия между этими показателями не являются статистически значимыми (р>0,05). Очевидно, что это снижение обусловлено инактивацией тромбина антикоагулянтом (фукоиданом либо гепарином) в присутствии AT III. При исследовании антикоагулянтной активности фукоиданов invivoустановлено, что однократное внутрибрюшинное введение фукоидана I 139 в дозе 5 мг/кг мышам линии BALB/c приводило к гипокоагуляции, о чем свидетельствует увеличение времени свертывания в АПТВ-тесте в 3,3 раза (р>0,05) и в тромбо-тесте — в 4,0 раза (р>0,05) через 15 мин после инъекции (табл. 1). По истечении 30 мин время свертывания в этих тестах отличалось от контрольного в 1,8 и 1,6 раза, а через 60 мин показатели коагулограммы возвращались к контрольному уровню. При введении мышам фукоидана II в такой же дозе время свертывания плазмы через 15 мин после введения увеличивалось по сравнению с контролем в 4,1 раза в АПТВ-тесте (р<0,05) и в 5,3 раза в тромбо-тесте (р<0,05); через 30 мин после инъекции препарата время свертывания возрастало в 2,9 и 2,1 раза (р<0,05) соответственно. К контрольному уровню время свертывания возвращалось только через 180 мин, т.е. антикоагулянтный эффект фукоидана II был более продолжителен по сравнению с фукоиданом I (табл. 6.1). При увеличении кратности введения фукоидана из F. evanescensживотным до 10 (ежедневное внутрибрюшинное введение в течение 10 суток) отмечен более выраженный процесс гипокоагуляции с замедлением по сравнению с контролем времени свертывания в АПТВ-тесте в 3,6 раза, в ПВ-тесте в 3,3 раза, в ТВ-тесте в 7,1 раза (р<0,05) (табл. 2). В связи с тем, что фукоиданы перспективны для разработки новых БАД к пище и лекарственных препаратов, важным является исследование антикоагулянтной активности фукоиданов при условии их введения per os. В этом случае доза фукоидана составила 50 мг/кг. При 10-кратном пероральном введении фукоидана показатели гемостаза не отличались статистически значимо от таковых в контроле. При увеличении продолжительности перорального введения фукоидана животным до 30 дней наблюдалось пролонгирование времени свертывания в 1,4-1,5 раза по сравнению с контролем (р<0,05) (табл. 2). Таким образом, фукоидан из F. evanescensоказывает антикоагулянтный эффект при парентеральном и длительном (30-кратном) пероральном введении животным. С увеличением кратности введения фукоидана развивается более глубокая гипокоагуляция. 140 Таблица 6.1 Показатели гемостаза при внутрибрюшинном введении фукоиданов,выделенных из F. evanescens(I) и S. cichorioid.es(II), мышам BALB/c
Примечание: показатели гемостаза Ме±т; ИС — индекс стимуляции — рассчитан как отношение времени свертывания в опыте и контроле; р-значимость различий показателей в опыте по сравнению с контролем (К); использован непараметрический Q-критерий Данна; при сравнении показателей I и II использован непараметрический z-критерий Манна-Уитни; п=5; (*р<0,05) — различия статистически значимы по отношению к контролю. Таблица 6.2 Влияние фукоидана из F. evanescensна систему гемостаза у мышей BALB/c в зависимости от кратности и способа введения
141
Примечание: показатели гемостаза Ме±т; ИС — индекс стимуляции — рассчитан как отношение времени свертывания в опыте и контроле; р-значимость различий показателей в опыте по сравнению с контролем; использован непараметрический Q-критерий Данна; п=5; (*р<0,05) — различия статистически значимы. Для исследования специфической антикоагулянтной активности плазмы в экспериментах invivoфукоиданы I и II вводили однократно внутривенно в дозах 5 и 10 мг/кг крысам Wistar. При введении фукоидана I отмечено незначительное увеличение показателей антикоагулянтной активности плазмы с увеличением дозы. Так, активность фактора Ха регистрировалась только через 5 мин после введения и составила 0,2±0,02 ЕД/мл и 0,3±0,02 ЕД/мл в зависимости от вводимой дозы. Показатели alia активности через 5 мин после введения фукоидана I составляли достаточную для терапевтического эффекта величину (2,3±0,23 ЕД/мл и 2,5±0,36 ЕД/мл) (табл. 6.3). В отношении фукоидана II в дозе 10 мг/кг аХа доходила до 0,95±0,0б ЕД/мл, a alia до 3,1 ±0,24 ЕД/мл. Эффект по аХа активности для фукоидана II сохранялся до 60 мин (0,43±0,09 ЕД/мл; р=0,002). Длительность эффекта по alia активности составила 180 мин (срок наблюдения) для обоих препаратов. В зависимости от срока после введения крысам каждого из исследуемых препаратов отмечалось снижение эффекта 3—12 — кратно (табл. 6.3). Таким образом, внутривенное введение крысам фукоиданов I и II вызывает дозозависимое усиление специфической антикоагулянтной активности плазмы. Следует отметить, что, несмотря на больший показатель соотношения aXa/alla для фукоидана I из F. evanescens, сила и длительность антикоагулянтного эффекта для фукоидана II из S. cichorioidesвыше. Это, по-видимому, объясняется различием в удельной антитромбиновой активности образцов (у II фукоидана alia активность в два раза больше, чем у I) при практически одинаковых ингибиторных активностях фукоиданов по отношению к фактору Ха. Наши исследования включали также изучение способности фукоиданов к комплексообразованию с протамина сульфатом. Необходимость нейтрализации антикоагулянтного эффекта у пациентов возникает во время угрозы кровотечения, возникающей при длительном приеме антикоагулянтов, а также при угрозе кровотечений, появляющейся при различных хирургических вмешательствах с использованием антикоагулянтов, при экстракорпоральном кровообращении при операциях на 142 открытом сердце или программном гемодиализе при заместительной терапии с использованием антикоагулянтов (Haverkamp et al., 2003; Schick et al., 2004;). Известна способность протамина сульфата нейтрализовать антикоагулянтную активность нефракционированного и некоторых низкомолекулярных гепаринов. Нейтрализация антикоагулянтного эффекта гепарина происходит за счет электростатического взаимодействия между отрицательно заряженным полисахаридом и положительно заряженным протамина сульфатом с возникновением комплекса (Ramamurthy et al., 1999). Таблица 6.3 Антикоагулянтная активность плазмы крыс после внутривенного введения фукоиданов, выделенных из F. evanescens(I) и S. cichorioides(II)
Примечание: показатели M±m; p — значимость различий показателей в опыте по сравнению с контролем; использован параметрический t-критерий Стьюдента; п=15; (*р<0,05) — различия статистически значимы по отношению к контролю. 143 " 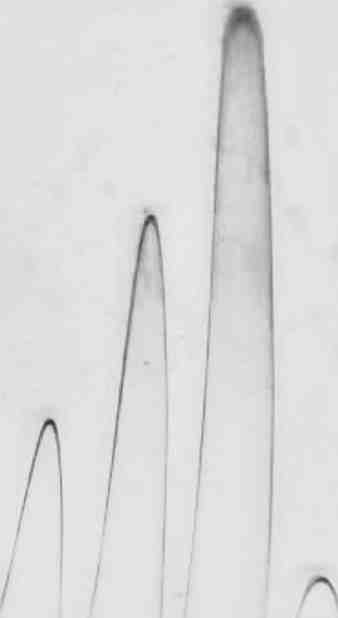 /> 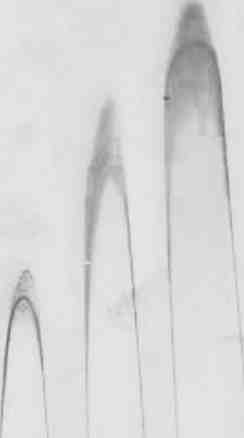 1a 26 Зв 4г 5д 6а 76 9г 10д 11а 126 13в 14г 15д Рис. 6.1. Комплексообразование с сульфатом протамина фукоиданов из F. evanescencs (I) (6—10) и S. cichorioides(II) (11—15) в сравнении с гепарином (1—5) в геле агарозы. Концентрация фукоиданов и гепарина (мг/мл): а — 0,31; б — 0,63; в- 1,25; г - 2,5; д-5,0 На рис. 1 представлено сканированное изображение результата электрофореза образцов фукоиданов в агарозном геле, в который добавлен протамина сульфат. Зоны преципитации окрашенных комплексов полисахарид-белок имеют вид ракеток. Фукоиданы I и II, внесенные в гель в концентрации от 31 до 500 мкг/мл образуют комплексы с протамина сульфатом. Установлено, что чем больше концентрация, тем больше высота и площадь пика преципитации (рис. 6.1). Коэффициенты корреляции между высотой и площадью пиков преципитации в отношении как I, так и II образцов фукоиданов значительны и составляют г=0,97±0,05 (р=0,002) и г=0,98±0,07 (р=0,001), соответственно. Таким образом, фукоиданы способны создавать комплексы с известным для гепаринов антидотом — протамина сульфатом. Важной характеристикой препаратов, применяемых в качестве тромбо-литических средств является усиление фибринолиза. В связи с этим нами исследовано влияние фукоидана на систему фибринолиза в тесте спонтанного эуглобулинового лизиса, скорость которого отражает количество плаз-миногена и степень его активации в плазме, а также путем количественного определения плазминогена на основе гидролиза хромогенного субстрата, свидетельствующего о потенциальной активности плазминовой системы. Как известно, время лизиса эуглобулинов отражает активный потенциал плазминовой системы. Укорочение времени лизиса сгустка свидетельствует 144 об активации фибринолиза, а активация фибринолиза соответствует увеличению активности и количества плазминогена — неактивного предшественника плазмина — фермента, расщепляющего фибрин и ФГ (Баркаган, Момот, 2001; Макаров, Горбунова, 2003). В экспериментах invitroбыло установлено, что фукоидан во всем диапазоне исследуемых концентраций (10-1000 мкг/мл) способствовал возрастанию уровня основного компонента фибринолитической системы — плазминогена. Максимальное количество плазминогена (вдвое превышающее контрольные показатели, р<0,05) зарегистрировано при действии фукоидана в концентрации 1000 мкг/мл (табл. 6.4). Таблица 6.4 Влияние фукоидана из F. evanescensна уровень плазминогена в плазме доноров (in vitro)
Примечание: показатели Ме±т; ИС — индекс стимуляции — рассчитан как показателей в опыте и контроле; р — значимость различий показателей в опыте по сравнению с контролем по результатам дисперсионного анализа (*р<0,05); п=6; использован непараметрический Q-критерий Данна. Исследование показателей фибринолиза через 30 мин после однократного введения фукоидана мышам показало незначительное усиление скорости спонтанного эуглобулинового лизиса и увеличение уровня плазминогена в сыворотке крови по сравнению с контрольной группой (р<0,05). При 10-кратном введении фукоидана наблюдалась более интенсивная активации фибринолиза (р<0,05) и увеличение уровня плазминогена в 2,7 раза по сравнению с контролем (р<0,05) (табл. 6.5). 145 При исследовании уровня фибриногена (ФГ) в сыворотке крови у животных этой группы статистически значимых изменений не выявлено (р>0,05) (табл. 6.5). Таблица 6.5 Влияние фукоидана из F. evanescensна показатели фибринолитической системы и уровень фибриногена у мышей BALB/c в зависимости от кратности введения
Примечание: показатели гемостаза Ме<т; ИС — индекс стимуляции- рассчитан как отношение показателя в опыте к контролю; р-значимость различий показателей в опыте по сравнению с контролем; п=5; использован непараметрический Q-критерий Данна; р — значимость различий по результатам дисперсионного анализа (*р<0,05). Представленные результаты свидетельствуют о том, что фукоиданы, выделенные из бурых водорослей F. evanescensи S. cichorioid.es, обладают свойствами антикоагулянтов прямого типа действия. Исследование механизмов антикоагулянтной активности позволило установить эффективное влияние этих фукоиданов на факторы внутреннего и внешнего путей свертывания, а также на конечный этап свертывания или превращение фибриногена в фибрин под воздействием тромбина. Антикоагулянтная активность фукоидана из F. evanescensсвязана с плазменным AT III. Фукоидан, как и гепарин, превращает AT III из медленно действующего в быстродействующий ингибитор тромбина. Исследованные фукоиданы демонстрируют ингибиторную активность в отношении тромбина (фактора Па) и фактора Ха. При этом отмечено, что, несмотря на больший показатель соотношения aXa/alla для фукоидана из F. evanescens, сипа и длительность антикоагулянтного эффекта для фукоидана из S. cichorioid.esвыше. Это объясняется различием в удельной антитромбиновой активности образцов (у последнего alia 146 активность вдвое больше, чем у первого) при практически одинаковых ингибиторных активностях по отношению к фактору Ха. Полученные в экспериментах invitroи invivoрезультаты свидетельствуют, что фукоидан из F. evanescensотносится к препаратам, влияющим на систему коагуляционного гемостаза и фибринолиза как прямо, так и опосредованно. Влияние на систему фибринолиза осуществляется путем активации эндогенной фибринолитической системы крови и связано с повышением потенциальной активности плазминовой системы. Таким образом, исследуемые фукоиданы обладают свойствами антикоагулянтов и активаторов фибринолиза, в связи с чем имеют большие перспективы клинического применения в этом качестве. Результаты проведенных экспериментальных исследований позволили нам разработать гипотетическую схему механизмов действия фукоидана на систему гемостаза (рис. 6.2). Как показано на рис. 6.2, фукоидан оказывает прямое влияние на факторы внутреннего и внешнего путей свертывания, а также на конечный этап свертывания и демонстрирует ингибиторную активность в отношении тромбина (фактора Па) и фактора Ха. Антикоагулянтная активность фукоидана связана с плазменным антитромбином III, который превращается из медленно действующего в быстродействующий ингибитор тромбина. Влияние фукоидана на систему фибринолиза осуществляется путем активации эндогенной фибринолитической системы крови и связано с повышением потенциальной активности плазминовой системы. Механизм действия фукоидана на систему гемостаза ФУКОИДАН (прямое влияние) Внутренний механизм свертывания крови Внешний механизм свертывания крови фактор Ха (протромбиназа) (ингибирование активности) фактор На (тромбин) (ингибирование активности) 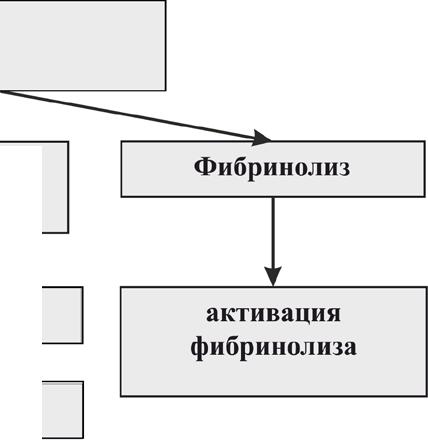 антитромбин III (AT-IH) (превращение AT-III из медленнодействующего в быстродействующий ингибитор тромбина) Антикоагулянтная активность, коррекция нарушений гемостаза, купирование явлений ДВС-синдрома Рис. 6.2. Гипотетическая схема механизма действия фукоидана на систему гемостаза 147 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
