шпора по анату. билеты с ответами-3. Билет 1 Изоферменты. Понятие. Биологическая роль. Примеры. Диагностическое значение определения изоферментов плазмы крови
 Скачать 0.96 Mb. Скачать 0.96 Mb.
|
Иммобилизованные ферменты. Общая характеристикаВ современной биотехнологии одно из видных мест принадлежит ферментам. Ферменты и ферментные системы широко используются в различных отраслях промышленности, медицине, сельском хозяйстве, химическом анализе и т.д. Ферменты - вещества белковой природы и поэтому неустойчивы при хранении, а также чувствительны к тепловым воздействиям. Кроме того, ферменты не могут быть использованы многократно из-за трудностей в отделении их от реагентов и продуктов реакции. Решить эти проблемы помогает создание иммобилизованных ферментов. Начало этому методу было положено в 1916 году, когда Дж.Нельсон и Е.Гриффин адсорбировали на угле инвертазу и показали, что она сохраняет в таком виде каталитическую активность. Сам термин "иммобилизованные ферменты узаконен в 1971 году, и означает любое ограничение свободы передвижения белковых молекул в пространстве. Преимущества иммобилизованных ферментов перед нативными предшественниками: 1. Гетерогенный катализатор легко отделим от реакционной среды, что дает возможность остановить реакцию в любой момент, использовать фермент повторно, а также получать чистый от фермента продукт. 2. Ферментативный процесс с использованием иммобилизованных ферментов можно проводить непрерывно, регулируя скорость катализируемой реакции и выход продукта. 3. Модификация фермента целенаправленно изменяет его свойства, такие как специфичность (особенно в отношении макромолекулярного субстрата), зависимость каталитической активности от рН, ионного состава и других параметров среды, стабильность к денатурирующим воздействиям. 4. Можно регулировать каталитическую активность иммобилизованных ферментов путем изменения свойств носителя действием физических факторов, таких как свет и звук. Иммобилизовать ферменты можно как путем связывания на нерастворимых носителях, так и путем внутримолекулярной или межмолекулярной сшивки белковых молекул низкомолекулярными бифункциональными соединениями, а также путем присоединения к растворимому полимеру. Носители для иммобилизованных ферментовДля получения иммобилизованных ферментов используется ограниченное число как органических, так и неорганических носителей. К носителям предъявляются следующие требования (Дж.Порат, 1974): - высокая химическая и биологическая стойкость; - высокая химическая прочность; - достаточная проницаемость для фермента и субстратов, пористость, большая удельная поверхность; - возможность получения в виде удобных в технологическом отношении форм (гранул, мембран); - легкая активация; - высокая гидрофильность; - невысокая стоимость. Классификация носителей схематично представлена на рисунке 4. 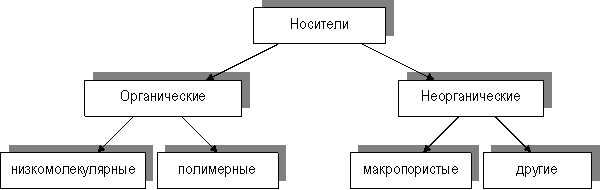 Рис. 4. Классификация носителей для иммобилизованных ферментов Следует отметить, что органические носители (как низко-, так и высокомолекулярные) могут быть природного или синтетического происхождения. Природные полимерные органические носители делят в соответствии с их биохимической классификацией на 3 группы: полисахаридные, белковые и липидные. Синтетические полимеры также можно разделить на группы в связи с химическим строением основной цепи макромолекул: полиметиленовые, полиамидные, полиэфирные. Для иммобилизации ферментов наиболее широко используются природные полисахариды и синтетические носители полиметильного типа, остальные применяются значительно реже. Большое значение природных полимеров в качестве носителей для иммобилизации объясняется их доступностью и наличием реакционно-способных функциональных групп, легко вступающих в химические реакции. Характерной особенностью этой группы носителей также является их высокая гидрофильность. Недостаток природных полимеров - неустойчивость к воздействию микроорганизмов и довольно высокая стоимость. Наиболее часто для иммобилизации используются такие полисахариды, как целлюлоза, декстран, агароза и их производные. Целлюлоза гидрофильна, имеет много гидроксильных групп, что позволяет модифицировать её, замещая эти группы. Для увеличения механической прочности целлюлозу гранулируют путем частичного гидролиза, в результате которого разрушаются аморфные участки. На их место для сохранения пористости между кристаллическими участками вводят химические сшивки. Гранулированную целлюлозу довольно легко превратить в различные ионообменные производные, такие как ДЭАЭ-целлюлоза, КМЦ и т.д. Широко распространены носители на основе декстрана, выпускаемые под названием "сефадексы". При высушивании они легко сжимаются, в водном растворе сильно набухают. В этих носителях размер пор в геле регулируется степенью сшитости. К группе декстранов относят и крахмал. Химически модифицированный крахмал сшивается агентами, такими как формальдегид. Таким способом был получен губчатый крахмал, обладающий повышенной устойчивостью по отношению к ферментам, гидролизу. Водорастворимые препараты на основе декстрана часто применяются как носители лекарственных средств в медицине. Хорошим носителем считается агар. Его свойства улучшаются после химической сшивки, например, диэпоксидными соединениями. Такой агар становится устойчивым к нагреванию, прочен, легко модифицируется. Белки в качестве носителей обладают рядом достоинств: вместительны, способны к биодеградации, могут применяться в качестве тонкой (толщиной 80 мкм) мембраны. Иммобилизацию ферментов на белковых носителях можно проводить как в отсутствие, так и в присутствии сшивающих агентов. Белки используются и в фундаментальных биологических исследованиях, и в медицине. К недостаткам белков в качестве носителей относят их высокую иммуногенность (за исключением коллагена и фибрина). Наиболее для иммобилизации используются структурные (кератин, фибрин, коллаген), двигательные (миозин) и транспортные (альбумин) белки. Синтетические полимерные носители применяются для ковалентной и сорбционной иммобилизации ферментов, для получения гелей, микрокапсул. Полимеры на основе стирола применяются сорбционной иммобилизации. Они могут иметь макропористую, изопористую структуру, а также гетеропористую структуру. Для получения полимерных гидрофильных носителей широко используется акриламид - производное акриловой кислоты. Широкое распространение получил метод включения ферментов и клеток в полиакриламидный гель, имеющий жесткую пространственную сетчатую структуру. Полиакриламидный гель устойчив к химическим воздействиям. Очень интересную группу представляют полиамидные носители. Это группы различных гетероцепных полимеров с повторяющейся амидной группой -С(О)-NH-. Например, полимеры на основе N-винилпирролидона используются для получения иммобилизованных ферментов, способных медленно распадаться в организме. Кроме того, они биологически инертны, что особенно важно при использовании в медицинских целях. Существенным недостатком большинства полимерных носителей является их способность накапливаться в организме. В этом отношении предпочтение отдается природным полимерам, которые гидролизуются ферментами. Поэтому в состав лекарственных препаратов часто входит декстран, а из синтетических носителей - полимеры на основе N-винилпирролидона. В настоящее время ведутся эксперименты по созданию синтетических полимеров, расщепляющихся с образованием нетоксичных продуктов обмена. Пути образования, расходования и обезвреживания аммиака. В организме человека подвергается распаду около 70г аминокислот в сутки: при этом освобождается большое количество аммиака, являющегося высокотоксичным соединением. Поэтому крнцентрация аммиака должна сохраняться на низком уровне (в норме уровень его не превышает 60 мкмоль/л). Концентрация аммиака 3 ммоль/л является летальной. Одним из путей связывания и обезвреживания аммиака в мозге, сетчатке, почках и мышцах, является биосинтез глутамина( и, возможно, аспарагина). Поскольку глутамин и аспарагин с мочой выделяются в небольших количествах, было высказано предположение, что они выполняют скорее транспортную функцию переноса аммиака в нетоксичной форме. Часть аммиака легко связывается с α-кетоглутаровой кислотой благодаря обратимости глутаматдегидрогеназной реакции; при синтезе глутамина связывается ещё 1 молекула, т.о. нейтрализуются две молекулы аммиака: Орнитиновый цикл мочевинообразования. Основным механизмом обезвреживания аммиака в организме является биосинтез мочевины (в основном,в печени).Она выводится с мочой в качестве главного конечного продукта белкового, соответственно аминокислотного, обмена. На долю мочевины приходится до 80-85% всего азота мочи. Реакции синтеза мочевины, представлены в виде цикла, получившего название орнитинового цикла мочевинообразования Кребса. · На первом этапе синтезируется макроэргическое соединение карбамоилфосфат – это метаболически активная форма аммиака, используемая в качестве исходного продукта для синтеза ряда других азотистых соединений. · На втором этапе цикла мочевинообразования происходит конденсация карбамоилфосфата и орнитина с образованием цитруллина; реакцию катализирует орнитинкарбамоилтрансфераза: На следующей стадии цитруллин превращается в аргинин в результате двух последовательно протекающих реакций. Первая из них, энергозависимая, сводится к конденсации цитруллина и аспаргиновой кислоты с образованием аргининосукцината ( эту реакцию катализирует аргининосукцинат-синтетаза). Аргининсукцинат распадается во второй реакции на аргинин и фумарат поддействием аргининосукцинат-лиазы. На последнем этапе аргинин расщепляется на мочевину и орнитин под действием аргиназы. Суммарная реакция синтеза мочевины без учёта промежуточных продуктов: Это энергетически выгодная реакция, поэтому процесс всегда протекает в направлении синтеза мочевины. В состоянии азотистого равновесия организм человека потребляет и соответственно выделяет примерно 15 г азота в сутки; из экскретируемого с мочой количества азота на долю мочевины приходится около 85% , креатинина- около 5%, аммонийных солей – 3%, мочевой кислоты-1% и на другие формы-около 6%. 3. При обследовании больного обнаружено: общий белок плазмы крови 46 г/л, проба Вельтмана 0,2, снижено количество протромбина. В крови снижена активность псевдохолинэстеразы. С патологией какого органа связаны обнаруженные изменения? Обоснуйте. Ответ. Печень. Гепатит или цирроз. ПхЭ - секреторный фермент. Белок понижен. П.в. понижена.протромбин и остальные исслед-е вещества обр-ся гепатоцитами. |
