|
|
шпора по анату. билеты с ответами-3. Билет 1 Изоферменты. Понятие. Биологическая роль. Примеры. Диагностическое значение определения изоферментов плазмы крови
В основе многих заболеваний лежат нарушения функционирования ферментов в клетке – энзимопатии. Приобретённые энзимопатии, как и вообще протеинопатии, по-видимому, наблюдают при всех болезнях.
При первичных энзимопатиях дефектные ферменты наследуются, в основном, по аутосомно-рецессивному типу. Гетерозиготы, чаще всего, не имеют фенотипических отклонений. Первичные энзимопатии обычно относят к метаболическим болезням, так как происходит нарушение определённых метаболических путей. При этом развитие заболевания может протекать по одному из ниже перечисленных «сценариев». Рассмотрим условную схему метаболического пути:
Е1 Е2 Е3 Е4
А → В → С → D → Р
Вещество А в результате последовательных ферментативных реакций превращается в продукт Р. При наследственной недостаточности какого-либо фермента, например фермента Е3, возможны разные нарушения метаболических путей:
Нарушение образования конечных продуктов. Недостаток конечного продукта этого метаболического пути (при отсутствии альтернативных путей синтеза) может приводить к развитию клинических симптомов, характерных для данного заболевания.
Клинические проявления. В качестве примера можно рассмотреть альбинизм. При альбинизме нарушен синтез в меланоцитах пигментов – меланинов. Меланин находится в коже, волосах, радужке, пигментном эпителии сетчатки глаза и влияет на их окраску. При альбинизме наблюдают слабую пигментацию кожи, светлые волосы, красноватый цвет радужки глаза из-за просвечивающих капилляров. Проявление альбинизма связано с недостаточностью фермента тирозингидроксилазы (тирозиназы) – одного из ферментов, катализирующего метаболический путь образования меланинов.
Накопление субстратов-предшественников. При недостаточности фермента будут накапливаться определенные вещества, а также во многих случаях и предшествующие им соединения. Увеличение субстратов-предшественников дефектного фермента – ведущее звено развития многих заболеваний.
Клинические проявления. Известно заболевание алкаптонурия, при котором нарушено окисление гомогентизиновой кислоты в тканях (гомогентизиновая кислота – промежуточный метаболит катаболизма тирозина). У таких больных наблюдают недостаточность фермента окисления гомогентизиновой кислоты – диоксигеназы гомогентизиновой кислоты, приводящей к развитию заболевания. В результате увеличиваются концентрация гомогентизиновой кислоты и выведение её с мочой. В присутствии кислорода гомогентизиновая кислота превращается в соединение чёрного цвета – алкаптон. Поэтому моча таких больных на воздухе окрашивается в чёрный цвет. Алкаптон также образуется и в биологических жидкостях, оседая в тканях, коже, сухожилиях, суставах. При значительных отложениях алкаптона в суставах нарушается их подвижность.
Нарушение образования конечных продуктов и накопление субстратов-предшественников. Отмечают заболевания, когда одновременно недостаток продукта и накопление исходного субстрата вызывают клинические проявления.
Клинические проявления. Например, у людей с болезнью Гирке (гликогеноз I типа) наблюдают снижение концентрации глюкозы в крови (гипогликемия) в перерывах между приёмами пищи. Это связано с нарушением распада гликогена в печени вследствие дефекта фермента глюкозо-6-фосфатазы. Одновременно у таких людей увеличиваются размеры печени (гепатомегалия) вследствие накопления в ней не используемого гликогена.
Особый интерес для клиники представляет исследование активности индикаторных ферментов в сыворотке крови, так как по появлению в плазме или сыворотке крови ряда тканевых ферментов в повышенных количествах можно судить о функциональном состоянии и поражении различных органов (например, печени, сердечной и скелетной мускулатуры). При остром инфаркте миокарда особенно важно исследовать активность креатинкиназы, АсАТ, ЛДГ и оксибутиратдегидрогеназы.
При заболеваниях печени, в частности при вирусном гепатите (болезнь Боткина), в сыворотке крови значительно увеличивается активность АлАТ и АсАТ, сорбитолдегидрогеназы, глутаматдегидрогеназы и некоторых других ферментов. Большинство ферментов, содержащихся в печени, присутствуют и в других органах тканей. Однако известны ферменты, которые более или менее специфичны для печеночной ткани. К таким ферментам, в частности, относится γ-глутамилтранспептидаза, или γ-глутамилтрансфе-раза (ГГТ). Данный фермент – высокочувствительныйиндикатор при заболеваниях печени. Повышение активности ГГТ отмечается при остром инфекционном или токсическом гепатите, циррозе печени, внутрипеченоч-ной или внепеченочной закупорке желчных путей, первичном или метастатическом опухолевом поражении печени, алкогольном поражении печени. Иногда повышение активностиГГТ наблюдается при застойной сердечной недостаточности, редко – после инфаркта миокарда, при панкреатитах, опухолях поджелудочной железы.
Факторы, определяющие уровень ферментов плазмы в норме.
Метаболизм ферментов складывается из их синтеза, функционирования и распада. Эти процессы идут непрерывно и одновременно и обеспечивают определённый уровень активности ферментов в тканях. Как было отмечено выше, активность нефункцональных ферментов плазмы крови в норме небольшая. Однако количество таких ферментов значительно увеличивается при повреждении мембран клеток, их усиленной пролиферации или гибели (рис. 5.2.1).
Многие факторы способны повышать проницаемость мембран и таким образом вызывать появление внутриклеточных ферментов в плазме. К таким факторам относятся недостаток притока кислорода в клетку, снижение концентрации глюкозы в крови, присутствие многих лекарственных и химических веществ, блокирующих гликолиз, работу ЦТК и окислительное фосфорилирование. Патогенные бактерии, бактериальные токсины и вирусы воздействуют непосредственно на мембрану. Кроме того, существуют генетически обусловленные нарушения структуры мембран. Утечка ферментов, то есть выход внутриклеточных ферментов в кровь, может быть обратимой или прогрессировать до необратимой стадии.
При выделении ферментов скорость их появления в крови зависит от трёх основных факторов. Прежде всего, от градиента концентрации, обеспечивающего движение ферментов через мембрану. Величина его различна для разных ферментов и типов тканей. Например, активность ЛДГ в клетках печени примерно в 3000 раз, в эритроцитах – в 200 раз выше, алкогольдегидрогеназы – в 20000, аспартат- и аланинаминотрансфераз – в 10000 раз выше, чем в плазме крови. Чем выше градиент, тем быстрее фермент появляется в крови. Второй фактор – размер молекул фермента. Более мелкие молекулы диффундируют с большей скоростью, чем крупные, и выделяются на ранней стадии повреждения мембраны. Третий фактор – внутриклеточная локализация ферментов. В первую очередь в плазму выходят цитоплазматические ферменты, а при некрозе клетки, когда разрушаются внутриклеточные органеллы, – и митохондриальные. Примером может служить увеличение в крови активности аспартатаминотрансферазы (АсАт). И цитоплазматическая, и митохондриальная форма фермента имеет одинаковую молекулярную массу, а митохондриальная выходит в кровь значительно медленнее.
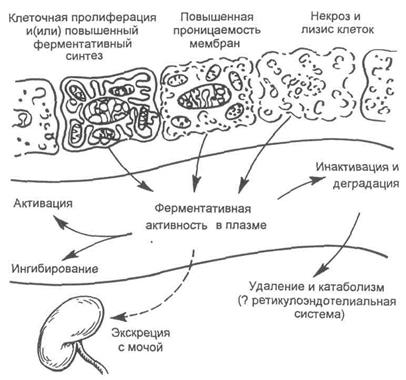
Рис. 5.2.1. Факторы, влияющие на активность ферментов в плазме крови
Кроме этого, изменение активности ферментов в сыворотке крови может быть обусловлено присутствием во внеклеточной жидкости активаторов или ингибиторов ферментов, обструкцией (непроходимостью) путей секреции ферментов в полости, а также удалением ферментов из циркуляторного русла.
О механизмах удаления ферментов из системы циркуляции известно мало. Большинство ферментов, по-видимому, катаболизируются плазменными протеазами и удаляется ретикулоэндотелиальной системой. Часть ферментов выделяется со слюной, желчью и другими секреторными жидкостями. Через почечный фильтр выводятся небольшие молекулы с Mr не более 60-70 кДа, поэтому в норме, количество экскретируемых ферментов невелико. Например, фермент амилаза имеет Mr = 48кДа и может выводиться почками.
Нужно отметить, что наиболее важными, с диагностической точки зрения, являются те изменения, которые возникают в результате нарушения скорости образования специфических ферментов вследствие либо повышения их синтеза клетками, либо увеличения количества таких клеток. Имеет значение также увеличение количества ферментов в крови, связанное с выделением их из повреждённых или мёртвых клеток.
3. При длительном голодании белки скелетных мышц используются в качестве источника энергии. Перечислите, какие превращения должны произойти с этими белками и продуктами их распада в скелетных мышцах и в печени, прежде чем сердечная мышца и мозг смогут использовать энергию их распада.
При длительном голодании происходит:
1) распад мышечных белков в самих мышцах;
2) транспорт аминокислот в печень, так как распад их идет только в печени;
3) распад аминокислот в печени и образование из них глюкозы (глюконеогенез);
4) транспорт глюкозы в жизненно важные органы – мозг и миокард.
Билет № 22
Глюкокортикоидные гормоны. Химическая природа. Основные направления стероидогенеза и катаболизма. Транспорт. Механизм действия на клетки-мишени. Влияние на обмен веществ.
Основным глюкокортикоидным гормоном у человека является гидрокортизон (кортизол). Суточная секреция кортизола составляет 15-30 мг и обладает выраженным суточным ритмом. Пик максимального уровня кортизола приходится на ранние утренние часы (6-8 часов утра), а минимальное его содержание отмечается в ночные часы (0-4 часа). Кортизол в плазме присутствует в трех видах: свободном, связанном с белком и в виде метаболитов. В норме на долю свободного, биологически активного кортизола приходится около 5% его количества, присутствующего в крови. Приблизительно 90% кортизола связываются специфическим белком (а2-глобулином) - транскортином, обладающим высоким средством к гормону и низкой емкостью. Менее 5% кортизола связывается белком с низким сродством и высокой емкостью - альбумином. Необходимо отметить, что именно от количества свободного кортизола зависит его биологическая активность, проявляющаяся в непосредственном воздействии на ткани. Физиологическое действие глюкокортикоидов на межуточный обмен включает регуляцию метаболизма белков, углеводов, липидов и нуклеиновых кислот. Большинство эффектов глюкокортикоидов имеет в основном катаболическую направленность и характеризуется ускорением распада белка и повышением экскреции азота. Глюкокортикоиды увеличивают содержание гликогена в печени и способствуют синтезу глюкозы в ней (глюконеогенез). Такое действие объясняется, главным образом, мобилизацией аминокислотных предшественников гликогена из периферических опорных структур, таких как кости, кожа, мышцы и соединительная ткань, вследствие усиления распада белка (катаболический эффект), а также торможения его синтеза и поглощения аминокислот этими тканями (антианаболический эффект). Вызываемая глюкокортикоидами гипераминоацидемия способствует глюконеогенезу и за счет стимуляции секреции глюкагона. Однако глюкокортикоиды не во всех тканях оказывают катаболическое действие. Так, в печени они стимулируют синтез некоторых ферментов, таких как тирозинаминотрансфераза и триптофанпирролаза. В большинстве тканей кортикоиды ингибируют синтез нуклеиновых кислот, но в печени синтез рибонуклеиновой кислоты возрастает. Кроме того, глюкокортикоиды регулируют мобилизацию жирных кислот, повышая активирующее действие жиромобилизирующих гормонов (катехоламинов, гипофизарных пептидов) на клеточную липазу. Глюкокортикоиды (кортизол) по-разному влияют на структурный белок и жировую ткань разных частей тела. Например, фармакологические дозы кортизола уменьшают содержание белкового матрикса в позвонках (трабекулярная кость), но в минимальной степени действуют на длинные трубчатые кости, имеющие преимущественно плотное строение); периферические жировые депо могут истощаться, тогда как в области живота и между лопаток жир накапливается. Глюкокортикоиды обладают мощным противовоспалительным действием, которое связано с их влиянием на микрососуды, клетки и продукцию клетками медиаторов воспаления. Одним из основных компонентов воспалительного процесса в бронхах и легких является повышение проницаемости сосудов микроваскулярного русла, пропотевание жидкой части плазмы в межклеточное пространство и формирование воспалительного отека. Экспериментальные исследования на грызунах показали, что вводимые внутривенно или местно глюкокортикоиды ингибируют вызванную медиаторами воспаления повышенную проницаемость микрососудов. Этот эффект обусловлен как прямым стабилизирующим действием глюкокортикоидов на эндотелий сосудов, так и повышением чувствительности сосудистой стенки к прессорным агентам, например катехоламинам (пермиссивное действие глюкокортикоидов). Глюкокортикоиды угнетают также повышение проницаемости сосудов, вызванное нейрогенным воспалением в бронхах. Предполагается, что это происходит благодаря повышению активности нейтральной эндопептидазы, которая угнетает высвобождение тахикининов из чувствительных нервных окончаний.
Кроме того, глюкокортикоиды действуют не только на подвижность лейкоцитов, но и также на различные их функции. Установлено, что они повышают синтез адренорецепторов, вследствие чего усиливается адренергический ответ, активизируется аденилатциклаза, усиливается синтез ц-АМФ. Глюкокортикоиды также ингибируют дегрануляцию макрофагов, базофилов и тучных клеток, что доказано пока в экспериментах на животных.
Переваривание белков и всасывание аминокислот. Азотистый баланс и азотистое равновесие. Биологическая ценность белков.
Все пищевые белки, состоящие из длинной цепи аминокислот, не способны всасываться в желудочно-кишечном тракте. Они расщепляются на свободные аминокислоты или фрагменты, состоящие из 2 или 3 аминокислот. Расщепление белков катализируют специфические пищеварительные ферменты протеазы.Степень перевариваемости белков колеблется от 65% для некоторых растительных белков до 97% для белка яиц.
Свободные аминокислоты всасываются в кровоток и транспортируются в органы и ткани, в первую очередь в печень. Наибольшее количество аминокислот захватывается печенью, где синтезируются белки плазмы крови и специфические белки-ферменты. Аминокислоты, не участвующие в биосинтезе новых белковых молекул, подвергаются в печени процессу дезаминирования, т.е. отщеплению аминогруппы. В процессах дезаминирования участвуют активные формы витамина В6.
Азотсодержащий остаток аминокислот превращается в мочевину и экскретируется с мочой. Не содержащая азота часть молекулы аминокислот превращается в углеводы или жиры и окисляется для образования энергии или запасается в виде жира.
В организме человека отсутствует большое депо для запасания белков. Отчасти функцию депо выполняют белки плазмы крови и печени. Альбумин плазмы крови служит лабильным резервом белка, и для обеспечения жизненно необходимой потребности в аминокислотах происходит его расщепление. Глобулины плазмы крови не подвергаются расщеплению даже при истощении запасов альбумина.
Животные и растительные белки усваиваются организмом неодинаково. Если белки молока, молочных продуктов, яиц усваиваются на 96%, мяса и рыбы - на 93-95%, то белки хлеба - на 62-86%, овощей - на 80%, картофеля и некоторых бобовых - на 70%.
Однако смесь этих продуктов может быть биологически более полноценной в силу взаимного обогащения одних белков аминокислотами других.
На степень усвоения организмом белков оказывают влияние технология получения пищевых продуктов и их кулинарная обработка. Анализируя воздействие различных видов обработки пищевого сырья и продуктов (измельчение, действие температуры, брожение и т.д.) на усвояемость содержащихся в них белков, следует отметить, что в большинстве пищевых производств при соблюдении технологии не происходит деструкции аминокислот. При умеренной тепловой обработке пищевых продуктов, особенно растительного происхождения, усвояемость белков несколько возрастает, так как частичная денатурация белков облегчает доступ протеаз к пептидным связям. При интенсивной тепловой обработке усвояемость снижается. При глубоком жареньи с образованием корочки и обугливании часть аминокислот разрушается или снижается усвоение белка из этих частей блюда или продукта.
Азотистый баланс
Конечные продукты метаболизма азота выделяются с мочой в виде мочевины (85-90% азота), мочевой кислоты, креатинина.
Азотистое равновесие наступает, когда величина потребления азота с пищей равна величине суммарных потерь азота. В этом случае организм получает достаточно белка для восполнения эндогенных затрат, но при этом не обеспечивается рост тканей, если он необходим. Азотистое равновесие у практически здоровых взрослых свидетельствует о достаточной обеспеченности организма белком.
Когда потребление азота с пищей превышает потери азота с калом, мочой и другими путями, то это состояние характеризуется положительным азотистым балансом,который свидетельствует о процессах роста тканей. Положительный азотистый баланс должен обеспечиваться у детей и подростков, при беременности. Его также необходимо поддерживать в период выздоровления от болезней и травм, при которых наблюдались потери азота.
Отрицательный азотистый баланссвидетельствует о том, что потери азота превышают его потребление с пищей. Отрицательный азотистый баланс наблюдается в случаях усиленного распада тканей даже при нормальном потреблении белка (азота) с пищей. Длительный отрицательный азотистый баланс приводит к потере массы тела, в первую очередь мышечной метаболически активной массы тела, и в конце концов сопровождается гибелью организма.
Потребность в белке здорового человека изменяется в зависимости от возраста, пола, физиологического состояния (беременность, кормление грудью), уровня физической активности. Физиологическая потребность в белке у взрослых составляет 0,75 г/кг массы тела. При этом имеются в виду белки высокой биологической ценности и усвояемости - белки яиц, мяса, молока, близкие по биологической ценности к «идеальному» белку. При потреблении смешанного растительно-животного рациона потребность в белке составляет около 0,85-1,0 г/кг массы тела. Увеличение потребности связано со снижением перевариваемости и усвояемости белка в желудочно-кишечном тракте. Рекомендуемые величины потребления белка должны удовлетворять потребность практически всех здоровых людей, а также содержать добавку на непредвиденные экстренные потребности в белке (стресс, заболевания). Однако потребление белка в количестве, превышающем 1,5 г/кг массы тела, считается нежелательным, а в количестве 2 г/кг и более - вредным
Почему больному, принявшему длительный курс стероидотерапии, опасно делать операцию в полости рта?
Побочные эффекты от длительного приема пероральных стероидов хорошо изучены. К ним относят потерю костной массы (остеопороз)-интенсивное вымывание кальция, гипертензию, склонность к образованию синяков и атрофию мышечной ткани.
Билет № 23
Глюкокортикоидные гормоны. Изменения в обмене при гипо- и гиперкортицизме. Возможные проявления гиперкортицизма со стороны тканей полости рта.
Основным глюкокортикоидным гормоном у человека является гидрокортизон (кортизол). Суточная секреция кортизола составляет 15-30 мг и обладает выраженным суточным ритмом. Пик максимального уровня кортизола приходится на ранние утренние часы (6-8 часов утра), а минимальное его содержание отмечается в ночные часы (0-4 часа). Кортизол в плазме присутствует в трех видах: свободном, связанном с белком и в виде метаболитов. В норме на долю свободного, биологически активного кортизола приходится около 5% его количества, присутствующего в крови. Приблизительно 90% кортизола связываются специфическим белком (а2-глобулином) - транскортином, обладающим высоким средством к гормону и низкой емкостью. Менее 5% кортизола связывается белком с низким сродством и высокой емкостью - альбумином. Необходимо отметить, что именно от количества свободного кортизола зависит его биологическая активность, проявляющаяся в непосредственном воздействии на ткани. Физиологическое действие глюкокортикоидов на межуточный обмен включает регуляцию метаболизма белков, углеводов, липидов и нуклеиновых кислот. Большинство эффектов глюкокортикоидов имеет в основном катаболическую направленность и характеризуется ускорением распада белка и повышением экскреции азота. Глюкокортикоиды увеличивают содержание гликогена в печени и способствуют синтезу глюкозы в ней (глюконеогенез). Такое действие объясняется, главным образом, мобилизацией аминокислотных предшественников гликогена из периферических опорных структур, таких как кости, кожа, мышцы и соединительная ткань, вследствие усиления распада белка (катаболический эффект), а также торможения его синтеза и поглощения аминокислот этими тканями (антианаболический эффект). Вызываемая глюкокортикоидами гипераминоацидемия способствует глюконеогенезу и за счет стимуляции секреции глюкагона. Однако глюкокортикоиды не во всех тканях оказывают катаболическое действие. Так, в печени они стимулируют синтез некоторых ферментов, таких как тирозинаминотрансфераза и триптофанпирролаза. В большинстве тканей кортикоиды ингибируют синтез нуклеиновых кислот, но в печени синтез рибонуклеиновой кислоты возрастает. Кроме того, глюкокортикоиды регулируют мобилизацию жирных кислот, повышая активирующее действие жиромобилизирующих гормонов (катехоламинов, гипофизарных пептидов) на клеточную липазу. Глюкокортикоиды (кортизол) по-разному влияют на структурный белок и жировую ткань разных частей тела. Например, фармакологические дозы кортизола уменьшают содержание белкового матрикса в позвонках (трабекулярная кость), но в минимальной степени действуют на длинные трубчатые кости, имеющие преимущественно плотное строение); периферические жировые депо могут истощаться, тогда как в области живота и между лопаток жир накапливается. Глюкокортикоиды обладают мощным противовоспалительным действием, которое связано с их влиянием на микрососуды, клетки и продукцию клетками медиаторов воспаления.
Гиперкортиц..Патогенез
В основе патогенеза патологических изменений, которые развиваются при синдроме Кушинга со стороны большинства органов и систем, лежит в первую очередь гиперпродукция кортизола. Кортизол в нефизиологических концентрациях оказывает катаболическое действие на белковые структуры и матрицы большинства тканей и структур (кости, мышцы, в том числе гладкие и миокард, кожа, внутренние органы и т. п.), в которых постепенно развиваются выраженные дистрофические и атрофические изменения. Нарушения углеводного обмена заключаются в стойкой стимуляции глюконеогенеза и гликогенолиза в мышцах и печени, что приводит к гипергликемии (стероидный диабет). Сложным образом меняется жировой обмен: на одних участках тела происходит избыточное отложение, а на других — атрофия жировой клетчатки, что объясняется разной чувствительностью отдельных жировых отделов к глюкокортикоидам. Важным компонентом патогенеза синдрома Кушинга являются электролитные расстройства (гипокалиемия, гипернатриемия), которые обусловлены влиянием избытка кортизола на почки. Прямым следствием этих электролитных сдвигов является артериальная гипертензия и усугубление миопатии, в первую очередь кардиомиопатии, которая приводит к развитию сердечной недостаточности и аритмиям. Иммуносупрессивное действие глюкокортикоидов обусловливает склонность к инфекциям.
Витамин В6. Источники, потребность. Активные формы. Биохимические функции. Нарушения обмена при недостаточности. Проявления.
Витамин В6 включает группу трех природных производных пиридина, обладающих одинаковой витаминной активностью: пиридоксина, пиридоксаля, пиридоксамина, отличающихся друг от друга наличием соответственно спиртовой, альдегидной или аминогруппы.
Витамином В6 богаты бобовые, зерновые культуры, мясные продукты, рыба, картофель. Он синтезируется кишечной микрофлорой, частично покрывая потребность организма в этом витамине. В сутки человек должен получать 2—2,2 мг пиридоксина. Потребность в витамине возрастает при увеличении количества белка в рационе, а также во время беременности и лактации. Прием алкоголя и курение уменьшают содержание пиридоксальфосфата в тканях.
Биохимические функции. Витамин В6 часто называют «королем обмена аминокислот»; вместе с тем его коферментные формы участвуют в реакциях, катализируемых почти всеми классами ферментов. Механизм действия всех пиридоксальфосфатзависимых ферментов сходен: I) вначале образуются шиффовы основания между аминокислотой и коферментом, 2) будучи неустойчивыми, шиффовы основания (альдимины) далее модифицируются в процессах трансаминирования, декарбоксилирования, изомеризации и во многих других превращениях боковой цепи аминокислот.
Коферментные формы витамина В6 входят в состав следующих ферментов:
• аминотраисфераз аминокислот, катализирующих обратимый перенос NH2-группы от аминокислоты на α-кетокислоту, при этом образуются новые α-кетокислоты и заменимые аминокислоты;
• декарбоксилаз аминокислот^ отщепляющих карбоксильную группу аминокислот, что приводит к образованию биогенных аминов (гистамина, серотонина, ГАМК и других), а также моноаминоксидаз, гистаминазы (диаминооксидаза) и аминотрансферазы ГАМК, обезвреживающих (окисляющих) биогенные амины;
• изомераз аминокислот,, с помощью которых организм разрушает D-аминокислоты (в состав тканевых белков млекопитающих входят L-аминокислоты);
• аминотраисфераз иодтирозипов и иодтиронинов, участвующих в синтезе гормонощитовидной железы и распаде этих гормонов в периферических тканях;
• синтазы дельта-аминолевуленовой кислоты* участвующей в биосинтезе гема гемоглобина и других гемсодержащих белков (из глицина и сукцинилКоА);
• кинурениназы и кинуренинаминотрансферазы, обеспечивающих синтез витамина РР из триптофана;
• цистатионинсинтазы (а) и цистатионинлиазы (б) — ферментов, катализирующих синтез и распад цистатионина.
• синтетазы 3-кетодигидросфингозида, участвующей в реакциях биосинтеза сфинголипидов (из серина и пальмитил-КоА).
Таким образом, витамин В6 характеризуется исключительно широким спектром биологического действия. Он принимает участие в регуляции белкового, углеводного и липидного обмена, биосинтезе гема и биогенных аминов, гормонов щитовидной железы и других биологически активных соединений. Помимо каталитического действия, пиридоксальфосфат участвует в процессе активного транспорта некоторых аминокислот через клеточные мембраны, ему присуша функция регулятора конформационного состояния гликогенфосфорилазы — главного регулируемого фермента, осуществляющего распад гликогена.
Гиповитаминоз витамина B6. Основными проявлениями является повышенная возбудимость и склонность к судорогам, что объясняется недостаточным образованием ГАМК (гамма-аминомасляной кислоты) — медиатора торможения нейронов. Поражения кожи частично обусловлены недостаточностью витамина РР, в синтезе которого принимает участие витамин В6.
Недостаток в полости рта.
Недостаточность витамина В6 развивается при его дефиците в продуктах питания, а также при нарушении его синтеза микрофлорой кишечника. Формированию эндогенной недостаточности пиридоксина способствуют кишечные инфекции, болезни печени, токсикоз беременных, длительная аптибиотикотерапия и др. Проявляется анемичность слизистой.
Часто наблюдается ангулярный хейлит (заеды), стоматит (воспаление слизистой).
Поражение языка характеризуется атрофией и очаговым отслоением (десквамация) сосочков (глоссит). Иногда наблюдается полированный язык, складчатость языка, боли в языке.
Наблюдается извращение и понижение вкусовой чувствительности.
3. Напишите уравнения реакций, способных привести к образованию g-аминомасляной кислоты, если исходными субстратами являются аланин и a-кетоглутаровая кислота.
Билет № 24
Основные этапы обмена холестерина. Превращение в желудочно-кишечном тракте. Всасывание, транспорт, биосинтез. Биологическая роль.
Холестерин в организме человека бывает 2 видов: 1) холестерин, поступающий с пищей через ЖКТ и называемый экзогенный и 2) холестерин, синтезируемый из Ац – КоА - эндогенный.
С пищей ежедневно поступает ≈ 0,2 – 0,5 г, синтезируется ≈ 1 г (почти все клетки за исключением эритроцитов синтезируют холестерин, 80% холестерина синтезируется в печени.
Всасывание холестерина происходит в основном в тощей кишке (пищевой холестерин всасывается почти полностью – если в пище его не очень много), холестерин желчи всасывается примерно на 50% - остальное экскретируется.
Всасывание холестерина осуществляется только после эмульгирования эфиров холестерина. Эмульгаторами являются желчные кислоты, моно- и диглицериды и лизолецитины. Холестериды гидролизуются холестеринэстеразой поджелудочной железы.
Пищевой и эндогенный холестерин находится в просвете кишечника в неэстерифицированной форме в составе сложных мицелл (желчные, жирные кислоты, лизолецитин), причем поступают в состав слизистой кишечника не вся мицелла целиком, а ее отдельные фракции. Сорбцил холестерина из мицелл – пассивный процесс, идущий по градиенту концентрации. Поступивший в клетки слизистой холестерин этерифицируется холестеринэстеразой или АХАТ (у человека это в основном олеиновая кислота). Из клеток слизистой кишечника холестерин поступает в лимфу в составе АОНП и ХМ, из них он переходит в ЛНП и ЛВП. В лимфе и крови 60-80% всего холестерина находится в этерифицированном виде.
Процесс всасывания холестерина из кишечника зависит от состава пищи: жиры и углеводы способствуют его всасыванию, растительные стероиды (структурные аналоги) блокируют этот процесс. Большое значение принадлежит желчным кислотам (все функции активируют – улучшают эмульгирование, всасывание). Отсюда значение лекарственных веществ, блокирующих всасывание желчных кислот.
Резкое повышение холестерина в пище ( до 1,5 г ежедневно) может сопровождаться некоторой гиперхолестеринемией у здоровых людей.
Биосинтез холестерина
Клетки печени синтезируют ≈ 80% всего холестерина, примерно 10% холестерина синтезируется в слизистой кишечника. Холестерин синтезируется не только для себя, но и на «экспорт».
Митохондрии являются держателем субстрата для синтеза холестерина. Ацетил-КоА выходит в виде цитрата и ацетоацета.
Синтез холестерина идет в цитоплазме и включает 4 стадии.
1 стадия – образование мевалоновой кислоты:
2 стадия – образование сквалена (30 атом С)
Эта стадия (как и 1) начинается в водной фазе клетки, а заканчивается в мембране эндоплазматического ретикулума образованием водо-нерастворимого сквалена.
Затрачивается 6 молей мевалоновой кислоты, 18 АТФ, НАДФ НН с образованием цепочечной структуры из 30 С – сквалена.
3 стадия – циклизация сквалена в ланостерин.
4 стадия – превращение ланостерина в холестерин.
Холестерин – циклический ненасыщенный спирт. Содержит ядро циклопентан-пергидрофенантрена.
Регуляция биосинтеза холестерина
При высоком содержании холестерина, он угнетает активность фермента β -гидрокси- β -метилурацил-КоА-редуктазы и синтез холестерина тормозится на стадии образования мевалоновой кислоты – это первая специфическая стадия синтеза. β -гидрокси- β -метилурацил-КоА, не пошедший на синтез холестерина может пойти на синтез кетоновых тел. Это регуляция по типу обраьной отрицательной связи.
Транспорт холестерина
В плазме крови здоровых людей содержится 0,8 – 1,5 г/л ЛОНП, 3,2 – 4,5 г/л ЛНП и 1,3 – 4,2 г/л ЛВП.
Липидный компонент практически всех ЛП представлен наружной оболочкой, которая образована монослоем ФЛ и холестерина и внутренним гидрофобным ядром, состоящим из ТГ и холестеридов. Кроме липидов ЛП содержат белок – аполипопротеиды А, В или С. Свободный холестерин, находящийся на поверхности ЛП, легко обменивается между частицами: меченый холестерин, введенный в плазму в составе одной группы ЛП, быстро распределяется между всеми группами.
ХМ формируются в эпителиальных клетках кишечника, ЛОНП и ЛВП независимо друг от друга образуются в гепатоцитах.
ЛП обмениваются своим холестерином с мембранами клеток, особенно интенсивный обмен идет между ЛП и гепатоцитами, на поверхности которых есть рецепторы для ЛПНП. Процесс переноса холестерина в гепатоциты требует энергии.
2. Структура и биохимический состав костной ткани. Регуляция метаболизма. Особенности строения и состава тканей зуба. Нарушения структуры кости.
Клеточными элементами костной ткани являются остеобласты, остеоциты и остеокласты.
Остеобласт – клетка костной ткани, участвующая в образовании межклеточного вещества. Отличительной чертой остеобластов является наличие сильно развитого эндоплазматического ретикулума и мощного аппарата белкового синтеза. В остеобластах синтезируется проколлаген, который затем перемещается из эндоплазматического ретикулума в комплекс Гольджи, включается в секретируемые гранулы (везикулы). В результате действия группы специальных пептидаз от проколлагена отщепляются сначала N-концевой, а затем С-концевой домены и формируется тропоколлаген. Последний в межклеточном пространстве образует фибриллы. В дальнейшем после образования поперечных сшивок формируется зрелый коллаген (см. гл. 21).
В остеобластах синтезируются также гликозаминогликаны, белковые компоненты протеогликанов, ферменты и другие соединения, многие из которых затем быстро переходят в межклеточное вещество.
Остеоцит(костная клетка) – зрелая отростчатая клетка костной ткани, вырабатывающая компоненты межклеточного вещества и обычно замурованная в нем.
Как известно, остеоциты образуются из остеобластов при формировании костной ткани.
Остеокласт – гигантская многоядерная клетка костной ткани, способная резорбировать обызвествленный хрящ и межклеточное вещество костной ткани в процессе развития и перестройки кости. Это основная функция остеокласта. Следует отметить, что остеокласты, так же как и остеобласты, синтезируют РНК, белки. Однако в остеокластах этот процесс протекает
менее интенсивно, так как у них слабо развит эндоплазматический ретикулум и имеется небольшое число рибосом, но содержится много лизосом и митохондрий.
^ Химический состав костной ткани.
Изучение химического состава костной ткани сопряжено со значительными трудностями, поскольку для выделения органического матрикса требуется провести деминерализацию кости. Кроме того, содержание и состав органического матрикса подвержены значительным изменениям в зависимости от степени минерализации костной ткани.
Известно, что при продолжительной обработке кости в разведенных растворах кислот ее минеральные компоненты растворяются и остается гибкий мягкий органический остаток (органический матрикс), сохраняющий форму интактной кости. Межклеточный органический матрикс компактной кости составляет около 20%, неорганические вещества – 70% и вода – 10%. В губчатой кости преобладают органические компоненты, которые составляют более 50%, на долю неорганических соединений приходится 33–40%
Неорганический состав костной ткани. Более 100 лет назад было высказано предположение, что кристаллы костной ткани имеют структуру апатита. В дальнейшем это в значительной мере подтвердилось. Действительно, кристаллы кости относятся к гидроксилапатитам, имеют форму пластин или палочек и следующий химический состав – Са10(РО4)6(ОН)2. Кристаллы гидроксилапатита составляют лишь часть минеральной фазы костной ткани, другая часть представлена аморфным фосфатом кальция Са3(РО4)2. Содержание аморфного фосфата кальция подвержено значительным колебаниям в зависимости от возраста. Аморфный фосфат кальция преобладает в раннем возрасте, в зрелой кости преобладающим становится кристаллический гидроксилапатит. Обычно аморфный фосфат кальция рассматривают как лабильный резерв ионов Са2+ и фосфата.
В организме взрослого человека содержится более 1 кг кальция, который почти целиком находится в костях и зубах, образуя вместе с фосфатом нерастворимый гидроксилапатит. Большая часть кальция в костях постоянно обновляется. Ежедневно кости скелета теряют и вновь восстанавливают примерно 700–800 мг кальция.
В состав минеральной фазы кости входит значительное количество ионов, которые обычно не содержатся в чистом гидроксилапатите, например ионы натрия, магния, калия, хлора и др. Высказано предположение, что в кристаллической решетке гидроксилапатита ионы Са2+ могут замещаться другими двухвалентными катионами, тогда как анионы, отличные от фосфата и гидроксила, либо адсорбируются на поверхности кристаллов, либо растворяются в гидратной оболочке кристаллической решетки.
^ Органический матрикс костной ткани. Приблизительно 95% органического матрикса приходится на коллаген. Вместе с минеральными компонентами коллаген является главным фактором, определяющим механические свойства кости. Коллагеновые фибриллы костного матрикса образованы коллагеном типа 1. Известно, что данный тип коллагена входит также в состав сухожилий и кожи, однако коллаген костной ткани обладает некоторыми особенностями. Есть данные, что в коллагене костной ткани несколько больше оксипролина, чем в коллагене сухожилий и кожи. Для костного коллагена характерно большое содержание свободных ε-амино-групп лизиновых и оксилизиновых остатков. Еще одна особенность костного коллагена – повышенное по сравнению с коллагеном других тканей содержание фосфата. Большая часть этого фосфата связана с остатками серина.
В сухом деминерализованном костном матриксе содержится около 17% неколлагеновых белков, среди которых находятся и белковые компоненты протеогликанов. В целом количество протеогликанов в сформировавшейся плотной кости невелико.
В состав органического матрикса костной ткани входят гликозаминогликаны, основным представителем которых является хондроитин-4-суль-фат. Хондроитин-6-сульфат, кератансульфат и гиалуроновая кислота содержатся в небольших количествах.
Состав эмали
Неорганических веществ до 97 %,
гидроксиапатита — Ca10(PO4)6(OH)2 до 75%,
карбонатапатита 12%,
хлорапатита 4,4 %,
фторапатита 0,7- 2,5 %,
CaCO3 2%,
MgCO3 2%
Здоровая эмаль содержит
4 % воды (¾ - cвязанная)
1,5 % органических веществ
3. В клинику доставлен мужчина 55 лет. При обследовании: АлТ - 2,1 мкМ, АсТ - 6,4 мкМ. Повышена активность креатинкиназы в плазме крови. Ваши предположения. Обоснуйте.
Инфаркт миокарда. Креатинкиназа – внутриклеточный фермент серд.клеток.
Билет № 25
1. Белки плазмы крови. Альбумины, глобулины. Свойства, функции, метаболизм. "Транспортные" болезни. Проявления, причины, профилактика и лечение.
Белки плазмы крови выполняют множество функций. Одна из них заключается в поддержании осмотического давления, так как белки связывают воду и удерживают её в кровеносном русле.
Белки плазмы образуют важнейшую буферную систему крови и поддерживают рН крови в пределах 7,37 - 7,43.
Альбумин, транстиретин, транскортин, трансферрин и некоторые другие белки (табл. 14-2) вьшолняют транспортную функцию.
Белки плазмы определяют вязкость крови и, следовательно, играют важную роль в гемодинамике кровеносной системы.
Белки плазмы крови являются резервом аминокислот для организма.
Иммуноглобулины, белки свёртывающей системы крови, α1-антитрипсин и белки системы комплемента осуществляют защитную функцию
Альбумин. Концентрация альбумина в крови составляет 40-50 г/л. В сутки в печени синтезируется около 12 г альбумина, Т1/2 этого белка - примерно 20 дней. Альбумин состоит из 585 аминокислотных остатков, имеет 17 дисульфидных связей и обладает молекулярной массой 69 кД. Молекула альбумина содержит много дикарбоновых аминокислот, поэтому может удерживать в крови катионы Са2+, Cu2+, Zn2+. Около 40% альбумина содержится в крови и остальные 60% в межклеточной жидкости, однако его концентрация в плазме выше, чем в межклеточной жидкости, поскольку объём последней превышает объём плазмы в 4 раза.
Благодаря относительно небольшой молекулярной массе и высокой концентрации альбумин обеспечивает до 80% осмотического давления плазмы. При гипоальбуминемии осмотическое давление плазмы крови снижается. Это приводит к нарушению равновесия в распределении внеклеточной жидкости между сосудистым руслом и межклеточным пространством. Клинически это проявляется как отёк. Относительное снижение объёма плазмы крови сопровождается снижением почечного кровотока, что вызывает стимуляцию системы ренинангиотензинальдрстерон, обеспечивающей восстановление объёма крови (см. раздел 11). Однако при недостатке альбумина, который должен удерживать Na+, другие катионы и воду, вода уходит в межклеточное пространство, усиливая отёки.
Гипоальбуминемия может наблюдаться и в результате снижения синтеза альбуминов при заболеваниях печени (цирроз), при повышении проницаемости капилляров, при потерях белка из-за обширных ожогов или катаболических состояний (тяжёлый сепсис, злокачественные новообразования), при нефротическом синдроме, сопровождающемся альбуминурией, и голодании. Нарушения кровообращения, характеризующиеся замедлением кровотока, приводят к увеличению поступления альбумина в межклеточное пространство и появлению отёков. Быстрое увеличение проницаемости капилляров сопровождается резким уменьшением объёма крови, что приводит к падению АД и клинически проявляется как шок.
Альбумин - важнейший транспортный белок. Он транспортирует свободные жирные кислоты (см. раздел 8), неконъюгированный билирубин (см. раздел 13), Са2+, Сu2+, триптофан, тироксин и трийодтиронин
Глобулины.
В отличие от альбуминов глобулины не растворимы в воде, а растворимы в слабых солевых растворах.
1-глобулины
В эту фракцию входят разнообразные белки. 1-глобулины имеют высокую гидрофильность и низкую молекулярную массу - поэтому при патологии почек легко теряются с мочой. Однако их потеря не оказывает существенного влияния на онкотическое давление крови, потому что их содержание в плазме крови невелико.
Функции v1-глобулинов.
Транспортная. Транспортируют липиды, при этом образуют с ними комплексы - липопротеины. Среди белков этой фракции есть специальный белок, предназначенный для транспорта гормона щитовидной железы тироксина - тироксин-связывающий белок.
Участие в функционировании системы свертывания крови и системы комплемента - в составе этой фракции находятся также некоторые факторы свертывания крови и компоненты системы комплемента.
Регуляторная функция. Некоторые белки фракции 1-глобулинов яляются эндогенными ингибиторами протеолитических ферментов. Наиболее высока в плазме концентрация 1-антитрипсина. Содержание его в плазме от 2 до 4 г/л (очень высокое), молекулярная масса - 58-59 кДа. Главная его функция - угнетение эластазы - фермента, гидролизующего эластин (один из основных белков соединительной ткани). 1-антитрипсин также является ингибитором протеаз: тромбина, плазмина, трипсина, химотрипсина и некоторых ферментов системы свертывания крови. Количество этого белка увеличивается при воспалительных заболеваниях, при процессах клеточного распада, уменьшается при тяжелых заболеваниях печени. Это уменьшение - результат нарушения синтеза 1-антитрипсина, и связано оно с избыточным расщеплением эластина. Существует врожденная недостаточность (1-антитрипсина. Считают, что недостаток этого белка способствует переходу острых заболеваний в хронические.
К фракции 1-глобулинов относят также 1-антихимотрипсин. Он угнетает химотрипсин и некоторые протеиназы форменных элементов крови.
2-глобулины
Высокомолекулярные белки. Эта фракция содержит регуляторные белки, факторы свертывания крови, компоненты системы компемента, транспортные белки. Сюда относится и церулоплазмин. Этот белок имеет 8 участков связывания меди. Он является переносчиком меди, а также обеспечивает постоянство содержания меди в различных тканях, особенно в печени. При наследственном заболевании - болезни Вильсона - уровень церулоплазмина понижается. Вследствие этого повышается концентрация меди в мозге и печени. Это проявляется развитием неврологической симптоматики, а также циррозом печени.
2. Применение глюкокортикоидных гормонов в клинической практике. Осложнения стероидной терапии. Проявления со стороны тканей полости рта.
Глюкокортикоиды стимулируют катаболизм триглицеридов и подавляют синтез жира из углеводов. В то же время, уменьшение жировой ткани конечностей нередко сочетается с увеличением отложения жира на брюшной стенке и между лопатками. Гипергликемия под влиянием гормонов возникает вследствие усиленного образования глюкозы в печени из аминокислот (глюконеогенеза) и подавления ее утилизации тканями; в печени увеличивается также содержание гликогена. Глюкокортикоиды снижают чувствительность тканей к инсулину и синтез нуклеиновых кислот.
Гормоны повышают чувствительность адренорецепторов к катехоламинам, усиливают прессорные эффекты ангиотензина II, уменьшают проницаемость капилляров, принимают участие в поддержании нормального тонуса артериол и сократимости миокарда. Под влиянием глюкокортикоидов уменьшается содержание в крови лимфоцитов, моноцитов, эозинофилов и базофилов, стимулируется выход нейтрофилов из костного мозга и повышение их количества в периферической крови. Гормоны задерживают в организме натрий и воду на фоне потери калия, в кишечнике тормозят всасывание кальция, способствуют выходу последнего из костной ткани и выведению его с мочой. Глюкокортикоиды повышают сенсорную чувствительность и возбудимость нервной системы, участвуют в осуществлении стрессовых реакций, влияют на психику человека [3].
Широкое применение в клинике естественные глюкокортикоиды и их синтетические аналоги нашли главным образом потому, что обладают еще несколькими ценными качествами: они оказывают противовоспалительное, иммуносупрессивное, антиаллергическое и противошоковое действие. Конечные результаты терапии зависят от многих факторов, в том числе длительности лечения, дозы препаратов, способа и режима их введения, иммунологических и иммуногенетических особенностей самих заболеваний и т. д. Кроме того, различные глюкокортикоиды оказывают разной степени выраженности иммуносупрессивный и противовоспалительный эффекты, между которыми нет прямой зависимости. Так, дексаметазон обладает мощной противовоспалительной и сравнительно низкой иммуносупрессивной активностью.
Метаболические:-Диспротеинемия-Ожирение-Усиление глюконеогенеза-Гиперосмолярная некетонемическая кома
Эндокринные:Депрессия гипоталамо- гипофизарно- надпочечниковой функции-Замедление роста у детей-Нарушение менструального цикла-Развитие синдрома Кушинга
Мьшечно-скелетные:Остеопороз-Асептический (аваскулярный) некроз костей-Миопатия
Кардиоваскулярные и почечные:Задержка натрия и воды-Повышение продуктов азотистого обмена
ГипокалиемияГипокалиемический алкалозртериальная гипертензияУвеличение протеинурииЖелудочно-кишечныеГастриты и пептические язвыПерфорации тонкого и толстого кишечникаПанкреатитЦеребральные
При обследовании больного обнаружено: общий билирубин крови 156 мкМ/л, холебилирубин 102 мкМ/л, повышена активность АЛТ, АСТ. Объясните происхождение обнаруженных изменений. С патологией какого органа они могут быть связаны?
Печень. Паренхиматозная желтуха, так как помимо прямого билирубина, разрушаются клетки печени.
Паренхиматозная (печеночно-клеточная) желтуха – причиной может быть нарушение на всех трех стадиях превращения билирубина в печени: извлечение билирубина из крови печеночными клетками, его конъюгирование и секреция в желчь.
Наблюдается при вирусных и других формах гепатитов, циррозе и опухолях печени, жировой дистрофии печени, при отравлении токсическими гепатотропными веществами, при врожденных патологиях.
Так как нарушаются все процессы превращения билирубина в печени, гипербилирубинемия развивается за счет обеих фракций, преимущественно прямого билирубина
Билет № 26
Биосинтез гликогена. Ход процесса. Регуляция. Значение.
Гликоген - разветвлённый гомополимер глюкозы, в котором остатки глюкозы соединены в линейных участках α-1,4-гликозидной связью. В точках ветвления мономеры соединены α-1,6-гликозидными связями. Эти связи образуются примерно с каждым десятым остатком глюкозы.Так возникает древообразная структура с молекулярной массой >107Д, что соответствует приблизительно 50 000 остатков глюкозы.
Таким образом, в молекуле гликогена имеется только одна свободная аномерная ОН-группа и, следовательно, только один восстанавливающий (редуцирующий) конец.
А. Строение молекулы гликогена: 1 - остатки глюкозы, соединённые α-1,4-гликозидной связью; 2 - остатки глюкозы, соединённые α-1,6-гликозидной связью; 3 - нередуцирующие концевые мономеры; 4 - редуцирующий концевой мономер. Прежде всего глюкоза подвергается фосфорилированию при участии ферментагексокиназы, а в печени – и глюкокиназы. Далее глюкозо-6-фосфат под влиянием ферментафосфоглюкомутазы переходит в глюкозо-1-фос-фат. Образовавшийся глюкозо-1-фосфат уже непосредственно вовлекается в синтез гликогена. На первой стадии синтеза глюкозо-1-фосфат вступает во взаимодействие с УТФ (уридинтрифосфат), образуя уридиндифосфатглю-козу (УДФ-глюкоза) и пирофосфат. Данная реакция катализируется ферментом глюкозо-1-фосфат-уридилилтрансферазой (УДФГ-пирофосфорила-за):
Глюкозо-1-фосфат + УТФ < => УДФ-глюкоза + Пирофосфат
На второй стадии – стадии образования гликогена – происходит перенос глюкозного остатка, входящего в состав УДФ-глюкозы, на глюкозидную цепь гликогена –праймер («затравочное» количество). При этом образуется α-(1–>4)-связь между первым атомомуглерода добавляемого остатка глюкозы и 4-гидроксильной группой остатка глюкозы цепи. Эта реакция катализируется ферментомгликогенсинтазой (возможна только при условии, что полисахаридная цепь уже содержит более 4 остатков D-глюкозы). Образующийся УДФ затем вновь фосфорилируется в УТФ за счет АТФ, и таким образом весь цикл превращений глюкозо-1-фосфата начинается сначала.Установлено, что гликогенсинтаза неспособна катализировать образование α-(1–>6)-связи, имеющейся в точках ветвления гликогена. Этот процесс катализирует специальный фермент, получивший название гликогенветвящегофермента, или амило-(1–>4)–>(1–>6)-трансглюкозидазы. Последний катализирует перенос концевого олигосахаридного фрагмента, состоящего из 6 или 7 остатков глюкозы, с нередуцирующего конца одной из боковых цепей, насчитывающей не менее 11 остатков, на 6-гидроксиль-ную группу остатка глюкозы той же или другой цепи гликогена. В результате образуется новая боковая цепь.Ветвление повышает растворимостьгликогена. Кроме того, благодаря ветвлению создается большое количество невосстанавливающих концевых остатков, которые являются местами действия гликогенфосфорилазы и гликогенсинтазы.Таким образом, ветвление увеличивает скорость синтеза и расщепления гликогена. Благодаря способности к отложению гликогена (главным образом в печени и мышцах и в меньшей степени в других органах и тканях) создаются условия для накопления в норме некоторого резерва углеводов. При повышении энерготрат в организме в результате возбуждения ЦНС обычно происходят усиление распада гликогена и образование глюкозы.
Помимо непосредственной передачи нервных импульсов к эффекторным органам и тканям, при возбуждении ЦНС повышаются функции ряда желез внутренней секреции (мозговое вещество надпочечников, щитовидная железа, гипофиз и др.), гормоны которых активируют распад гликогена, прежде всего в печени и мышцах .
Витамины D. Источники, потребность. Условия всасывания. Образование активных форм. Биохимические функции. Нарушения обмена при недостаточности. Проявления общие и в полости рта.
Химическое строение и свойства. В из рыбьего жира был выделен препарат, излечивающий рахит. Он был назван витамином Д3, так как ранее из растительных масел был выделен эргостерин, получивший название витамин Д1, При воздействии на витамин Д1 УФ-лучей образовывалось излечивающее рахит соединение — витамин Д2, эргокалциферол (кальциферол означает несущий кальций). В растениях при УФ-облучении синтезируются и другие витамеры эргостерина (Д4-7). Наиболее важным из группы витаминов Д является витамин Д3 — холекальциферол. Холекальциферол образуется в качестве промежуточного продукта при биосинтезе холестерола (из 7-дегидрохолестерола) в клетках кожи человека под влиянием УФ-лучей.
|
|
|
 Скачать 0.96 Mb.
Скачать 0.96 Mb.