|
|
Билет 1. Вопрос Ингалипт
Производство желатиновых капсул
Метод погружения («макания»), сущность которого заключается в изготовлении оболочек капсул при помощи специальных «макальных» рам со штифтами, отображающих форму капсул. Штифты опускаются в расплав желатиновой массы, которая застывает на них тонкой оболочкой. Оболочку снимают, формуют (закрепляют форму сушкой при определенных режимах) и заполняют наполнителем, или сперва заполняют, а затем формуют — в зависимости от вида получаемых капсул: твердые или мягкие. При этом, если для получения мягких капсул (с капельной запайкой) метод низкопроизводителен, трудоемок и применяется сегодня только в лабораторных условиях, то для получения твердых капсул он нашел широкое применение в промышленности, являясь, по сути, единственным. Сегодня в мире насчитывается свыше 400 автоматов по получению твердых желатиновых капсул (выпускаются преимущественно американскими фирмами — «Elanco», «Parke-Davis», «Colton», канадской «Capsule Technology International», немецкой «Hofliger und Karg», некоторыми другими) .
Изготовление твердых желатиновых капсул погружением. Состоит из следующих операций:
приготовление желатинового раствора;
изготовление оболочек капсул:
наполнение капсул;
запайка капсул;
контроль капсул;
сушка капсул;
шлифовка капсул;промывка капсул;
регенерация отбракованных капсул.
Приготовление желатинового раствора (массы).
Для его приготовления используют желатин, глицерин и воду. Для мягких капсул расходуют 20 - 25% глицерина, для твердых - 0,3%- Кроме этого, берут пластификаторы: сорбит, полиэтиленсорбит с оксиэтиленом; красители; титана двуоксид (белый), аморант кислый, эритрозин (красный), тартразин (желтый), индиготин (синий). Для антимикробной устойчивости оболочек в состав раствора вводят консерванты: нипагин и нипазол, кислоту бензойную, натрия бензоат и др.
Твердые желатиновые капсулы предназначены для дозирования сыпучих порошкообразных, гранулированных и микрогранулированных веществ. Они имеют форму цилиндра с полусферическими концами и состоят из двух частей — корпуса (тела) и крышечки, которые должны свободно входить одна в другую, не образуя зазоров. Для обеспечения «замка» они могут иметь специальные канавки и выступы.
Пустые твердые капсулы наполняются лекарственными веществами на специальных наполняющих автоматах.
Контроль качества
При оценке качества капсул определяют среднюю массу, однородность дозирования, распадаемость и растворение (согласно статье «Капсулы» по ГФ XI).
Определение средней массы. Взвешивают 20 невскрытых капсул и определяют их среднюю массу, затем ■— каждую отдельно и сравнивают массу каждой капсулы со средней. Отклонение не должно превышать ±10%.
Определение однородности дозирования. При содержании в капсуле 0,05 г и менее лекарственного вещества испытания проводят согласно статье «Таблетки», если нет других указаний в частных статьях.
Определение распадаемости и растворения проводят также согласно статье «Таблетки». Если нет других указаний в частных статьях, капсулы должны распадаться или растворяться в желудочно-кишечном тракте не дольше 20 мин. Серия считается удовлетворительной при растворении в воде не менее 75% действующего вещества (от содержания в лекарственной форме) за 45 мин, при перемешивании со скоростью 100 об/мин.
Упаковка. Капсулы должны выпускаться в плотно закрытой упаковке, предохраняющей от воздействия влаги.
Хранение. Капсулы следует хранить в сухом, прохладном месте, в соответствии с указанием нормативно-технической документации на препарат.
В связи с развитием производства капсул и ро ванных лекарственных форм большое внимание уделяется биодоступности лекарственных средств в капсулах.
На биологическую доступность капсулированных препаратов оказывают влияние основные и вспомогательные вещества, как в составе содержимого капсул, так и в составе
116Уничтожение этих препаратов можно проводить только в унитарных предприятиях или учреждениях, имеющих лицензию на уничтожение наркотических средств и психотропных веществ. Если юридическое лицо не имеет такой лицензии, но осуществляет Деятельность с их оборотом, то в случае необходимости уничтожения указанных Л С заключается договор с ГУП (учреждением), имеющим лицензию на право уничтожения, куда Л С передаются по приемо-сдаточному акту.
Билет 25. Вопрос 1.
11
Требования, предъявляемые к инъекционным лекарственным формам.
1. Стерильность - отсутствие жизнеспособных микроорганизмов и их спор.
2. Апирогенность - отсутствие продуктов жизнедеятельности и распада микроорганизмов.
3. Стабильность - неизменяемость по составу и количеству находящихся в растворе екарственных веществ в течение установленных сроков хранения
4. Отсутствие механических включении - прозрачность инъекционного раствора (или отсутствие каких-либо взвешенных частиц)
Обеспечить эти требования должен весь технологический процесс (помещения, ехнологическое оборудование, упаковка, система вентиляции, транспортные системы ввода ырья и вывода готового продукта, обслуживающий персонал).
Большая часть инъекционных препаратов является лекарственными формами промышленного производства (ампулы, флаконы, шприц-тюбики).
В аптеках готовят растворы для инъекций, которые отпускают в герметично укупоренных флаконах вместимостью 5—1000 мл. На флаконы наклеиваются этикетки «Стерильно».
Технология инъекционных препаратов — сложный многостадийный процесс, состоящий из основных и вспомогательных этапов. Условия изготовления лекарственных форм для инъекций должны быть асептическими, т. е. исключающими попадание в готовый продукт микроорганизмов и механических частиц. Только после определения способов стерилизации для различных инъекционных лекарственных форм стало возможно их практическое применение.
Выработаны специальные условия выполнения стадий и операций технологического процесса для соответствия готового раствора требуемым стандартам.
Повышенные требования предъявляются к следующим объектам:
1) производственным помещениям;
2) технологическому оборудованию;
3) системам подготовки основных и вспомогательных материалов;
4) вентиляции;
5) обслуживающиему персоналу.
На каждой из стадий производственного процесса существует угроза микробной контаминации и внесения в раствор загрязнений иного рода. Технология ампулированных препаратов: 1) получение ампул (флаконов);количестве уничтожаемого ЛС, а также о таре или упаковке; наименование производителя ЛС; наименование владельца или собственника ЛС; способ уничтожения. Акт по уничтожению ЛС подписывается всеми членами комиссии по уничтожению ЛС и скрепляется печатью предприятия, которое осуществило уничтожение.
Ответственность за уничтожение Л С несут субъекты обращения в соответствии с законодательством Российской Федерации.
Уничтожение особо ядовитых веществ. В настоящее время действуют Временные правила уничтожения сильнодействующих ядовитых веществ, пришедших в негодность, и меры личной и общественной безопасности и Инструкция по обезвреживанию и уничтожению сильнодействующих ядовитых веществ (1938). Правила уничтожения существуют для особо ядовитых веществ, таких, как мышьяковый и мышьяковистый ангидрид, сулема, фосфор (желтый), бруцин, никотин, стрихнин, синильная кислота и ее соли, хлорпикрин, сероуглерод. Необходимость и порядок уничтожения указанных веществ устанавливаются специальным приказом. Факт уничтожения оформляется актом. Уничтожение данных веществ разрешается проводить только в присутствии представителя органов санитарно-эпидемиологического надзора и органов милиции. Предъявляются строгие требования к подготовке персонала, снабжению его спецодеждой и защитными приспособлениями, мерам по обеспечению первой помощи при возможных несчастных случаях и отравлениях и пр.
Способы уничтожения и обезвреживания выбираются в каждом отдельной случае в зависимости от количества уничтожаемого вещества и местных условий, в которых это уничтожение производится.
Уничтожение наркотических средств и психотропных веществ. Производится в соответствии с Инструкцией по уничтожению наркотических средств и психотропных веществ, входящих в списки II и III Перечня наркотических средств, психотропных веществ и их прекурсоров, подлежащих контролю в Российской Федерации, дальнейшее использование которых в медицинской практике признано нецелесообразным, утвержденной приказом Минздрава России от 31.01.2002 № 26.
Наркотические средства и психотропные вещества, дальнейшее использование которых в медицинской практике признано нецелесообразным органами, осуществляющими их изъятие или конфискацию, подлежат уничтожению в полном объеме. Уничтожение осуществляется в следующих случаях: истек срок годности;
вещество подвергалось химическому или физическому воздействию, следствием которого стала непригодность, исключающая возможность восстановления или переработки;
неиспользованные наркотические средства, принятые от родственников умерших больных;
когда трудно определить, является ли препарат наркотическим средством или психотропным веществом;
конфискованное из незаконного оборота наркотическое средство или психотропное вещество, которое не может быть использовано в медицинских, научных или иных целях.2) подготовка ампул (флаконов) к заполнению. Параллельно с этими процессами идут:
1) получение и подготовка растворителей;
2) приготовления раствора. Далее производят:
1) ампулирование (наполнение и укупорку флаконов):
2) стерилизацию;
3) контроль качества, маркировку и упаковку.
Особенно ответственно нужно подходить к стадиям получения раствора и ампулирования.
Принимая во внимание то, что в городском воздухе содержится от 100 000 до 1 000 000 частиц размером 0,5 мкм и более в 1 л, в 1982 г. в нашей стране были введены «Требования к помещениям для производства лекарственных средств в асептических условиях РДП 46-3-80».
Все производственные помещения в соответствии с этими требованиями следует делить на четыре класса:
Ранее системы очистки и вентиляции воздуха в производственных помещениях обеспечивали содержание в 1 л около 1000 частиц. Эти параметры не отвечали требуемым условиям асептики, так как изначально на 1000 частиц в воздухе приходится 1 микроорганизм, а каждый член персонала при дыхании за 1 мин в неподвижном состоянии выделяет 100 000 частиц, а при ходьбе до 10 000 000 частиц.
Одной из характеристик данных систем являлось то, что они создавали турбулентные потоки, смешивающие чистый фильтрованный воздух с поступающим нефильтрованным, при этом происходило разбавление концентрации взвеси частиц в воздухе помещения.
Для того чтобы избавиться от данного недостатка, были разработаны системы с применением ламинарного потока фильтрованного воздуха со скоростью около 27,5 м/мин по всему сечению помещения.
В результате был достигнут допустимый результат — содержание 10 частиц в 1 л воздуха.
Автономный ламинарный поток стерильного воздуха применяется для создания условий сверхчистых помещений или отдельных зон внутри помещения (размещаемых в виде специального блока).
При применении данной технологии чистота воздуха достигает 1 частицы в 1 л, что соответствует условиям стерильности и асептики.
Между помещениями разных классов чистоты устанавливают шлюзовые соединения, создается подпор воздуха 533,288 Н/м".
НПП рекомендует для обеспечения стерильности продукции использовать способы производства, сводящие к минимуму или устраняющие присутствие персонала в производственных помещениях, например, полностью замкнутые и автоматизированные системы.
Использование изолирующих технологий (GMP ЕС) сокращает необходимость присутствия человека в производственных зонах, в результате чего значительно сокращается риск микробной контаминации продукции, производимой в асептических условиях, из окружающей среды. Изолирующие технологии .предусматривают применение различныхтипов изоляторов и передаточных устройств. Изолятор и окружающая его среда должны быть спроектированы таким образом, чтобы в соответствующих рабочих зонах достигалось требуемое качество воздуха. Возможно использование полностью герметизированных систем, включающих оборудование для стерилизации.
Требования к производственным помещениям и чистоте воздушной среды
Производственные помещения необходимо проектировать, располагать, приспосабливать, оснащать, содержать и обслуживать таким образом, чтобы они соответствовали своему назначению, обеспечивали возможность проведения эффективной уборки и эксплуатации с целью исключения микробной и перекрестной контаминации, а также других факторов, которые могут отрицательно повлиять на качество продукции.
Обеспечение производственных помещений чистым воздухом
Воздух производственных помещений — потенциальный источник загрязнения лекарств, поэтому его очистка является одним из ключевых вопросов технологической гигиены. Уровень чистоты воздуха помещения определяет класс чистоты воздуха.
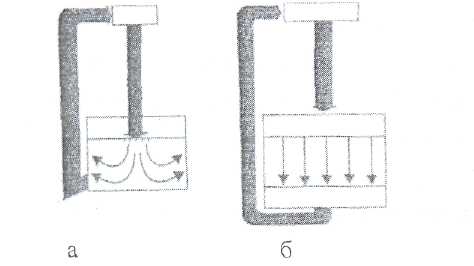
Рис. 1. Схемы подачи обеспыленного воздуха:
а — турбулентный поток;
б — ламинарный поток
Для снабжения производства стерильных растворов обеспыленным стерильным воздухом используют как обычные системы турбулентной вентиляции, обеспечивающие стерильность воздуха в помещении, так и системы с ламинарным потоком воздуха по всей площади помещения или в определенных рабочих зонах.
Требования, предъявляемые к персоналу и спецодежде
В «чистых» производственных помещениях во время работы должно находиться минимальное количество рабочих, предусмотренное соответствующими инструкциями.
Персонал, входящий в производственное помещение, должен быть одет в специальную одежду, соответствующую выполняемым им производственным операциям. Технологическая одежда персонала должна соответствовать классу чистоты той зоны, в которой он работает, и выполнять свое основное назначение — максимально защищать продукт производства от частиц, выделяемых человеком.Основное назначение технологической одежды работников — максимально защищать продукт производства от частиц, выделяемых человеком. Требования к технологическому процессу
Производство стерильных лекарственных средств должно осуществляться по методикам, четко изложенным в технологических регламентах и производственных инструкциях, с учетом принципов и правил надлежащей производственной практики, что необходимо для получения готовой продукции требуемого качества в соответствии с регистрационной и лицензионной документацией.
Требования к технологическому оборудованию
Производственное оборудование не должно отрицательно влиять на качество продукции. Части или поверхности оборудования, соприкасающиеся с продукцией, должны быть изготовлены из материалов, которые не вступают с ней в реакцию, не обладают абсорбционными свойствами и не выделяют какие-либо вещества в такой степени, чтобы это могло повлиять на качество продукции. Одним из путей решения этих задач является применение современных автоматических линий ампулирования инъекционных препаратов.
Учитывая специфику этой технологии, должно уделяться особое внимание:
— Конструкции и квалификации оборудования
— Валидации и воспроизводимости процессов «очистка на месте» и «стерилизация на месте»
— Окружающей среде, в которой установлено оборудование
— Квалификации и обучению операторов
— Чистоте технологической одежды операторов.
Требования к контролю качества
Каждое предприятие-производитель должно иметь независимую службу контроля качества и контрольную (испытательную) лабораторию, штат и оснащение которой позволяют проводить все требуемые испытания. Такая лаборатория должна быть отделена от производственных помещений и других лабораторий (биологической, микробиологической и тд.).
Во время технологического процесса производства инъекционных растворов обязательно проводят промежуточный (постадийный) контроль качества, т.е. после каждой технологической стадии (операции) проводится бракераж ампул, флаконов, гибких контейнеров и др., не отвечающих определенным требованиям. Так. после растворения (изотонизации, стабилизации и т.д.) лекарственного вещества, контролируется качественный и количественный состав, рН раствора, плотность и др.: после операции наполнения — проверяется выборочно объем наполнения сосудов и т.п.
Поступившее сырье, материалы, полупродукты, а также изготовленная промежуточнаяили готовая продукция сразу же после поступления или окончания технологического процесса до принятия решения о возможности их использования должны находиться в карантине. Готовая продукция не допускается к реализации до тех пор, пока ее качество не будет признано удовлетворительным.
Жидкие лекарственные средства для парентерального применения обычно контролируют по следующим показателям качества: описание, идентификация, прозрачность, цветность, рН, сопутствующие примеси, извлекаемый объем, стерильность, пирогены, аномальная токсичность, механические включения, количественное определение действующих веществ, антимикробных консервантов и органических растворителей.
Для жидких лекарственных средств для парентерального применения в виде вязких жидкостей дополнительно контролируют плотность.
Стабильность лекарственных препаратов зависит от многих факторов — температуры хранения, освещенности, состава окружающей атмосферы, способа приготовления, т. е. технологии лекарственной формы, вспомогательных веществ, вида лекарственной формы, особенно ее агрегатного состояния, упаковки и др.
Используемые в настоящее время методы стабилизации лекарственных средств — химический и физический, нередко применяются в комплексе, дополняя друг друга. Химические методы основаны на добавлении химических веществ — стабилизаторов, антиоксидантов и консервантов.
Химические методы стабилизации. Стабилизация гомогенных дисперсных систем основана на подавлении процесса разложения лекарственных веществ за счет связывания или нейтрализации тех химических соединений, которые активируют деструкцию лекарственного вещества. Такие соединения находятся в растворе в незначительных количествах, либо переходят в раствор из упаковки (стекла) при его технологической обработке (стерилизации) и хранении.
Стабильность инъекционных растворов, в первую очередь, зависит от качества исходных растворителей и лекарственных веществ, класса и марки стекла ампул и флаконов, наличия кислорода в воде и растворах, рН растворов, температуры и времени стерилизации, наличия ионов тяжелых металлов, условий хранения препаратов и т. д.
Основной принцип стабилизации препаратов предусматривает максимальное устранение факторов, способствующих изменению лекарственных веществ.
Влияние качества стекла на стабильность веществ. Медицинское стекло представляет, собой твердый раствор, полученный в результате охлаждения расплавленной смеси силикатов, оксидов металлов и некоторых солей. В зависимости от качественного и количественного соотношения оксидов металлов в стекле различают классы и марки медицинского стекла, обладающие различной химической устойчивостью»..
На поверхности стекла ампул или флаконов при контакте с водными инъекционными растворами во время хранения, и особенно при тепловой стерилизации, в зависимости от его марки и значения рН раствора может происходить процесс выщелачивания или растворения верхнего слоя стекла. Выщелачивание — это выход из стекла преимущественно оксидовщелочных и щелочноземельных металлов, благодаря высокой подвижности ионов этих металлов по сравнению с. высоким зарядом четырехвалентного иона кремния. По этой причине ион натрия даже при комнатной температуре может замещаться другими ионами. При более глубоких процессах выщелачивания ионы щелочных металлов легко перемещаются из внутренних слоев стекла на место ионов, вступивших в реакцию. Выщелачивание из стекла компонентов и их гидролиз ведут к увеличению или уменьшению величины рН раствора. Это приводит к изменениям свойств лекарственных веществ, в основе которых лежат различные химические процессы: гидролиз, окисление, восстановление, омыление, декарбоксилирование, изомеризация и др.
Оптимальная концентрация водородных ионов в инъекционных растворах — существенный стабилизирующий фактор. Она достигается путем добавления стабилизаторов, которые предусмотрены в нормативно-технической документации, а также использованием комплекса технологических приемов в процессе приготовления парентеральных растворов.
Стабилизаторы могут замедлять или ускорять нежелательные химические реакции, создавать, определенные значения рН растворов, повышать растворимость лекарственных веществ или удерживать их во взвешенном состоянии. Выбор стабилизатора, в первую очередь, зависит от природы лекарственных веществ.
В растворах солей очень слабых оснований, малорастворимых в воде, незначительное повышение рН приводит к образованию осадка. Это наблюдается в растворах стрихнина нитрата, папаверина гидрохлорида, дибазола и др. При значительных увеличениях рН раствора (сильно щелочное стекло) иногда наблюдается выделение сильных свободных оснований, например новокаина.
Бели основания алкалоидов сильные или хорошо растворимые в воде, то при повышении рН выделения осадка не происходит (основания — эфедрина, кодеина, пилокарпина). Иногда свободное основание не выпадает в осадок, так как способно реагировать со щелочью с образованием растворимых продуктов (морфин, апоморфин, адреналин). Кроме того, в слабощелочной среде данные растворы подвергаются окислению с изменением окраски (раствор морфина желтеет, апоморфина — зеленеет, адреналина — розовеет).
Указанные выше изменения вызывают необходимость стабилизации растворов многих алкалоидов и азотсодержащих оснований. Большинство из них стабилизируют добавлением О.1н раствора кислоты хлористоводородной, нейтрализующей щелочь, выделяемую стеклом, и смещает рН раствора в кислую сторону. Это создает условия, препятствующие гидролизу, омылению сложных эфиров, окислению фенольных и альдегидных групп. Количество кислоты, необходимое для стабилизации раствора, зависит от свойств лекарственного вещества.
Методы стерилизации
По требованиям Государственной фармакопеи XI издания все готовые лекарственные препараты должны выдерживать тест на микробиологическую чистоту. Поэтому процессстерилизации имеет большое значение при изготовлении всех лекарственных форм, а особенно инъекционных.
Под стерилизацией (обеззараживание, обеспложивание) понимают совокупность физических, химических и механических способов освобождения от вегетативных и покоящихся форм микроорганизмов (Н. Horn, 1984).
ГФ XI издания определяет стерилизацию как процесс умерщвления в объекте или удаления из него микроорганизмов всех видов, находящихся на всех стадиях развития.
Поскольку к производству стерильных лекарственных форм предъявляют высокие требования по микробиологической чистоте (надежность стерильных инъекционных препаратов должна быть не ниже 10" ), то обеспложиванию подвергаются не только готовый продукт, но и используемое оборудование, вспомогательные материалы, фильтры, растворители, исходные вещества. Выбор того или иного способа стерилизации должен основываться на экономических соображениях и технологичности обработки, включая возможность ее автоматизации. От правильно подобранного метода стерилизации зависит качество производимой стерильной продукции.
В технологии лекарственных форм промышленного производства в настоящее время используют 3 группы методов стерилизации:
— механические;
— химические; ■— физические.
Механические методы стерилизации
Стерилизующая фильтрация. Микробные клетки и споры можно рассматривать как нерастворимые образования с очень малым (1—2 мкм) размером частиц. Подобно другим выключениям, они могут быть отделены от жидкости механическим путем — фильтрованием сквозь мелкопористые фильтры. Этот метод стерилизации включен в ГФ XI для стерилизации термолабильных растворов.
Стерилизующая фильтрация имеет преимущества по сравнению с методами термической стерилизации. Для многих растворов термолабильных веществ (апоморфина гидрохлорид, викасол, барбитал натрия и другие) его признают единственно доступным методом стерилизации. Метод весьма перспективный в производстве глазных капель.
Химические методы стерилизации
Методы основаны на высокой специфической (избирательной) чувствительности микроорганизмов к различным химическим веществам, что обусловливается физико-химической структурой их клеточной оболочки и протоплазмы.
Химическая стерилизация подразделяется на стерилизацию растворами (веществами) и стерилизацию газами (газовая стерилизация).
Стерилизация растворами или веществами. Стерилизацию растворами (веществами) серийно выпускаемой инъекционной продукции в заводских условиях не используют, так как введение в раствор постороннего биологически активного вещества нежелательно из-завозможных химического взаимодействия стерилизующего агента с действующими компонентами и побочных действий этого агента на организм человека.
Газовая стерилизация. К своеобразной химической стерилизации следует отнести метод стерилизации газами. Преимущество метода — возможность стерилизации объектов в пластмассовой упаковке, проницаемой для газов. Физические методы стерилизации
Тепловая (термическая) стерилизация. В настоящее время монопольное положение среди возможных методов стерилизации в фармацевтическом производстве занимает тепловая стерилизация.
В зависимости от температурного режима тепловая стерилизация подразделяется на стерилизацию:
— паром под давлением (автоклавирование);
— текучим паром;
— тиндализацию;
— воздушную.
Стерилизация паром под давлением. Автоклавирование — стерилизация растворов, устойчивых к нагреванию, паром под давлением 1,1 атм при температуре 119—121 °С. В данных условиях погибают не только вегетативные, но и споровые микроорганизмы за счет коагуляции белка клетки.
Стерилизация текучим, паром. Растворы веществ термически малоустойчивые иногда стерилизуют при 100 °С текучим паром (без примеси воздуха и избыточного давления). Насыщенный пар убивает только вегетативные формы микроорганизмов и при наличии в объекте споровых форм метод неэффективен.
Тиндализацыя (дробная стерилизация). Для термолабильных веществ, а также для растворов в шприц-ампулах стерилизацию иногда проводят методом тиндализации. Суть метода заключается в трехкратном нагревании растворов до 40—60 °С с перерывами в сутки, в течение которых объекты термостатируют при температуре 37±1 °С для прорастания споровых форм в вегетативные.
Стерилизация сухим жаром (воздушная стерилизация). Стерилизация сухим жаром, проводимая в аэростерилах или других аппаратах этого типа, также высокоэффективна. Погибают все формы микроорганизмов за счет пирогенетического разложения белковых веществ. Однако высокая температура нагрева (160—- 200 °С), длительное время воздействия (]—2 ч) и сухой горячий воздух оказывают повреждающее действие на стерилизуемые объекты и, следовательно, ограничивают возможности данного Способа.
Ультразвуковая стерилизация. Прохождение ультразвука (УЗ) в жидкой среде сопровождается чередующимися сжатиями, разрежениями и большими переменными ускорениями. В жидкости образуются разрывы, называемые кавитационными полостями. В момент сжатия эти полости захлопываются. Избыточное давление, создаваемое УЗ-волной, накладывается на постоянное гидростатическое и суммарно может составлять в пузырьках
107несколько атмосфер. В качестве «зародышей» кавитационных полостей могут быть пузырьки газа, пара в жидкости, твердые частицы и места неровностей твердой поверхности..
Стерилизация ультрафиолетовым излучением. Из-за возможности образования ядовитых продуктов и возможности разложения биологически активных компонентов инъекционных растворов под действием УФ-излучения. метод не нашел применения для стерилизации препаратов для инъекций. Однако он широко используется для стерилизации порошков, воды для инъекций, вспомогательных материалое. воздушной среды производственных помещений, технологического оборудования и других объектов.
Стерилизация ИК- и лазерным излучением. Электронная стерилизация.
Эти перспективные виды стерилизации практически не находят сегодня применения, хотя возможности для этого имеются.
Вопрос 2. Acidum sulfocam-phoratum — кислота сульфокамфорная
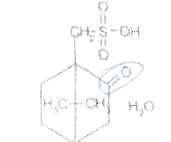
Белый или со слегка желтоватым оттенком кристаллический порошок. Т. разложения 194-198 °С для левовращающей и 196-202 °С для рацемической. Удельное вращение от -20° до -24° для левовращающей и от -1 до +1° для рацемической (5%-ный водный раствор)
К7,7-триметилбицикло[2.2.1 ]- гептан-2-он-сульфоновая
10- кислота, моногидрат
Кислота сульфокамфорная, содержащая в молекуле сульфо-группу, очень легко растворима в воде и этаноле, но мало растворима в эфире.
Утверждённая ФС регламентирует требования на кислоту сульфокамфорную. получаемую из 1,-камфоры и рацемической камфоры. В зависимости от способа получения кислота сульфокамфорная отличается по температуре разложения и удельному вращению
При испытании подлинности кислоты сульфокамфорной подтверждают наличие в её молекуле сульфо- и кетогрупп. Присутствие сульфогруппы можно установить, разрушая лекарственное вещество при прокаливании его в смеси карбоната и нитрата натрия с последующим воздействием концентрированной хлороводородной кислотой. Образовавшийся сульфат-ион обнаруживают по реакции с раствором хлорида бария.

Наличие кетогруппы подтверждают по образованию желто-оранжевого осадка при взаимодействии с раствором 2,4-динитрофенилгидразина: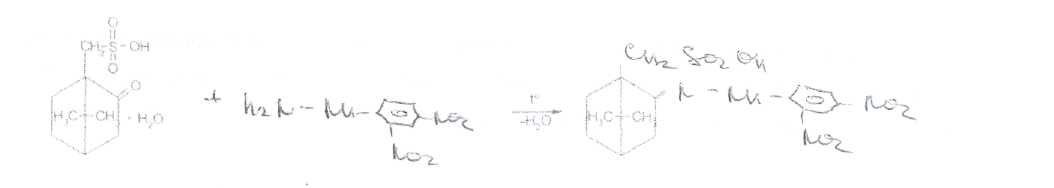
кислота 2,4-динитрофенил 2,4-динитрофенилгидразон
сульфокамфорная -гидразин кислоты сульфокамфорной
При испытании бициклических терпенов на чистоту ФС предусматривают установление прозрачности, цветности, рН растворов, микробиологической чистоты. В кислоте сульфокамфорной определяют наличие примесей ацетатов, сульфатов, потерю в массе при высушивании.
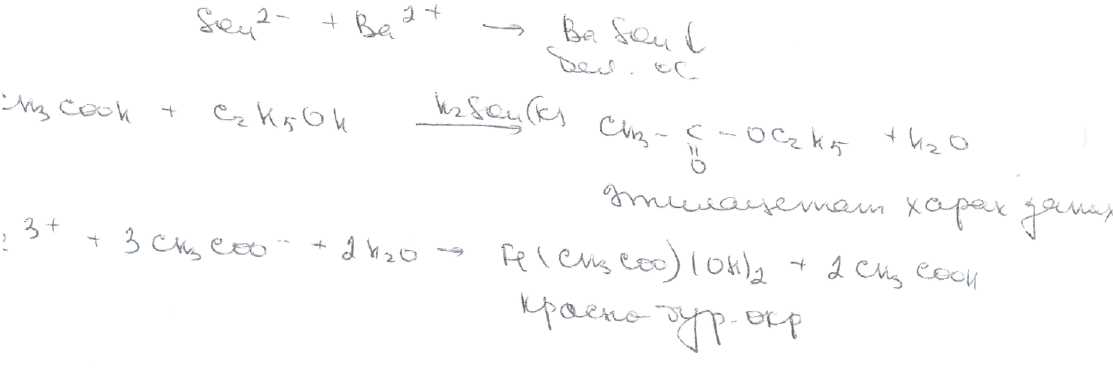
Кислоту сульфокамфорную количественно определяют методом нейтрализации в водной среде (индикатор фенолфталеин):
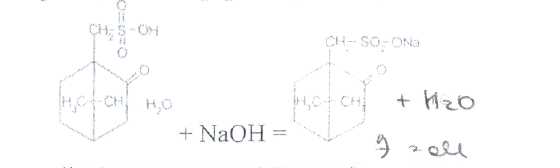
Лекарственные препараты бициклических терпенов хранят в хорошо укупоренных банках. Кислоту сульфокамфорную хранят в сухом, защищенном от света месте.
Кислота сульфокамфорная является составной частью применяемого для инъекций сульфокамфокаина (Sulfocamphocamum 10% pro injectionibus). Для его приготовления берут 49,6 г кислоты сульфокамфорной, 50,4 г основания прокаина и до 1 л воды для инъекций.
Вопрос 3. Radices Araliaemandshuricae— корни аралии маньчжурской Аралии высокой (аралии маньчжурской) —Araliaelata(Miq.) Seem. (= A mandshuricaRupr. et Maxim.) из сем. аралиевых (Araliaceae): используют в качестве лекарственного средства и сырья.
Корни - фармацевтической практике используют высушенные, реже свежие подземные органы многолетних растений, собранные чаше осенью или ранней весной, очищенные или отмытые от земли, освобожденные от отмерших частей, остатков стеблей и листьев. Крупные подземные органы перед сушкой разрезают на части (продольно или поперек).Сырье может быть представлено корнями — radices, корневищлми — rhizomata, корневищами и корнями — rhizomata et radices, корневищами с корнями — rhizomata cum radicibus, луковицами—bulbi, клубнями — tubera и клубнелуковицами — bulbotubera.
Химический состав. Основные действующие вещества корней аралии — тритерпеновые пентациклические сапонины группы (в-амирина, производные олеаноловой кислоты. Главные из них — аралозиды А, В, С.
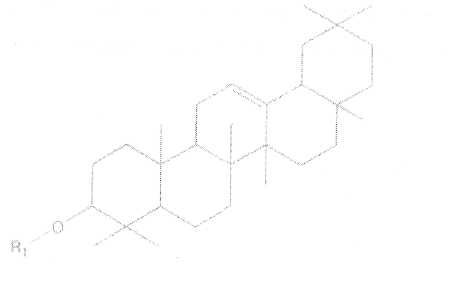
R-ь R2 - Н - олеаноловая кислота
Аралозид А - R, = гллюкуроновая кислота (4 -> 1) арабиноза
R2 = глюкоза
Качественная реакция. Берут навеску, изолируют сапарал метиловым спиртом, хроматографируют на пластинках. В качестве свидетеля наносят 0,01 мл 0,6 % раствора сапарала в метиловом спирте. Через 10 мин пластинку помещают в камеру со смесью растворителей хлороформ—метиловый спирт—вода (61 : 32 : 7). Сушат хроматограмму в течение 10 мин, опрыскивают 20 % раствором кислоты серной и нагревают при температуре 105 °С 10 мин в сушильном шкафу. Проявляются три пятна вишневого цвета (аралозиды). Допускается наличие дополнительных пятен вишневого и других цветов.
Колич. опред . Для цельного и измельченного сырья содержание суммы аралозидов в пересчете на аммонийную соль аралозидов А, В и С. определяемых методом потенциометрического титрования, должно быть не менее 5% (определение проводят после изолирования метанолом и очистки извлечения)
Хранение. Сырье хранят по общим правилам. Срок годности 3 года.
Использование. Из корней аралии получают тонизирующий препарат «Сапарал» и настойку, которые применяют при гипотонии, астении, депрессивных состаяниях.
Корни аралии входят в состав гипогликемических сборов «Арфазетин» и «Мирфазин».
Используется для приготовления тонизирующих напитков, а также в составе БАДов.
Вопрос 4. Рецепт выписан правильно. Рецепт хранится в аптеке 5 лет. Способ применения ЛС обозначается на русском или русском и национальном языках с указанием дозы, частоты, времени приема и его длительности, а для ЛС, взаимодействующих с пищей, времени их /потребления относительно приема пищи (до, во время, после еды).
1.7,7-триметилбицикло[2.2.1 ]-гептан-2-он
Белые кристаллические куски или бесцветный кристаллический порошок, или
прессованные плитки с кристаллическим строением, легко режущиеся ножом, слипающиеся
в комки.
Камфора отличается сильным характерным запахом и пряным горьковатым, а затем
охлаждающим вкусом. Камфора практически нерастворима в воде, легко растворима в
этаноле, очень легко в эфире, хлороформе, легко растворимы в жирных маслах.
Подобно ментолу, камфора образует густые прозрачные жидкости (эвтектические смеси)
с фенолом, ментолом, тимолом, хлоралгидратом, а также постепенно возгоняется даже при
обычной температуре, образуя в верхних частях сосуда кристаллический сублимат. При
осторожном нагревании камфора полностью возгоняется без обугливания. Горит светлым
пламенем, флуоресцирует в УФ-свете.
Утверждённая в 1999 г ФС распространяется на I-камфору, получаемую из пихтового
масла, и рацемическую — получаемую из скипидара. Они отличаются друг от друга
некоторыми константами
Физические константы камфоры (по ФС)_______^__^____________________
Лекарственное Темп. Удельное Темп плавл. Темп.
ве- затверде- вращение 2.4- кипения
щество вания, °С (10%-ный динчтрофенилги (возгон.). °С
раствор в дразо-
_____________________________этаноле)_______на, °С ______
d-камфора 178,2-178,6 +443° 207.4-209.1
1-камфора 174-179 от -39 до -44° 174-176 —«—
Камфора 171-177 от 1.0 до + 1.0° 164-167 — «—
рацемическая Эти константы служат подтверждением подлинности камфоры. Для ее идентификации
могут быть использованы цветные реакции, основанные на взаимодействии активированной
метиленовой группы с альдегидами: фурфуролом (сине-фиолетовое окрашивание),
бензальдегидом (красное):
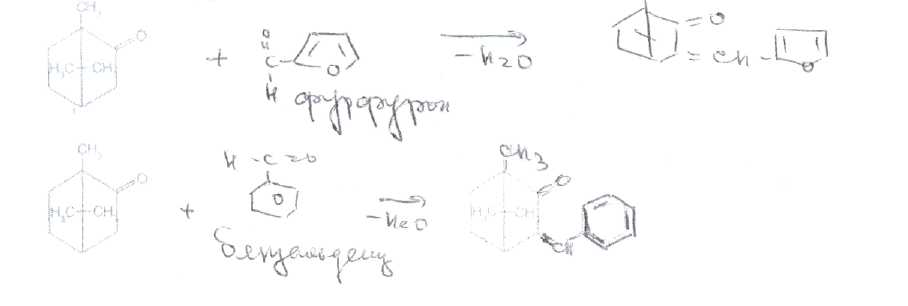
Наличие в молекулах камфоры кетогруппы обусловливает ряд других химических реакций, которые используют для их испытания подлинности и количественного определения. С этой целью применяют реакции образования оксимов. фенилгидразонов, семикарбазонов. ФС рекомендует для подтверждения подлинности камфоры реакцию образования 2,4-динитрофенилгидразона и установления его температуры плавления
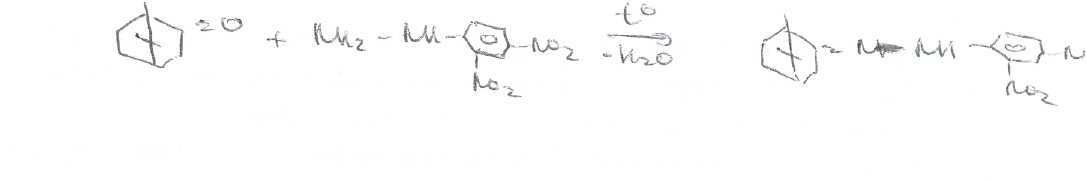
Раствор (0,006%) 2.4-динитрофенилгидразона камфоры в этаноле имеет максимумы поглощения при 231, 365 нм и плечо от 255 до 275 нм. Подлинность камфоры можно подтвердить по температурам плавления и УФ-спектрам других производных камфоры.
Известны способы идентификации спиртовых растворов камфоры и бромкамфоры с использованием метода УФ-спектрофотометрии. Камфора имеет максимум светопоглощения при 231 и 365 нм, плечо — от 273 до 277 нм с незначительным удельным показателем поглощения (около 2).
При испытании бициклических терпенов на чистоту ФС предусматривают установление прозрачности, цветности, рН растворов, микробиологической чистоты. Камфору контролируют на содержание воды, жирных масел, нелетучего остатка.
Для количественного определения камфоры используют оксимный способ, основанный на взаимодействии камфоры с определенным количеством гидрохлорида гидроксиламина:
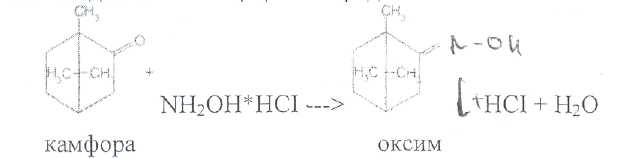
Нерастворимый в воде оксим определяют гравиметрическим методом или титруют выделившееся эквис1алентное количество хлороводородной кислоты титрованным раствором гидроксида натрия.

Количественное определение камфоры может быть также выполнено гравиметрическим методом по содержанию 2,4-динитрофенилгидразона, полученного при нагревании навески в течение 4 ч (с обратным холодильником) с 2.4-динитрофенилгидразином.
Испытание на подлинность и количественное определение камфоры согласно ФС выполняют методом ГЖХ с помощью хроматографа, снабженного детектором по теплопроводности или детектором по ионизации в пламени. Подлинность подтверждают, снимая хроматограммы двух ацетоновых растворов. Один из них содержит толькоиспытуемое вещество, а в другой прибавляют синтетической левовращающей или рацемической камфоры. О подлинности судят по значительному увеличению основного пика камфоры. Количественное определение выполняют методом внутренней нормализации в тех же условиях. Содержание камфоры вычисляют по отношению площади пика камфоры к сумме площадей всех пиков компонентов лекарственного вещества на хроматограмме. Оно должно быть не менее 97% для камфоры, применяемой для инъекций, и не менее 94% для камфоры, используемой для наружного применения. Одновременно по относительным временам удерживания устанавливают возможные примеси трициклена, камфена. фенхона, изофенхона, изофенхола, борнеола, изоборнеола и др.
Камфору применяют в качестве стимулятора центральной нервной системы и кардиотонического средства. Назначают внутрь (0,1-0,2 г) или подкожно в виде 20%-ного масляного раствора. При наружном применении камфора оказывает местное раздражающее и антисептическое действие.
Вопрос 2. Настойка перца стручкового (Tinetura Capsici). Настойка (1:10) на 90% спирте.
Прозрачная жидкость красновато-желтого цвета, жгучего вкуса. Содержит от 0,1 до 1% капсаицина.
Назначают наружно как раздражающее и отвлекающее средство для растирания при радикулитах, миозитах, люмбоишиалгиях и т. п.
Форма выпуска во флаконах но 50 и 100 мл.
Хранение: в прохладном, защищенном от света месте.
Настойки (от лат. tincturae —- погружать, мочить, красить) — это спиртовые извлечения из лекарственного растительного сырья, получаемые без нагревания и удаления экстрагента. Они представляют собой прозрачные окрашенные жидкости, обладающие вкусом и запахом растений, из которых их готовят. Настойки — старейшая лекарственная форма, введенная в медицинскую практику Парацельсом (1495—1541), не утратившая своего значения до настоящего времени, является официнальной но ГФ XI.
Настойки получают методами: мацерации, мацерации с использованием турбоэкстракции, циркуляции экстрагента, дробной мацерации, перколяции, растворением густых и сухих экстрактов. В качестве экстрагента применяют этанол в концентрации от 40 до 95 %. Для настоек принято массообъемное соотношение между сырьем и готовым продуктом. Обычно из 1 части по массе несильнодействующего растительного сырья получают 5 объемных частей готового продукта (1:5), а из одной части сильнодействующего — 10 объемных частей (1:10). В отдельных случаях настойки готовят 1:10 из сырья, не содержащего сильнодействующих веществ (настойка арники, боярышника, календулы) и в других соотношениях.
Получение настоек состоит из следующих стадий: подготовка лекарственного растительного сырья и экстрагента, экстрагирование лекарственных веществ из растительного материала (растворение густых или сухих экстрактов), очистка извлечения, стандартизация готового продукта.
Подготовка растительного материала заключается в подсушивании, измельчении иосвобождении от пыли. Экстрагент готовят разведением крепкого этанола водой до нужной концентрации.
При получении настоек методом мацерации растительный материал истощается неполностью, особенно, когда объем экстрагента ограничен, поэтому в настоящее время предложены различные, более совершенные его модификации. Наряду с ним часто используют метод перколяции. Растворением сухих экстрактов получают лишь отдельные настойки (например, чилибухи), растворением густого экстракта солодки— грудной эликсир.
Настойки по степени очистки являются одними из самых несовершенных препаратов. Очистка настоек заключается в отстаивании полученного извлечения в течение нескольких дней при температуре не выше 8 °С. В период отстаивания коагулируют и выпадают в осадок многие высокомолекулярные соединения, различные механические включения. Отстоявшуюся вытяжку сливают и фильтруют через друк- или пресс-фильтры, нутч-фильтры использовать не следует из-за возможной потери экстрагента.
Стандартизацию настоек проводят по этанолу, содержанию действующих или экстрактивных веществ, регламентируют тяжелые металлы (не более 0,001 %)
Содержание этанола устанавливают по температуре кипения или методом дистилляции с последующим определением плотности отгона пикнометром (ГФ XI).
Мацерация
Мацерация (от лат maceratio ■— вымачивание) относится к статическим методам экстрагирования. Ранее он широко применялся для получения настоек и был официнальным по ГФ VIII. Метод заключается в настаивании в мацерационном баке необходимого для получения настойки количества материала с прописанным объемом экстрагента при комнатной температуре в течение 7 сут (если в НТД нет других указаний) с периодическим перемешиванием мешалкой. После этого сырье отжимают и замеряют объем полученной вытяжки. Поскольку часть экстрагента удерживается в шроте, его промывают чистым экстрагентом в количестве, равном оставшемуся в сырье, повторно отжимают и обе порции извлечения объединяют. Если полученная вытяжка не соответствует заданному объему готового продукта, то добавляют чистый экстрагент.
Метод малоэффективен. Растительный материал большую часть времени находится в неподвижном состоянии, коэффициент конвективной диффузии невелик. Процесс протекает медленно, так как выравнивание концентрацией веществ внутри растительной клетки и во внешнем слое эстрагента идет в основном за счет молекулярной диффузии. Велики потери на диффузии. Поэтому в данном варианте метод применяется крайне редко: при экстрагировании свежего растительного сырья и для получения настоек из «неорганизованного» материала (не имеющего клеточной структуры).
С целью интенсификации экстрагирования материала процесс ведут при постоянном перемешивании мешалками или во вращающихся мацерационных баках-турбулах. Время экстрагирования при этом можно сократить в несколько раз. Процесс мацерации часто сопровождают циркуляцией экстрагента. После настаивания сырья полученную вытяжку с помощью центробежного насоса возвращают на сырье и вновь настаивают. Циркуляция экстрагента приводит к более быстрому выравниванию концентраций, т. е. к завершению процесса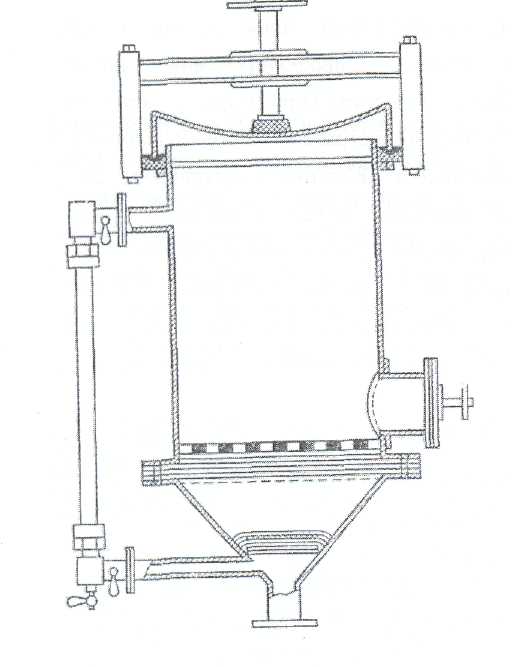
Рис. 1. Устройство цилиндрического перколятора.
. Метод перколяции включает три последовательно протекающие стадии: намачивание сырья, настаивание, собственно перколяция.
Намачивание рекомендуется проводить вне перколятора (в мацерационном баке или любой другой емкости) половинным или равным количеством экстрагента по отношению к массе сырья, в течение 4—5 ч без перемешивания. За счет капиллярных сил экстрагент проникает между кусками растительного материала и внутрь клетки, происходит так называемая капиллярная пропитка. Сырье набухает со скоростью, зависящей от свойств материала и природы экстрагента. Многие виды лекарственного растительного сырья обладают дифильными свойствами, но имеют большее сродство к гидрофильным экстрагентам. Такое сырье лучше набухает при использовании воды или слабого этанола (20—30%), особенно если в нем содержится много пектиновых веществ или низкомолекулярных белков. Наименьшее набухание этих видов сырья вызывает крепкий этанол и различные органические растворители. При намачивании происходит растворение действующих веществ внутри клетки и образование концентрированного первичного сока.
В производственных условиях намачивание проводится не всегда и может быть объединено с застаиванием. Однако в том случае, когда сырье способно сильно набухать, стадию намачивания шускать не рекомендуется, так как достигается равномерная загрузка сырья в перколятор, исключается возможность образования воздушных полостей, которые препятствуют прохождению жстрагента. Кроме того, материал может сильно спрессоваться и вообще не пропустить экстрагент.
Настаивание — следующая стадия процесса перколяции. Набухший или сухой материал ;агружают в перколятор на ситчатое (ложное) дно достаточно плотно, чтобы в сырье оставалось как южно» меньше воздуха. Материал, способный слеживаться, укладывают в перколятор слоями. Длятакого сырья перколяторы снабжают специальными ситовидными прокладками. Сверху
растительный материал покрывают куском полотна и прижимают перфорированным диском.
г^ х- Ремацерация .
Экстрагентом заливают сырье. Ьго подают в перколятор сверху или снизу (при открытом кране для
|
|
|
 Скачать 11.63 Mb.
Скачать 11.63 Mb.