Билет 1. Вопрос Ингалипт
 Скачать 11.63 Mb. Скачать 11.63 Mb.
|
|
Принципы лицензирования. Основными законодательно утвержденными принципами осуществления лицензирования в РФ являются: обеспечение единства экономического пространства на территории РФ; установление единого перечня лицензируемых видов деятельности; установление единого порядка лицензирования на территории РФ; установление лицензионных требований и условий положениями о лицензировании конкретных видов деятельности; гласность и открытость лицензирования: соблюдение законности при осуществлении лицензирования. Единство экономического пространства. В целях обеспечения единства экономического пространства на территории РФ правительство утверждает Положения о лицензировании конкретных видов деятельности, определяет федеральные органы исполнительной власти, осуществляющие лицензирование конкретных видов деятельности, устанавливает виды деятельности, лицензирование которых осуществляется органами исполнительной власти субъектов Федерации. В принятом Федеральном законе «О лицензировании отдельных видов деятельности» даются общие нормы права, единые для всех видов деятельности, регулируемых данным законом. Таким образом, для учета особенностей лицензируемых видов деятельности Правительством РФ специальными постановлениями утверждаются Положения о лицензировании конкретных видов деятельности. Любое изменение в федеральном законодательстве должно сопровождаться приведением в соответствие с ним всех подзаконных актов. Так, в связи с выходом в 2001 г. Федерального закона, регулирующего процесс лицензирования, началась работа по приведению существующих положений в соответствие с новым законом. В настоящее время приняты постановления Правительства РФ: «Об утверждении Положения о лицензировании фармацевтической деятельности» от 01.07.2002 № 489, «О лицензировании деятельности, связанной с оборотом наркотическихсредств и психотропных веществ» от 21.06.2002 № 454, «Об утверждении Положения о лицензировании деятельности по культивированию растений, используемых для производства наркотических средств и психотропных веществ» от 14.06.2002 № 423, «Об утверждении Положения о лицензировании производства лекарственных средств» от 04.07.2002 № 500, «Об утверждении Положения о лицензировании медицинской деятельности» от 04.07.2002 № 499 и др. Единый перечень лицензируемых видов деятельности. Он устанавливается Федеральным законом, где в соответствующей статье перечислены подпадающие под его действие виды деятельности (в Федеральном законе «О лицензировании отдельных видов деятельности» — это ст. 17). Среди перечисленных видов деятельности так или иначе связаны с деятельностью субъектов фармацевтического рынка следующие: фармацевтическая деятельность; производство ЛС; производство медицинской техники; деятельность по распространению ЛС и ИМН; культивирование растений, используемых для производства наркотических средств и психотропных веществ; деятельность, связанная с оборотом наркотических средств и психотропных веществ (разработка, производство, изготовление, переработка, хранение, перевозки, отпуск, реализация, распределение, приобретение, использование, уничтожение), внесенных в Список II в соответствии с Федеральным законом «О наркотических средствах и психотропных веществах»; деятельность, связанная с оборотом наркотических средств и психотропных веществ (разработка, производство, изготовление, переработка, хранение, перевозки, отпуск, реализация, распределение, приобретение, использование, уничтожение), внесенных в Список Ш в соответствии с Федеральным законом «О наркотических средствах и психотропных веществах»; деятельность, связанная с использованием возбудителей инфекционных заболеваний; производство дезинфекционных, дезинсекционных, дератизационных средств; аудиторская деятельность; деятельность по изготовлению и ремонту средств измерений; ветеринарная деятельность; медицинская деятельность и др. Как уже упоминалось, для учета особенностей каждого конкретного вида деятельности разрабатываются специальные положения, которые утверждаются постановлениями Правительства РФ. Аналогичные положения могут быть утверждены в субъектах РФ. которые представляют региональный уровень управления и которым дано право определять порядок лицензирования на своей территории в соответствии с местными условиями. Например, в Москве распоряжением мэра утверждено Временное положение о порядке лицензирования фармацевтической деятельности на территории города Москвы, которое разработано с учетом федеральных правовых документов, специальным приказом Комитета здравоохранения Правительства Москвы № 369 от 20.08.2001 утверждено Положение о лицензировании медицинской и фармацевтической деятельности в городе Москве, определяющее порядок получения лицензии в столице. Единый порядок лицензирования. Он обусловлен: едиными правами и полномочиями, предоставленными лицензирующим органам; требованиями, предъявляемыми к соискателям лицензий и лицензиатам; процедурой лицензирования. К лицензирующим органам в России относятся федеральные органы исполнительной власти и органы исполнительной власти субъектов РФ. которые осуществляют лицензирование в соответствии с действующим законом. Билет 4 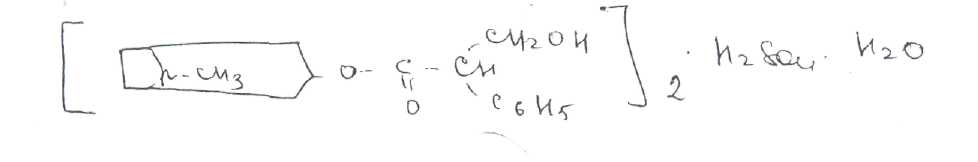 Вопрос 1. На рисунке представлена формула атропина сульфата. —Atropine Sulfate —атропина сульфат Вопрос 1. На рисунке представлена формула атропина сульфата. —Atropine Sulfate —атропина сульфаттропинового эфира сЦ-троповой кислоты сульфат Белый кристаллический или слегка комкующийся порошок без запаха. Т. пл. атропина сульфата 188-194 °С Т. пл. основания атропина 115-117°. Угол вращения не более -0,6° (5%-ный водный раствор в трубке длиной 2 дм) Соли тропановых алкалоидов и их синтетических аналогов легко растворимы в воде (атропина сульфат — очень легко), легко растворимы в этаноле. В хлороформе атропина сульфат практически нерастворим, ' Известны спектрофотометрические методики идентификации атропина сульфата в максимумах поглощения при длинах волн 252, 258 и 264 нм (растворитель вода). Количественное спектрофотометрическое определение с достаточной точностью выполнить в УФ-области не представляется возможным, так как удельный показатель поглощения в этих условиях очень низкий (от 4,13 до 5,41). Методом ВЭЖХ на жидкостном хроматографе «Милихром» разработаны способы идентификации и определения производных тропана в лекарственных формах. Предложена унифицированная методика, основанная на использовании времени удерживания, коэффициента емкости и других факторов. Испытания алкалоидов, производных тропана и их синтетических аналогов осуществляют также с помощью химических реакций: гидролиза, нитрования, окисления, сложной эфирной группы  Для испытания подлинности и количественного определения производных тропана использован метод ГЖХ. Качественную оценку осуществляют по относительным объемам удерживания и индексам удерживания Ковача. При выполнении количественного определения используют внутренний стандарт. Реакция основана на их гидролизе, нитровании и окислении выделившихся кислот (при выпаривании с концентрированной азотной кислотой). При действии на остаток после выпаривания спиртовым раствором гидроксида калия и ацетона происходит образование окрашенного в фиолетовый цвет соединения хиноидной структуры. Схема реакции на примере троповой кислоты: 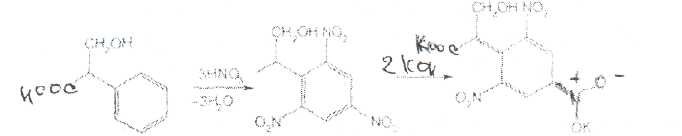 Общее испытание заключается в осаждении органических оснований из растворов действием гидроксидов щелочных металлов. Эту реакцию используют для установления подлинности атропина сульфата, основания которых имеют характерную температуру плавления. 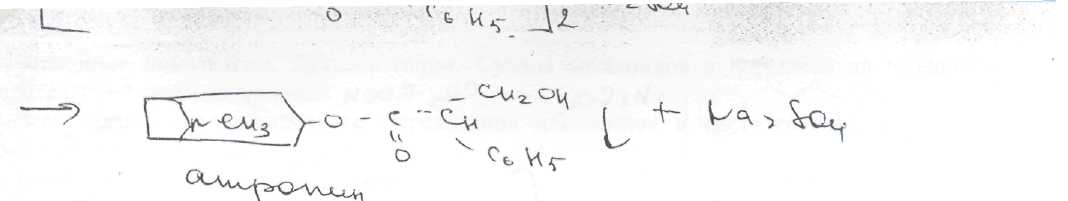 Производные тропана можно также идентифицировать осадительными (общеалкалоидными) реактивами: раствором пикриновой кислоты, раствором иода, реактивами Марки, Драгендорфа и др. ^__  При нагревании основания атропина с раствором серной кислоты в присутствии кристалла дихромата калия ощущается запах горького миндаля вследствие образования бензальдегида: 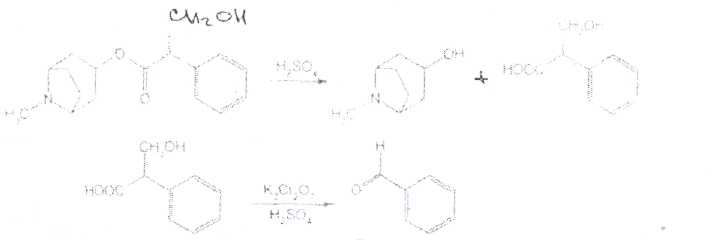 бензальдегид При испытании на чистоту устанавливают допустимые пределы примесей посторонних алкалоидов. Это вызвано тем, что исходный продукт синтеза — тропин получают обычно гидролизом смеси алкалоидов, производных тропана. Допустимо содержание апоатропина в атропина сульфате (не более 0.2%),. Эти посторонние алкалоиды обладают восстанавливающими свойствами (обесцвечивают раствор перманганата калия) вследствие наличия в молекуле непредельной связи: 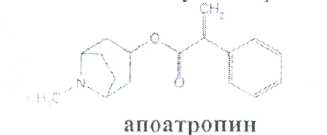 Указанные примеси определяют также методом ТСХ на пластинках Силуфол УФ-254. Количественное определение производных тропана выполняют методом неводного нитрования. Титруют в среде безводной уксусной кислоты 0,1 М раствором хлорной кислоты 'индикатор кристаллический фиолетовый). 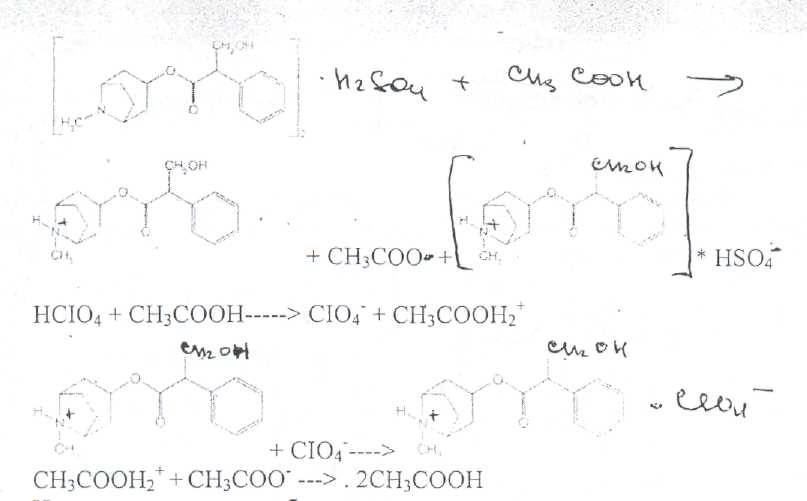 Известны также спосооы определения производных тропана методом нейтрализации в водно-спиртовой среде в присутствии хлороформа, который извлекает образующееся в процессе титрования основание (индикатор фенолфталеин).  Атропина сульфат хранят по списку А, в хорошо укупоренной таре, предохраняя от действия света и влаги. Вопрос 2. Folia Hyoscyami(Folia Hyoscyaminigri) — листья белены (Hyoscyamifolia — белены лист) Белена черная (HyoscyamusnigerL.) из сем. пасленовых (Solanaceae); используют в качестве лекарственного сырья и лекарственного средства. Химический состав. Листья белены содержат сумму алкалоидов тропанового ряда (0.04-0,16 0//°) — гиосциамин, тиосцин, апогиосцин, скополамин, апоатропин; флавоноиды — спиреозид, кверцитрин, гиперозид. рутин. Внешние признаки. Цельное сырье. Представлено цельными или частично измельченными листьями. Листья продолговато-яйцевидной или эллиптической формы, перисто надрезанные, перистолопастные или цельные с неравномерно-зубчатым краем. Прикорневые листья с длинным черешком, с обеих сторон покрыты густыми, длинными, мягкими волосками; стеблевые — без черешков, менее опушены, волоски располагаются преимущественно по жилкам и краю пластинки листа. Длина листьев 5-20 см; ширина 3-10 см. Главная жилка беловатая, плоская, сильно расширяется к основанию. Цвет листьев серовато-зеленый. Запах слабый, вкус не определяется (!). Микроскопия. Клетки эпидермиса с верхней стороны с мало извилистыми стенками, с нижней — с более извилистыми. Устьица, многочисленные с обеих сторон листа анизоцитного типа. Диагностическим признаком является наличие многочисленных волосков двух типов: простых и головчатых-. Простые волоски тонкостенные, одни из них 2-3-клеточные, небольшие, другие многоклеточные, очень крупные. Головчатые волоски с длинной многоклеточной ножкой и 4-8-клеточной железистой головкой . В мезофилле листа содержатся одиночные призматические кристаллы кальция оксалата; нередко в поздно собранных листьях встречаются друзы. В крупных жилках имеются овальные клетки, заполненные кристаллическим песком. Числовые показатели. Цельное сырье. Суммы алкалоидов в пересчете на гиосциамин. определенной титриметрически. Весь процесс количественного определения алкалоидов в растительном сырье можно разделить на три основных стадии: 1) извлечение алкалоидов из сырья; 2) очистка извлеченных алкалоидов от сопутствующих веществ: смолы, пигменты, жиры, пектиновые вещества и др.; ■ 3) количественное определение выделенных и очищенных алкалоидов, (методика основана на выделении алкалоидов в виде оснований и затем применяется обратное кислотно-основное титрование) Хранение. Все алкалоидное сырье относится к сильнодействующему и ядовитому, поэтому хранят его с предосторожностью по списку Б. Срок годности 3 года. Использование. Основное терапевтическое действие — спазмолитическое. м-холиноблокирующее. анальгезирующее. раздражающее. Листья входят в состав противоастматического сбора; используются для получения беленного масла, применяемого как отвлекающее средство при невралгиях в составе комплексных препаратов «Салинимент», «Капсин» и «Линимент метилсалицилата сложный». Используется в гомеопатии. 4 Вопрос 3. Атропина сульфат в очень малых дозах (0,0005-0.001 г внутрь или 0,25-0.5 мл 0,1%-ного раствора при подкожном введении) назначают при бронхиальной астме, спазмах кишечника, мочевых путей. Для лечения глазных заболеваний атропина сульфат и гоматропина гидробромид используют в виде 0,5-1,0%-ных растворов. ТЕХНОЛОГИЧЕСКАЯ СХЕМА ПОЛУЧЕНИЯ АМПУЛИРОВАННЫХ ЛЕКАРСТВЕННЫХ ФОРМ ВР-1. Изготовление ампул ВР-1.1. Варка стекла ВР-1.2. Изготовление дрота ВР-1.3. Калибровка дрота ВР-1.4. Мойка дрота ВР-1.5. Сушка дрота В Р-1.6. Выделка ампул ВР-1.7. Отжиг ампул ВР-2. Подготовка ампул к наполнению ВР-2.1. Обрезка капилляров ВР-2.2. Мойка наружной поверхности ампул ВР-2.3. Мойка ампул изнутри ВР-2.4. Контроль качества мойки ВР-2.5. Сушка и стерилизация ампул ВР-3. Получение и подготовка растворителя ВР-4. Подготовка лекарственных веществ ТГТ-5. Изготовление раствора ТП-5.1. Растворение лекарственного вещества ТП-5.2. Стабилизация (изотонирование, введение консервантов) ТП-5.3. Стандартизация ТП-5.4. Очистка (фильтрование) ТП-6. Амиулирование . ТП-6.1, Заполнение ампул ТП-6.2. Запайка капилляров ТП-6.3. Стерилизация ТП-6.4. Оценка качества продукции и брокераж УМО-7. Маркировка и упаковка Требования, предъявляемые к инъекционным лекарственным формам.1. Стерильность - отсутствие жизнеспособных микроорганизмов и их спор. 2. Апирогенность - отсутствие продуктов жизнедеятельности и распада микроорганизмов. 3. Стабильность - неизменяемость по составу и количеству находящихся в растворе лекарственных веществ в течение установленных сроков хранения 4. Отсутствие механических включении - прозрачность инъекционного раствора (или отсутствие каких-либо взвешенных частиц) Обеспечить эти требования должен весь технологический процесс (помещения, технологическое оборудование, упаковка, система вентиляции, транспортные системы ввода сырья и вывода готового продукта, обслуживающий персонат). Выработаны специальные условия выполнения стадий и операций технологического процесса для соответствия готового раствора требуемым стандартам. Повышенные требования предъявляются к следующим объектам: 1) производственным помещениям; 2) технологическому оборудованию; 3) системам подготовки основных и вспомогательных материалов; 4) вентиляции; 5) обслуживающиему персоналу. GMP (правила надлежащего производства) - это единая система требований по организации производства и контролю качества лекарственных средств от начала переработки сырья до производства готовых продуктов, включая общие требования к помещениям, оборудования и персоналу. В России данную функцию выполняет руководящий нормативный документ РД 64-125-91 "Правила организации производства и контроля качества лекарственных средств", утвержденный приказом Министра медицинской промышленности СССР в 1992 г. Согласно данному документу все помещения для производства лекарств в асептических условиях делятся на 4 класса в зависимости от чистоты воздуха. 1-й класс чистоты достигается установкой в помещении 2-го класса "чистых" камер с подачей ламинарного потока чистого стерильного воздуха. В помещениях 1-го класса выполняются наиболее ответственные технологические операции: выгрузка стерильных флаконов, пробок, колпачков, разлив стерильного раствора, фасовка стерильных порошков, предукупорка и укупорка флаконов пробками, сборка стерилизующих фильтров, отбор проб. 2-й и 3-й классы чистоты обеспечиваются за счет технологических и санитарных мероприятий, стерильной приточной вентиляции, рециркуляционных очистителей воздуха, увеличением кратности воздухообмена, специальной подготовки помещений и персонала. В помещениях 2-го касса чистоты производится изготовление растворов, фильтрование, мойка ампул и флаконов, их сушка и стерилизация. Помещения 3-го класса используются для мойки и стерилизации вспомогательного материала. В помещениях 4-го класса осуществляется мойка дрота, выделка ампул и т.д. Основные требования GMP к производству инъекционных лекарственных форм заключаются в следующем: ♦ в работе участвуют минимальное количество людей: ♦ активность человека должна быть сведена к минимуму, чтобы избежать изменения перемещения частиц и микроорганизмов; ♦ одежда должна соответствовать процессу и рабочему месту и предохранять продукт от загрязнения; ♦ исходный материал не должен быть обсеменен микроорганизмами и пирогенными веществами; ♦ хранение воды, используемой для изготовления инъекционных растворов, осуществляется при постоянной циркуляции и температуре выше 80 °С; ♦ предохранение лекарственной формы перед стерилизацией для предупреждения кантаминации (повторного обсеменения) микроорганизмами; ♦ интервал между изготовлением и стерилизацией должен быть минимальным;♦ каждый цикл стерилизации контролируется биологическими и химическими способами; ♦ пробы раствора, взятые на анализ для определения стерильности, должны включать пробы в начале и в конце работы, пробы после значительного перерыва в работе и пробы из потенциально наиболее холодной части загрузки автоклава, ♦ на пирогенность контролируется вода, промежуточные и конечные продукты, ♦ помещения должны иметь многоступенчатую систему приточно-вытяжной вентиляции, ♦ между помещениями различных классов чистоты должна поддерживаться разность давления, причем давление в помещениях более высокого класса чистоты должно быть выше; ♦ ответственные операции должны быть защищены установками ламинарного потока стерильного воздуха (движение параллельных потоков стерильного воздуха внутри ограниченного пространства); ♦ санитарно-бытовые помещения должны примыкать к производственным; ♦ вход персонала и передача материала в производственные помещения должны осуществляться через воздухошлюзы: ♦ для облегчения уборки и обработки дез. растворами сопряжения между стенами, полом и потолком должны быть закругленной формы; ♦ между помещениями различных классов чистота должны быть переговорные устройства; ♦ запрещается применение фильтров, выделяющих волокна и др. Атропина сульфат - список А Лекарственные средства размещаются в соответствии с токсикологическими группами. Список А. Это группа высокотоксичных лекарственных средств. Порошки с сильнодействующими и ядовитыми веществами Хранение, учет и отпуск ядовитых, наркотических и сильнодействующих лекарственных средств в аптеках регламентируются требованиями следующих приказов МЗ РФ: № 523 от 03.07.68 г.. № 330 от 12.11.97 г., № 328 от 23.08.99 г., Постановление Правительства РФ № 681 от 30.06.98 г. Правила хранения, учета и отпуска ядовитых, наркотических и сильнодействующих лекарственных средств Хранение ядовитых, наркотических и сильнодействующих веществ: 1. Возложить персональную ответственность за учет, сохранность, отпуск, назначение и использование наркотических лекарственных средств в аптечных учреждениях на управляющих аптеками. 2. Обеспечить все места хранения наркотических средств в аптечных учреждениях охранной сигнализацией и сейфами. При отсутствии возможности проведения указанных мероприятий изъять наркотические средства из этих учреждений, возложив обеспечение наркотическими лекарственными средствами через другие учреждения, имеющие соответствующие условия хранения наркотиков. 3. Выдача наркотических и особо ядовитых средств в ассистентскую комнату должна производиться из материальной комнаты только управляющим аптекой или лицом, уполномоченным на это. 4. Ядовитые и наркотические лекарственные средства, относящиеся к списку А. должны храниться изолированно, в специальных металлических шкафах (сейфах) под замком. Наркотические и особо ядовитые средства: мышьяковистый ангидрид, натрия арсенат кристаллический, стрихнина нитрат, ртути дихлорид (сулема), ртути цианид и оксицианид -должны храниться во внутреннем, запирающемся на замок отделении сейфа. 5. На внутренней стороне дверок сейфов, в которых хранятся лекарственные средства списка А, должна быть надпись «A» «Venena», а на внутренней стороне дверок сейфов, в которых хранятся лекарственные средства списка Б, —- надпись «Б» «Heroica» и переченьядовитых, наркотических и сильнодействующих лекарственных средств с указанием высших разовых и суточных доз. 6. В шкафах «А» для изготовления лекарств с ядовитыми средствами должны храниться ручные весы, разновес, ступки, цилиндры и воронки, мытье и обработка которых производится отдельно от другой посуды под наблюдением фармацевта. Желательно на посуде, используемой для изготовления лекарств, иметь маркировку: «Для атропина», «Для сулемы» и т. д. 7. Надписи на штангласах, в которых хранятся ядовитые лекарственные средства, должны быть белого цвета на черном фоне, а на штангласах, содержащих сильнодействующие лекарственные средства, — красного цвета на белом фоне. В обоих случаях на штангласах должны быть указаны высшие разовые и суточные дозы. Прием рецептов, изготовление и отпуск лекарственных средств 1. При приеме рецептов на лекарственные средства, в состав которых входят ядовитые или сильнодействующие лекарственные средства, фармацевт обязан уточнить возраст пациента, проверить правильность дозировки, совместимость прописанных ингредиентов в лекарственной форме и подчеркнуть красным карандашом наименование ядовитого препарата. 2. Ядовитые и наркотические средства, входящие в состав лекарственного средства, должны отвешиваться провизором-технологом в присутствии ассистента, после чего штанглас немедленно убирается в шкаф. На обратной стороне рецепта и паспорте письменного контроля провизор-технолог расписывается в выдаче, а фармацевт в получении требуемого количества ядовитого средства с указанием его наименования, количества и даты. 3. Полученное фармацевтом ядовитое средство должно быть немедленно использовано для изготовления лекарственного средства, которое тотчас же передается провизору-технологу для проверки. 4. Изготовленные лекарственные средства, содержащие ядовитые средства, опечатываются лицом, проверившим лекарственную форму, или укупориваются «под обкатку» и хранятся до отпуска в отдельном запирающемся шкафу. 5. Если в рецепте наряду с другими ингредиентами прописаны ядовитые, наркотические и сильнодействующие средства, то отпускать их отдельно (не в составе изготовленного лекарственного средства) запрещается. 6. Наркотические лекарственные средства, выписываемые на специальных рецептурных бланках, отпускаются только из аптек, прикрепленных для этих целей к территориальным амбулаторно-поликлиническим учреждениям. Перечень амбулаторно-поликлинических учреждений и аптек определяется органами здравоохранения и аптечными управлениями на местах. 7. Обязать руководителей лечебно-профилактических и аптечных учреждений здравоохранения: ► ежемесячно контролировать обновление списков инкурабельных онкологических больных в прикрепленных аптечных учреждениях; ► обеспечить сохранность емкостей с эфиром, баллонов с закисью азота, фторотаном, кислородом. В соответствии с требованиями ГФ XI ядовитые и сильнодействующие вещества в количествах менее 0,05 г на всю массу порошков используют в виде тритурации — смесей с молочным сахаром или другими вспомогательными веществами, разрешенными к медицинскому применению в соотношениях 1:100 или 1:10. Особые случаи приготовления. Тритурации Тритурация 1:100 содержит 1,0 г ядовитого вещества и 99,0 г вспомогательного вещества и используется, как правило, тогда, когда общее количество ядовитого вещества в рецепте не превышает тысячных долей грамма. Тритурация 1:10 содержит 1,0 г ядов итогового вещества и 9,0 г молочного сахара и используется, как правило, когда в рецепте общее количество ядовитого вещества достигаетсантиграммов. Тритурации готовят в отдельных ступках, в которых предварительно растирают молочный сахар в количестве, не превышающем соотношение 1:20. К сахару прибавляют навеску ядовитого вещества, тщательно измельчают и затем порциями добавляют оставшееся количество сахара. Тритурацию помещают в небольшой штанглас и оформляют этикеткой. Например: |
