Билет 1. Вопрос Ингалипт
 Скачать 11.63 Mb. Скачать 11.63 Mb.
|
|
Факторы, влияющие на основные качества таблеток — механическую прочность, распадаемость и среднюю массу Механическая прочность таблеток зависит от многих факторов. В случае применения способа прямого прессования прочность таблеток будет зависеть от физико-химических свойств прессуемых веществ. Прочность таблеток, получаемых методом влажной грануляции, зависит от количества, природы связывающих (склеивающих) веществ, от величины давления прессования и от влажности таблетируемого материала. Количество склеивающих веществ и оптимальная влажность, как правило, указываются в промышленных регламентах. Давление прессования подбирается для каждого препарата и контролируется путем измерения прочности таблеток и времени их распадаемости. Излишнее давление прессования часто приводит к расслаиванию таблеток. Кроме того, происходит резкое уменьшение пор, что снижает проникновение жидкости в таблетку, увеличивает время ее распадаемости. Влагосодержание выше оптимального приводит к прилипанию таблеточной массы к пресс-инструменту. Недостаточное содержание влаги, т. е. пересушивание материала, приводит к расслаиванию в момент прессования или же к недостаточной механической прочности. Распадаемость и растворимость таблеток также зависит от многих факторов:■— количества и природы связывающих веществ; — количества и природы разрыхляющих веществ, способствующих распадаемости таблеток; — давления прессования; — физико-химических свойств веществ, входящих в таблетку —- прежде всего от способности их к смачиваемости, набуханию и растворимости. Средняя масса таблеток также зависит от ряда составляющих: — сыпучести материала; — фракционного состава; — формы загрузочной воронки и угла ската; — скорости вращения матричного стола, т. е. от скорости прессования. Влияние вспомогательных веществ и вида грануляции на биодоступность лекарственных веществ из таблеток Ни один фармацевтический фактор не оказывает столь значительного и сложного влияния на действие препарата, как вспомогательные вещества. При изготовлении лек. формы фармацевт поступил не верно, так как лек. формы для внутреннего применения для новорожденных готовят без применения стабилизатоа и должны быть стерильными, кислота глутаминовая растворима в горячей воде. Rp.: Solutionis Glucosi 10% - 100 ml Acidi glutaminici 1,0 Misce. Da. Signa: По 1 чайной ложке 3 раза в день ребенку пятнадцати дней. 6.2. Свойства ингредиентов Glucosum — бесцветные кристаллы или белый мелкокристаллический порошок без запаха, сладкого вкуса. Растворим в 1,5 ч. воды (ГФ X, ст. 311). Acidum glutaminicum — белый кристаллический порошок с едва ощутимым запахом, кислого вкуса. Мало растворим в воде, растворим в горячей воде (ГФ X, ст. 15). Жидкая лекарственная форма для внутреннего применения, представляющая собой истинный раствор. Предназначена для новорожденного. Паспорт письменного контроля Лицевая сторона Дата № рецепта Aquae destillatae seu pro mjectionibus 93,6 ml Acidi glutaminici 1,0 Glucosi 11,11 ________ Объем 100 Простерилизовано Приготовил (подпись) Проверил (подпись) Отпустил (подпись) Оборотная сторона Глюкозы б/в 10,0Глюкозы с влажностью 10% 10x100- 11,11 г 100x10 Кислоты глютаминовой 1,0 Воды очищенной или для инъекций 100-(10x0,64)-93,6 мл. Технология лекарственной формы с теоретическим обоснованием Прописан истинный раствор мало растворимого (кислота глютаминовая) и растворимого (глюкоза) в воде веществ, предназначенного для новорожденного. Согласно приказу МЗ РФ № 1026 от 19.10.82 г. раствор для внутреннего применения должен быть стерильным. Растворы внутреннего употребления для новорожденных детей изготовляются в асептических условиях, массо-объемным способом на очищенной воде без добавлений стабилизаторов и консервантов (Методическое письмо ГАПУ МЗ РСФСР № 42 от 24.05.84 г.). Приготовление водных растворов, как и других жидких лекарственных форм, регламентируется «Инструкцией по приготовлению жидких лекарственных средств массо-объемным методом» (приказ МЗ РФ № 308 от 21.10.97 г.). При расчете количества глюкозы учитывается влажность вещества. В данной прописи концентрация веществ более 3%, поэтому необходимо учитывать, что лекарственные вещества, взятые в таких количествах, вызовут изменение объема раствора, превышающее допустимые нормы отклонений (приказ МЗ РФ № 305 от 16.10.97 г.). Расчет количества воды ведут, используя КУО. Коэффициент увеличения объема для кислоты глютаминовой отсутствует, но ее прописано мало, поэтому увеличением объема при растворении ее можно пренебречь. В асептических условиях (приказ МЗ РФ № 309 от 21.10.97 г.) в стерильную широкогорлую склянку (подставку) в первую очередь отмеривают 93,6 мл горячей свежеперегнаннои очищенной воды или воды для инъекций и растворяют в соответствии с физико-химическими свойствами вначале кислоту глютаминовую, как малорастворимое вещество (легко растворима в горячей воде), а затем глюкозу (растворимое вещество) и фильтруют в стерильный флакон вместимостью 100 мл через стерильный фильтр с размером пор 10—16 мкм или стерильную фильтровальную бумагу и медицинскую вату. Лекарственную форму для новорожденного до стерилизации проверяют на подлинность и чистоту и подвергают полному химическому контролю согласно приказу МЗ РФ № 214 от 16.07.97 г. При отсутствии механических включений флакон укупоривают стерильной резиновой пробкой и металлическим колпачком «под обхватку» или стерильной стеклянной пробкой со шлифом (в последнем случае пробку обвязывают пергаментной бумагой). Проверяют качество укупорки. На обвязке надписывают простым карандашом состав и концентрацию раствора, фамилию приготовившего лекарственную форму. Раствор стерилизуют насыщенным водяным паром под давлением 1.1 кгс/см (120° С) — 8 минут в соответствии с методическими рекомендациями ГФ XI (методическое письмо ГАПУ 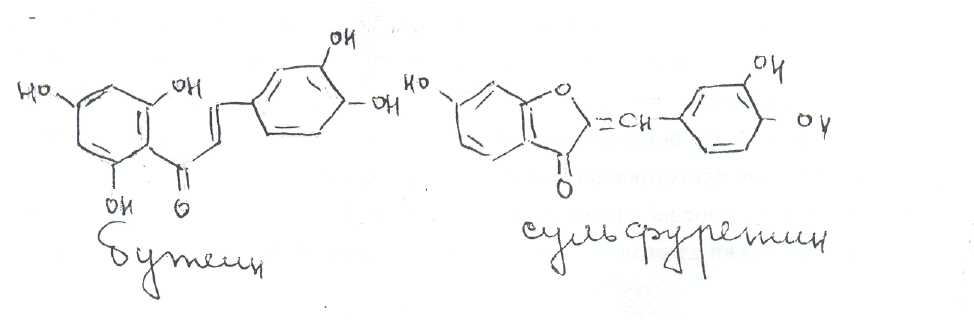 МЗ РСФСР № 42 от 24.05.84 г.). Упаковка и оформление Флакон оформляют этикеткой «Внутреннее». «Стерильно». «Детское», «Хранить v защищенном от света месте». На этикетке указаны № аптеки, номер рецепта, Ф.И.О. больного, способ применения, дата изготовления (число, месяц, год) и цена лекарственного средства. На этикетке делается пометка: «После вскрытия раствор должен быть использован в течение 2 суток при условии хранения его в холодильнике» (приказ МЗ РФ № 376 от 13.11.96 г. и Методическое письмо ГАПУ МЗ РСФСР № 42 от 24.05.84 г.). При отсутствии методов количественного анализа лекарственных форм, указанных в - приказе МЗ РФ № 214 от 16.07.97 г., лекарственные формы должны быть проверены качественным анализом. Как исключение, изготовление лекарственных форм для новорожденных детей, сложных по составу, не имеющих методик качественного и количественного анализа, проводится в присутствии провизора-аналитика или провизора-технолога «под наблюдением». Оценка качества Анализ документации. Вещества в прописи совместимы; исправление объема лекарственной формы и расчеты сделаны правильно, паспорт письменного контроля выписан верно, в соответствии с технологией изготовления (приказ МЗ РФ № 214 от 16.07.97 г.). Правильность упаковки и оформления. Лекарственный препарат снабжен этикеткой «Внутреннее» с указанием номера аптеки, номера рецепта, Ф.И.О. пациента, способа применения, даты изготовления (число, месяц, год), цены лекарственного средства, срока и условий хранения. Раствор отпускают в герметично укупоренном флаконе оранжевого стекла. Объем флакона соответствует объему лекарственной формы. Органолептический контроль. Вкус сладковато-кислый, без запаха, прозрачного цвета. Механические включения отсутствуют. Вопрос 3. Herba Bidentis(Herba Bidentistripartitae) — трава череды череда трехраздельная (BidenstripartitaL) из сем. сложноцветных — Asteraceae (Compositae); используют в качестве лекарственного средства. Химический состав. В траве череды содержится значительное количество каротиноидов (до 50 мг% каротина), кислоты аскорбиновой (60-70 мг%), а также флавоноидов — бутеин, сульфуретин, сульфуреин, лютеолин, цинарозид и др. (более 10 веществ); кумарины, полисахариды, дубильные вещества. Микроскопия. Диагностическое значение имеют секреторные ходы с красновато-бурым содержимым вдоль жилок и по краю листа. Кроме того, встречаются по всей пластинке простые «гусеницеобразные» волоски с тонкими стенками, а по краю и жилкам — простые волоски с толстыми стенками и продольной складчатостью кутикулы Числовые показатели. Измельченное сырье. Кусочков стеблей не более 40 %; частиц, не проходящих сквозь сито с отверстиями диаметром 7 мм, не более 10 %; частиц, проходящих сквозь сито с отверстиями диаметром 0,5 мм, не более 15 %; органической примеси не более 3 %; минеральной — не более 1 %. Хранение. На складах сырье хранят в сухих, хорошо проветриваемых помещениях. Срок годности 3 года. Использование. Применяют в виде настоя как противовоспалительное и противоаллергическое средство в детской практике при скрофулезе, различных диатезах в виде лечебных ванн. Используют также при простудных заболеваниях как потогонное и мочегонное средства. Входит в состав ряда сборов, в так называемый «Аверин чай», в сбор М.Н. Здренко. Выпускается в виде брикетов. Вопрос 4. Рецепт выписан правильно. НЕО для ГАМК не регламентированы. Срок действия рецепта - 2 мес. Рецепт отдается больному с указание на обороте количества отпущенного препарата и даты отпуска и не хранится в аптеке. По истечении срока действия рецепт гасится штампом «Рецепт не действителен». Способ применения ЛС обозначается на русском или русском и национальном языках с указанием дозы, частоты, времени приема и его длительности, а для ЛС, взаимодействующих с пищей, времени их употребления относительно приема пищи (до, во время, после еды). Условия хранения в аптеке: Готовые средства укладываются в упаковке этикеткой наружу. На шкафы и полки прикрепляется стеллажная карта, в которой отражены наименование лекарства, серия и срок годности. Такая карта заводится на каждую вновь поступившую серию, что позволяет осуществлять контроль своевременной ее реализации. В отделе должна находиться картотека по срокам годности препаратов. Лекарственные средства с истекшим сроком годности хранятся отдельно и подлежат переконтролю (после получения результатов анализа). Таблетки ГАМК необходимо хранить отдельно от других средств в заводской упаковке в сухом и защищенном от света месте. Лекарственное растительное сырье хранят в сухом, хорошо вентилируемом помещении в хорошо закрытой таре. Резаное сырье должно находиться в тканевых мешках, порошки - в двойных мешках (многослойный бумажный — внутренний, тканевый — наружный), в картонных упаковках. Иногда допускается упаковка из полимерных материалов. Растительное лекарственное сырье периодически контролируют согласно требованиям
Билет № 6,.Вопрос 1. На рисунке представлена формула хинина сульфата. Важнейшим природным источником получения производных хинолина является хинная корка, содержащая 24 алкалоида (2-15%). Получают хинную корку от различных видов хинного дерева (Cinchona), произрастающих в Южной Америке и культивируемых на острове Ява. В 1820 г. французскими учеными Пельтье и Кавенту из хинной корки выделен хинин и другие алкалоиды. Химическая структура хинина выяснена в 1907 г., а полный синтез осуществлен в 1945 г. американскими учеными Вудвордом и Дерингом. Структурной основой большинства алкалоидов, содержащихся в хинной корке, служат две гетероциклические системы: хинолин (конденсированное ядро пиридина и бензола,, хинуклидин (конденсированная система, состоящая из двух пиперидиновых циклов):  хинолин хинуклидин В молекуле хинина эти два цикла связаны между собой Карбинольной группой -СН(ОН) Общая формула алкалоидов хинной корки: 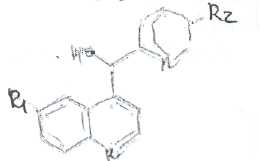 Фармакологическая активность алкалоидов хинной корки находится в зависимости как от химической структуры, так и от оптической изомерии. Применяемые в медицинской практике алкалоиды хинин и хинидин едины по химическому строению. Оба представляют собой 6'-метоксихинолил-(4')-[5-винилхинуклидил-(2)]-карбинол, но являются оптическими антиподами. Хинин представляет собой двукислотное основание. Это обусловлено наличием в его молекуле двух атомов азота (в хинолиновой и хинуклидиновой системах). Более сильные основные свойства проявляет азот, содержащийся в ядре хинуклидина. Являясь двукислотным основанием, хинин образует два типа солей: основные и нейтральные. Соли, содержащие два эквивалента кислоты, в растворах подвергаются гидролизу и показывают кислую реакцию. Chinine (Quinine) Sulfate —хинина сульфат 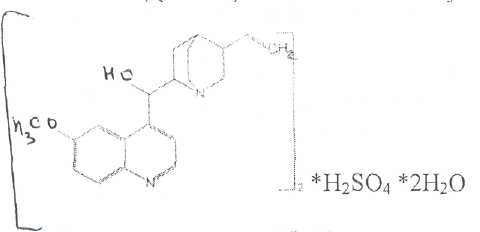 6 -метоксихинолил-(4)-[5-винилхинуклидил-(2)]-кароинола сульфат Бесцветные блестящие шелковистые игольчатые кристаллы или белый мелкокристаллический порошок без запаха. Удельное вращение 3%-ного раствора в 0,1 М растворе хлороводородной кислоты около -240° Хинина сульфат — мало растворим в воде. Для испытания на подлинность используют УФ-спектрофотометрию. Растворы в этаноле хинина сульфата имеют максимумы поглощения при 234. 278 и 331 нм, а в 0,1 М растворе хлороводородной кислоты — при 318 и 347 нм. Используемые для испытаний солей хинина химические реакции основаны на наличии восстановительных, кислотно-основных свойств, третичных атомов азота в молекулах и связанных с основаниями алкалоидов минеральных кислот. Общей реакцией на хинин является так называемая тачейохынная проба. Она заключается в окислении хинина бромной водой до образования бесцветного раствора орто-хинона. Последующее действие раствором аммиака приводит к образованию дииминопроизводных орто-хиноидной структуры, окрашенных в изумрудно-зеленый цвет: 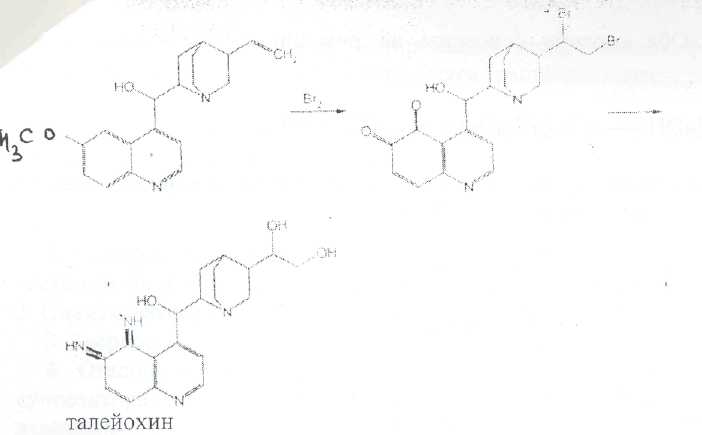 Алкалоиды хинной корки, не содержащие в молекуле метоксильной группы, этой реакции не дают. Характерной особенностью хинина является наличие голубой флуоресценции в растворах серной кислоты. В присутствии окислителей цвет флуоресценции изменяется. Так, например, при действии насыщенным раствором бромной воды образуется желто-зеленая флуоресценция. Флуоресцентные реакции происходят и при воздействии на соли хинина и хинидина другими окислителями (концентрированных серной и азотной кислот, пероксида водорода, периодата калия) в различных растворителях (воде, этаноле, диоксане. диметилформамиде). Для идентификации солей хинина можно использовать осадительные (общеалкалоидные) реактивы на органические основания: пикриновую кислоту, дихлорид ртути, танин, фосфорновольфрамовую кислоту. Подкисленный серной кислотой раствор хинина в этаноле при взаимодействии со спиртовым раствором иода образует характерные (в виде листочков) зеленые кристаллы герепатита: Наличие метоксильной группы в молекуле хинина можно обнаружить сплавлением с перекисью бензоила. Образуется формальдегид, который под действием фуксинсернистой кислоты в присутствии концентрированной серной кислоты приобретает фиолетовое окрашивание. 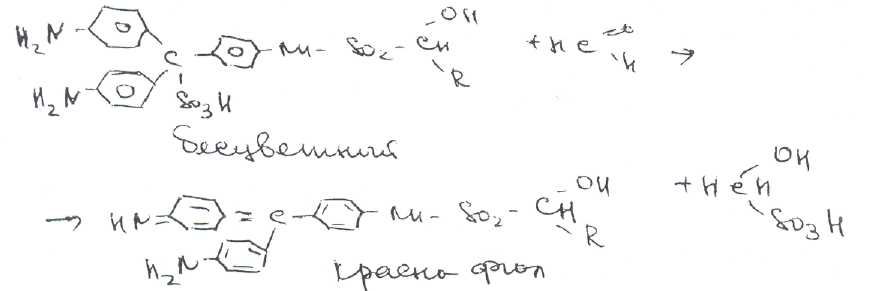 Количественное определение солей хинина выполняют гравиметрическим методом. Он основан на осаждении основания хлнина из солей (раствором гидроксида натрия), четырехкратном извлечении его хлороформом и взвешивании остатка, полученного после отгонки хлороформа. Определить содержание солей хинина можно также методом нейтрализации 0,3 М раствором гидроксида натрия в смеси этанола и хлороформа (индикатор фенолфталеин). Оба способа основаны на реакции нейтрализации солек, например хинина сульфата: МФ рекомендует для определения солей хинина метод неводного титрования в смеси ледяной уксусной кислоты, и уксусного ангидрида (50:20). 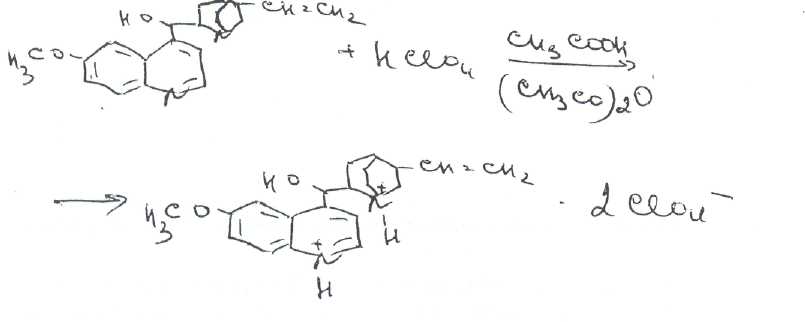 Соли хинина определяют иодометрическим методом, основанным на образовании полииодида в среде насыщенного раствора хлорида натрия 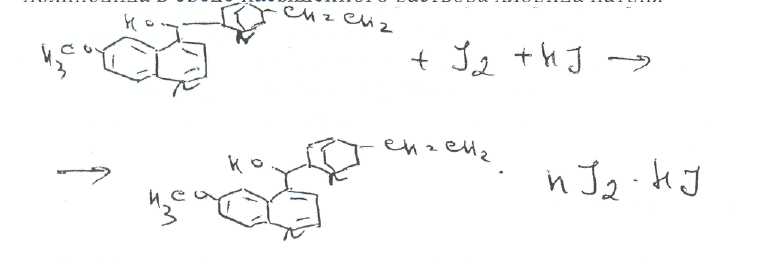 Хинина сульфат — спектрофотометрическим методом (растворитель этанол или 0,1 М раствор хлороводородной кислоты). Выделенное из солей (хлороформом с этанолом 2:1) основание хинина определяют флуориметрическим методом. Для этого растворитель отгоняют, остаток растворяют в 0,1 М херной кислоте л измеряют при 430 нм интенсивность флуоресценции. 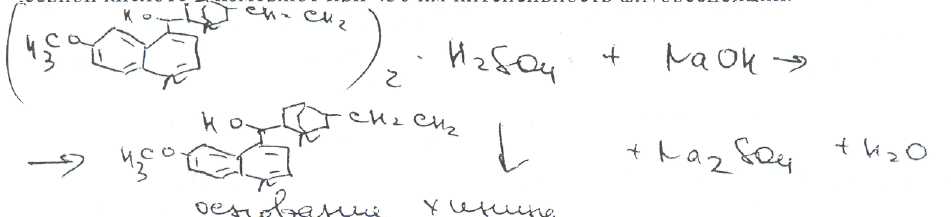 Соли хинина хранят в хорошо укупоренной таре, предохраняющей от действия света, так как под его влиянием хинин постепенно разлагается, приобретая желтое окрашивание. Применяют соли хинина в качестве противомалярийных средств. Назначают хинина сульфат внутрь по 1,0-2,0 г в сутки. Вопрос 2. В соответствии с ГФ XI: Суппозитории (Suppositoria) — твердые при комнатной и расплавляющиеся или растворяющиеся при температуре тела дозированные лекарственные формы, предназначенные для введения в полости тела. Суппозитории — твердая дозированная лекарственная форма, состоящая из основы и лекарственных веществ, расплавляющаяся (растворяющаяся, распадающаяся) при температуре тела. Суппозитории предназначены для ректального (свечи), вагинального (пессарии, шарики) и других путей введения (палочки). ФАРМАКОПЕЙНЫЕ ТРЕБОВАНИЯ К СУППОЗИТОРИЯМ 1. Однородность массы (проверяется на продольном срезе: не должно быть .включений, частиц различной окраски, кристаллических блесток, допустимо наличие воздушного стержня). 2. Одинаковая форма. 3. Твердость, обеспечивающая удобство применения. 4. Отклонение в массе от среднего значения не должно превышать 1=5%. Только два суппозитория могут иметь отклонение не более ±7.5%. Среднюю массу определяют взвешиванием 10 или ;всех суппозиториев. 5. Температура плавления суппозиториев, изготовленных на гидрофобной основе, не должна превышать 37 °С. Если определение температуры плавления затруднено, определяют времяполной деформации, которое не должно превышать 15 мин. 6. Время растворения суппозиториев, изготовленных на гидрофильных основах, не должно превышать 1 час(определяют, в воде). 7. Лекарственные вещества в суппозиториях должны быть точно дозированы. На них распространяется, правило высших разовых и суточных доз для внутреннего применения веществ списка А и Б.; 8. Препараты для введения ректально по микробиологической чистоте Государственной фармакопеей отнесены к, категории ЗА и должны в 1 г или в 1 мл содержать не более 1000 аэробных бактерий и 100 грибов при отсутствии Escherichiacoli Суппозитории - сложная лекарственная форма, состоящая из лекарственных веществ, равномерно распределенных в.основе. Требования к суппозиторным основам можно условно разделить на две группы: требования биофармацевтические и технологические. |
