Билет 1. Вопрос Ингалипт
 Скачать 11.63 Mb. Скачать 11.63 Mb.
|
|
ТРЕБОВАНИЯ GMP К ПРОИЗВОДСТВУ ИНЪЕКЦИОННЫХ ЛЕКАРСТВЕННЫХ ФОРМ КЛАССЫ ЧИСТОТЫ ПРОИЗВОДСТВЕННЫХ ПОМЕЩЕНИЙ GMP (правила надлежащего производства) - это единая система требований по организации производства и контролю качества лекарственных средств от начала переработки сырья до производства готовых продуктов, включая общие требования к помещениям, оборудования и персоналу. В России данную функцию выполняет руководящий нормативный документ РД 64-125-91 "Правила организации производства и контроля качества лекарственных средств", утвержденный приказом Министра медицинской промышленности СССР в 1992 г.Согласно данному документу все помещения для производства лекарств в асептических условиях делятся на 4 класса в зависимости от чистоты воздуха. 1-й класс чистоты достигается установкой в помещении 2-го класса "чистых" камер с подачей ламинарного потока чистого стерильного воздуха. В помещениях 1-го класса выполняются наиболее ответственные технологические операции: выгрузка стерильных флаконов, пробок, колпачков, разлив стерильного раствора, фасовка стерильных порошков, предукупорка и укупорка флаконов пробками, сборка стерилизующих фильтров, отбор проб. 2-й и 3-й классы чистоты обеспечиваются за счет технологических и санитарных мероприятий, стерильной приточной вентиляции, рециркуляционных очистителей воздуха, увеличением кратности воздухообмена, специальной подготовки помещений и персонала. В помещениях 2-го касса чистоты производится изготовление растворов, фильтрование, мойка ампул и флаконов, их сушка и стерилизация. Помещения 3-го класса используются для мойки и стерилизации вспомогательного материала. В помещениях 4-го класса осуществляется мойка дрота, выделка ампул и т.д. Основные требования GMP к производству инъекционных лекарственных форм заключаются в следующем: ♦ в работе участвуют минимальное количество людей: ♦ активность человека должна быть сведена к минимуму, чтобы избежать изменения перемещения частиц и микроорганизмов; ♦ одежда должна соответствовать процессу и рабочему месту и предохранять продукт от загрязнения; ♦ исходный материал не должен быть обсеменен микроорганизмами и пирогенными веществами; ♦ хранение воды, используемой для изготовления инъекционных растворов, осуществляется при постоянной циркуляции и температуре выше 80 °С; ♦ предохранение лекарственной формы перед стерилизацией для предупреждения кантаминации (повторного обсеменения) микроорганизмами; ♦ интервал между изготовлением и стерилизацией должен быть минимальным; ♦ каждый цикл стерилизации контролируется биологическими и химическими способами; ♦ пробы раствора, взятые на анализ для определения стерильности, должны включать пробы в начале и в конце работы, пробы после значительного перерыва в работе и пробы из потенциально наиболее холодной части загрузки автоклава, ♦ на пирогенность контролируется вода, промежуточные и конечные продукты, ♦ помещения должны иметь многоступенчатую систему приточно-вытяжной вентиляции. ♦ между помещениями различных классов чистоты должна поддерживаться разность давления, причем давление в помещениях более высокого класса чистоты должно быть выше; ♦ ответственные операции должны быть защищены установками ламинарного потока стерильного воздуха (движение параллельных потоков стерильного воздуха внутри ограниченного пространства): ♦ санитарно-бытовые помещения должны примыкать к производственным; ♦ вход персонала и передача материала в производственные помещения должны осуществляться через воздухошлюзы: ♦ для облегчения уборки и обработки дез. растворами сопряжения между стенами, полом и потолком должны быть закругленной формы; ♦ между помещениями различных классов чистота должны быть переговорные устройства; ♦ запрещается применение фильтров, выделяющих волокна и др. ТЕХНОЛОГИЧЕСКАЯ СХЕМА ПОЛУЧЕНИЯ РАСТВОРА РИНГЕРА_ЛОККА 1 получение ампул (флаконов) 2 Подготовка сосудов к наполнению 2.1. Мойка наружной поверхности сосудов2.2. Мойка сосудов изнутри 2.3. Контроль качества мойки 2.4. Сушка и стерилизация сосудов 3. Получение и подготовка растворителя 4. Подготовка лекарственных веществ 5 Изготовление раствора 5.1. Растворение лекарственного вещества 5.2. Стандартизация 5.3. Очистка (фильтрование) 6. Заполнение сосудов 7. Укупорка флаконов 8. Стерилизация 8. Оценка качества продукции и брокераж 10. Маркировка и упаковка Методы контроля качества инъекционных растворов Во время технологического процесса производства инъекционных растворов обязательно проводят промежуточный (постадийный) контроль качества, т. е. после каждой технологической стадии или операции проводится бракераж флаконов, гибких контейнеров, не отвечающих определенным требованиям. Так, после растворения лекарственного вещества, контролируется качественный и количественный состав, рН раствора, плотность и др.; после операции наполнения — проверяется выборочно объем наполнения сосудов. Определение норм наполнения. Фактический объем наполнения сосудов должен быть больше номинального. ГФ XI издания устанавливает нормы налива и количества сосудов для контроля. В сосудах вместимостью до 50 мл наполнение проверяют калиброванным шприцем, в сосудах вместимостью 50 мл и более — калиброванным цилиндром при температуре 20±2 °С. Таблица норм наполнения ампул растворами приведена выше. Определение герметичности. Контроль качества укупорки проходят 100% сосудов и для определения герметичности используют 3 метода: — вакуумирование; — с помощью растворов индикаторов (для водных растворов) и воды или мыльного раствора (для масляных растворов); — по свечению газовой среды внутри сосуда под действием высокочастотного электрического поля. Контроль на механические включения. Проводят путем просмотра сосудов на черном и белом фоне при освещении 60 Вт. На черном фоне проверяются прозрачность и наличие механических включений — стеклянная пыль, волокна фильтрующих материалов, нерастворенные частицы лекарственного вещества и т. д.: на белом — цветность раствора, отсутствие механических включений черного цвета и целостность стеклянного изделия. Метод имеет недостатки: субъективизм контролера — острота зрения, опыт работы, усталость и т. д. Допустимая ошибка метода составляет 30%. Для более объективной оценки качества раствора по этому параметру были разработаны другие методы: — визуально-оптические, основанные на использовании проекторов, увеличительных линз, поляризационного света и т. д.; — оптические, с автоматической регистрацией фотоэлементами поглощения или рассеивания проходящего света; — мембранно-микроскопические; — проточные методы.Количественное содержание лекарственных веществ, входящих в состав инъекционных растворов, определяют согласно указаниям ФС или другой нормативно-технической документации. Определение количественного состава проводится на каждой серии раствора. Определение стерильности растворов проводится путем посева и инкубации на специальных тест-средах образцов каждой серии продукции. При обнаружении роста микроорганизмов хотя бы в одной пробирке испытание повторяют на таком же количестве сосудов. И только при отсутствии роста при повторном посеве серия считается стерильной. Определению стерильности подвергают ампулы или флаконы каждой серии, одновременно подвергавшиеся стерилизации в одном стерилизующем аппарате. Метод мембранного фильтрования при определении стерильности рекомендован при выраженном антимикробном действии лекарственного вещества и испытании растворов в больших объемах (более 100 мл). Отбирается 30 ампул, их делят на 3 группы по 10 штук, 20 используют для испытания на стерильность, 10 — для контроля полноты отмывания мембраны от лекарственного вещества. Для фильтрования применяют установку с мембраной диаметром 47 мм и размером пор 0,45±0,02 мкм. Фильтры стерилизуют при температуре 121±1 °С 20 мин. Если испытывают порошок, его растворяют в воде для инъекций, фильтруют через стерильную мембрану, которую промывают от раствора 3—5 порциями растворителя по 100 мл, разрезают стерильными ножницами на 2 части, одну из них помещают в колбу с тиогликолевой средой, вторую — в среду Сабуро, 7 дней инкубируют при ежедневном просмотре. Все операции проводят в асептических условиях. При отсутствии роста на двух средах делают заключение о стерильности серии. Определение пирогенности растворов проводят биологическим методом согласно ГФ XI издания. За рубежом широко применяют лимулус-тест (лим-тест), основанный на образовании геля при взаимодействии бактериальных пирогенов с лизатом амебоцитов крови крабов Liraulus polyphemus. В России разработан аналогичный метод, основанный на способности грамотрицательных микроорганизмов (основные продуценты пирогенных веществ) образовывать гель в 3% растворе калия гидроксида. Методы стерилизации По требованиям Государственной фармакопеи XI издания все готовые лекарственные препараты должны выдерживать тест на микробиологическую чистоту. Поэтому процесс стерилизации имеет большое значение при изготовлении всех лекарственных форм, а особенно инъекционных. Под стерилизацией (обеззараживание, обеспложивание) понимают совокупность физических, химических и механических способов освобождения от вегетативных и покоящихся форм микроорганизмов (Н. Horn, 1984). ГФ XI издания определяет стерилизацию как процесс умерщвления в объекте или удаления из него микроорганизмов всех видов, находящихся на всех стадиях развития. Поскольку к производству стерильных лекарственных форм предъявляют высокие требования по микробиологической чистоте (надежность стерильных инъекционных препаратов должна быть не ниже 10" ), то обеспложиванию подвергаются не только готовый продукт, но и используемое оборудование, вспомогательные материалы, фильтры, растворители, исходные вещества. Выбор того или иного способа стерилизации должен основываться на экономических соображениях и технологичности обработки, включая возможность ее автоматизации. От правильно подобранного метода стерилизации зависит качество производимой стерильной продукции. В технологии лекарственных форм промышленного производства в настоящее время используют 3 группы методов стерилизации: — механические; — химические; — физические. Механические методы стерилизацииСтерилизующая фильтрация. Микробные клетки и споры можно рассматривать как нерастворимые образования с очень малым (1—2 мкм) размером частиц. Подобно другим выключениям, они могут быть отделены от жидкости механическим путем — фильтрованием сквозь мелкопористые фильтры. Этот метод стерилизации включен в ГФ XI для стерилизации терм о лабильных растворов. По механизму действия фильтрующие перегородки, используемые для стерильной фильтрации, подразделяют-на глубинные и поверхностные (мембранные) с размером пор не более 0,3 мкм. Глубинные фильтры характеризуются сложным механизмом задержания микроорганизмов (ситовым, адсорбционным, инерционным). Ввиду большой толщины таких фильтров удерживаются и частицы меньшего размера, чем размер пор фильтрующей перегородки. Глубинные фильтры классифицируют на; керамические и фарфоровые {размер пор 3—4 мкм), стеклянные (около 2 мкм), бумажно-асбестовые (1—1,8 мкм). Недостатками керамических и фарфоровых фильтров является продолжительность стерилизации, потеря раствора в порах толстого фильтра, образование микротрещин из-за хрупкости материала и. следовательно, ненадежность стерилизации. Так, стеклянные и бумажно-асбестовые фильтры несовершенны. Стеклянные фильтры малопроизводительны, бумажно-асбестовые фильтры не рекомендуются для стерилизации инъекционных растворов, поскольку они состоят из волокнистых материалов и имеется угроза отрыва волокон от фильтра. Попадая в организм с раствором, такие волокна могут вызывать различные патологические реакции. В последние годы большое распространение для стерилизующей фильтрации получили микропористые мембранные фильтры. Они лишены недостатков, присущих стеклянным и бумажно-асбестовым фильтрам. Мембранные фильтры представляют собой тонкие (100— 150 мкм) пластины из полимерных материалов, характеризующиеся ситовым механизмом задержания микроорганизмов и постоянным размером пор (около 0.3 мкм). Во избежание быстрого засорения фильтра мембраны используют в сочетании с префильтрами. имеющими более крупные поры. При стерилизации больших объемов растворов оптимальным является применение фильтров обоих типов. Использование глубинных и мембранных фильтров обеспечивает необходимую чистоту, стерильность и апирогенность растворов для инъекций. Стерилизующая фильтрация имеет преимущества по сравнению с методами термической стерилизации. Для многих растворов термолабильных веществ (апоморфина гидрохлорид, викасол, барбитал натрия и другие) его признают единственно доступным методом стерилизации. Метод весьма перспективный в производстве глазных капель. Химические методы стерилизации Методы основаны на высокой специфической (избирательной) чувствительности микроорганизмов к различным химическим веществам, что обусловливается физико-химической структурой их клеточной оболочки и протоплазмы. Механизм антимикробного действия многих таких веществ еще недостаточно изучен. Считают, что некоторые вещества вызывают коагуляцию протоплазмы клетки, другие — действуют как окислители. Ряд веществ влияет на осмотические свойства клетки, многие химические факторы вызывают гибель микробиологической клетки благодаря разрушению ферментной системы. Основа любого варианта химической стерилизации — взаимодействие бактерицидного вещества с компонентами микробной клетки или споры. Химическая стерилизация подразделяется на стерилизацию растворами (веществами) и стерилизацию газами (газовая стерилизация). Стерилизация растворами или веществами. Стерилизацию растворами (веществами) серийно выпускаемой инъекционной продукции в заводских условиях не используют, таккак введение в раствор постороннего биологически активного вещества нежелательно из-за возможных химического взаимодействия стерилизующего агента с действующими компонентами и побочных действий этого агента на организм человека. Еще одно принципиальное ограничение данного метода связано с тем. что практически любое бактерицидное вещество обладает определенной селективностью и его эффективность проявляется при высоких концентрациях или часто в определенных интервалах рН, недопустимых для живых организмов. Этот вид стерилизации используют для обеззараживания различной аппаратуры, трубопроводов и другого оборудования, применяемого в производстве стерильной продукции. Газовая стерилизация. К своеобразной химической стерилизации следует отнести метод стерилизации газами. Преимущество метода — возможность стерилизации объектов в пластмассовой упаковке, проницаемой для газов. В герметическую камеру вводят стерилизант — смесь этиленоксида и углерода диоксида в соотношении 9:1. Углекислый газ добавляют в связи со взрывоопасностью окиси этилена. При стерилизации стерилизант поступает в аппарат под давлением до 2 кгс/см2 (196133 Н/м ) при температуре 43—45 °С. Продолжительность стерилизации зависит от проницаемости упаковки, толщины слоя материала и продолжается от 4 до 20 ч. Затем этиленоксид удаляют продуванием стерильным воздухом (азотом) или путем вакуумирования. При химической стерилизации газами погибают все вегетативные формы микроорганизмов и плесневые грибы. Для стерилизации донорского материала, растворов кровезаменителей или продуктов, полученных из крови, широко применяют б-пропиолактон. Главный недостаток, химических методов стерилизации — необходимость освобождения простерилизованного объекта от остатков стерилизанта и продуктов возможного взаимодействия. Широкое распространение метода затруднительно из-за длительности стерилизации, высокой стоимости, возможности побочного действия химического агента на обслуживающий персонал. Тем не менее для ряда лекарственных препаратов — это единственно надежный способ стерилизации в современных условиях. Использование консервантов. Добавление консервантов условно можно отнести к методам химической стерилизации. Введение консервантов в растворы проводится в тех случаях, когда нельзя гарантировать сохранение стерильности. При этом возможно снижение температуры стерилизации или сокращение времени ее проведения. Механизмы воздействия консервантов на микроорганизмы очень различны и определяются их химическим строением. Как к основному результату при этом следует отнести нарушение жизненных функций клетки, в частности инактивацию белковой части клеточных ферментов. В зависимости от степени инактивации наступает либо гибель клетки: либо замедление ее жизненных функций. Физические методы стерилизации Тепловая (термическая) стерилизация. В настоящее время монопольное положение среди возможных методов стерилизации в фармацевтическом производстве занимает тепловая стерилизация. В зависимости от температурного режима тепловая стерилизация подразделяется на стерилизацию: — паром под давлением (автоклавирование); — текучим паром; — тиндализацию; — воздушную. Стерилизация паром под давлением. Автоклавирование — стерилизация растворов, устойчивых к нагреванию, паром под давлением 1,1 атм при температуре 119—121 °С. Вданных условиях погибают не только вегетативные, но и споровые микроорганизмы зз счет коагуляции белка клетки. Этот традиционный способ стерилизации сегодня предпочтителен по трем причинам. Во-первых, он дает возможность стерилизации препаратов в конечной герметичной упаковке, что исключает опасность вторичной контаминации. Во-вторых, благодаря длительной практике использования он обеспечен достаточно надежной аппаратурой. И в-третьих, на сегодняшний день он наиболее экономичен. При применении данного метода происходит комбинированное воздействие на микроорганизмы высокой температуры и влажности, при этом погибают самые стойкие споры. Коагуляция белковых веществ в этих условиях начинается при температуре 56 °С. Стерилизацию паром под давлением проводят в стерилизаторах различной конструкции цилиндрической или квадратной формы. Стерилизаторы квадратной формы типа АП-7 (рис. 19.25), АП-18 имеют двери с двух сторон: через одну происходит загрузка нестерильной продукции; через другую — выгрузка простерилизованной. Корпус автоклава нагревается глухим паром, чтобы не было его конденсации в рабочей камере. Затем в камеру для вытеснения воздуха подается острый пар. Отсчет времени стерилизации начинается с момента достижения заданного давления по манометру. Стерилизаторы оснащены, автоматической контрольной аппаратурой, с помощью которой на контрольной ленте записывается давление и время стерилизации. Условия стерилизации продукции указаны в промышленных регламентах или другой нормативно-технической документации. 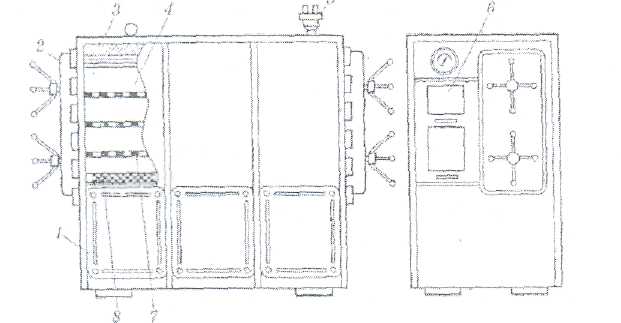 Рис. 21. Устройство парового стерилизатора АП-7: 1 ■— корпус; 2 — крышка; 3 -— теплоизоляция; 4 — стерилизационная камера; 5 — клапан предохранительный; 6 — пульт управления; 7 —- полка; 8 —• подача острого пара Стерилизацию растительных масел и жиров в заводских условиях осуществляют паром под давлением в герметически закрытых сосудах при температуре 119——121 °С и давлении 1.0— 1,1 атм в течение 2 ч. Авто клавир о в анию также подвергаются установки для стерилизующего фильтрования, фильтрующие перегородки и другой вспомогательный материал, используемый в технологическом процессе производства инъекционных лекарственных форм. Среди недостатков метода можно выделить невозможность стерилизации растворов, содержащих термолабильные вещества, опасность работы с паром под давлением, отсыревание многих материалов во время стерилизации и др. Стерилизация текучим паром. Растворы веществ термически малоустойчивые иногда стерилизуют при 100 °С текучим паром (без примеси воздуха и избыточного давления). Насыщенный пар убивает только вегетативные формы микроорганизмов и при наличии в объекте споровых форм метод неэффективен. Тиндализация (дробная стерилизация). Для термолабильных веществ, а также для растворов в шприц-ампулах стерилизацию иногда проводят методом тиндализации. Суть метода заключается в трехкратном нагревании растворов до 40—-60 °С с перерывами в сутки.в течение которых объекты термостатируют при температуре 37±1 °С для прорастания споровых форм в вегетативные. Стерилизация сухим жаром (воздушная стерилизация)- Стерилизация сухим жаром, проводимая в аэростерилах или других аппаратах этого типа, также высокоэффективна. Погибают все формы микроорганизмов за счет пирогенетического разложения белковых веществ. Однако высокая температура нагрева (160— 200 °С), длительное время воздействия (1—2 ч) и сухой горячий воздух оказывают повреждающее действие на стерилизуемые объекты и, следовательно, ограничивают возможности данного Способа. Инъекционные растворы не подвергают стерилизации сухим жаром, так как из-за низкой теплопроводности воздух не обеспечивает быстрый нагрев растворов до температуры стерилизации, а длительный прогрев — приводит к разложению большинство лекарственных веществ. Сухим жаром стерилизуют некоторые термостойкие порошки, масла, стеклянную тару (ампулы, флаконы и необходимую посуду), вспомогательные материалы. Лучшими считают стерилизаторы с ламинарным потоком стерильного воздуха, нагретого до требуемой температуры, что улучшает создание равномерного температурного поля и устраняет загрязнения от обогреваемых стенок камеры и из воздуха, попадаемого в момент выгрузки объекта. Радиационная стерилизация. Лучистая энергия губительно действует на клетки живого организма, в т. ч, и на различные микроорганизмы. Принцип стерилизующего эффекта этих излучений основан на способности вызывать в живых клетках при определенных дозах поглощенной энергии такие изменения, которые неизбежно приводят их к гибели за счет нарушения метаболических процессов и коагуляции белка. Источником ионизирующих у-излучений служат долгоживущие изотопы С027, CS66 , ускорители электронов прямого действия и линейные ускорители электронов. Для бактерицидного эффекта достаточно от 15 до 25 кГр, причем верхний предел необходим для инактивации споровых форм. В настоящее время накоплен большой опыт применения этого метода, точно установлены типичные дозы излучения, необходимые для надежной стерилизации, разработано радиационное оборудование для высокопроизводительного процесса стерилизации, решены вопросы безопасности работы установок для обслуживающего персонала. Этот метод по экономическим показателям превосходит асептическое изготовление растворов со стерильной фильтрацией, но несколько уступает тепловой стерилизации. Однако в будущем может приблизиться к ней из-за неизбежного снижения относительной стоимости изотопов — побочных продуктов атомной энергетики. Ультразвуковая стерилизация. Прохождение ультразвука (УЗ) в жидкой среде сопровождается чередующимися сжатиями, разрежениями и большими переменными ускорениями. В жидкости образуются разрывы, называемые кавитационными полостями. В момент сжатия эти полости захлопываются. Избыточное давление, создаваемое УЗ-волной, накладывается на постоянное гидростатическое и суммарно может составлять в пузырьках несколько атмосфер. В качестве «зародышей» кавитационных полостей могут быть пузырьки газа, пара в жидкости, твердые частицы и места неровностей твердой поверхности. Большие импульсные давления кавитаций приводят к разрушению целостности клеточной мембраны микроорганизмов, споровых образований и других частиц. Важно установить оптимальные параметры процесса стерилизации, так как высокие импульсные давления могут приводить к механическому разрушению ампул. Стерилизующая частота звука должна быть в пределах 3 8—22 кГц. И хотя метод очень эффективен, он не нашел широкого применения из-за сложности аппаратурного оснащения и возможных сложных химических превращений компонентов растворов. Вопросы стабильности компонентов при УЗ-стерилизации имеют много общего с аналогичными проблемами радиационной стерилизации. Для повышения устойчивости лекарств при ультразвуковом воздействии необходимо подобрать такие условиястерилизующей обработки, которые обеспечивают снижение вводимой в систему энергии на тех частотах ультразвука, которые одновременно со стерилизацией не приводят к разложению компонентов лекарственных препаратов. Чаще метод применим при производстве эмульсий и суспензий с целью лучшего диспергирования веществ в них и одновременно получения стерильных гетерогенных систем для парентерального применения. Стерилизация токами высокой и сверхвысокой частоты. К настоящему времени нет единой точки зрения на механизм инактивации микроорганизмов при ВЧ- и СВЧ-облучении. Существует мнение об исключительно тепловом механизме действия токов высокой частоты на биологические объекты. Принцип действия высокочастотного поля заключается в его активном воздействии на ориентацию молекул вещества. Изменение направленности поля вызывает изменение ориентации молекул и поглощение части энергии поля веществом. В результате происходит быстрый нагрев вещества во всех точках его массы. Менее широко распространены представления о том, что, помимо тепловых процессов, на гибель микроорганизмов оказывает влияние специфическое действие ВЧ- и СВЧ-излучения. С помощью СВЧ-энергии возможно стерилизовать в расфасованном виде готовую продукцию: глазные мази, пасты в тубах, лекарственные средства в конвалютах, порошки, таблетки, пористые лиофилизированные массы, не содержащие гидрофильные жидкости. Стерилизация ампулированных растворов и жидких лекарственных форм, укупоренных герметически — нежелательна, так как в замкнутой емкости возникает избыток давления паров испарившейся жидкости, взрывающий ее. В результате наступает разгерметизация в виде растрескивания стенок ампул или срыва укупорочного материала. Метод также не нашел широкого применения из-за сложности аппаратурного оснащения и возможности неблагоприятного воздействия быстрого кратковременного нагрева инъекционного раствора. Стерилизация ультрафиолетовым излучением. Из-за возможности образования ядовитых продуктов и возможности разложения биологически активных компонентов инъекционных растворов под действием УФ-излучения, метод не нашел применения для стерилизации препаратов для инъекций. Однако он широко используется для стерилизации порошков, воды для инъекций, вспомогательных материалов, воздушной среды производственных помещений, технологического оборудования и других объектов. При стерилизации воздушной среды производственных помещений в качестве источников УФ-радиации используют специальные лампы БУВ (бактерицидная увиолевая). которые изготавливают в виде трубки из специального увиолевого стекла, способного пропускать УФ-лучи, с электродами из длинной вольфрамовой спирали, покрытой бария и стронция гидрокарбонатами. В трубке находится ртуть и аргон при давлении в несколько мм рт. ст. Источник УФ-лучей — разряд ртути, происходящий между электродами при подаче на них напряжения. Излучение лампы БУВ обладает большим бактерицидным действием, так как максимум излучения лампы близок к максимуму бактерицидного действия (254 нм). Количество и мощность бактерицидных ламп подбирается так, чтобы при прямом облучении на 1 м объема помещения приходилось не менее 2—2,5 Вт мощности излучателя. Промышленностью выпускаются лампы БУВ-15, БУВ-30, БУВ-60 и др. (цифра обозначает мощность в ваттах), а также бактерицидные облучатели: настенный ОБН, состоящий из двух ламп БУВ-30; потолочный ОБП — из 4 ламп БУВ-30; передвижной маячного типа ОБПЕ -из 6 ламп БУВ-30. Облучатели используют только при отсутствии в помещении людей. Для стерилизации воды применяют аппараты с погруженными и непогруженными источниками УФ-радиации. В аппаратах первого типа источник УФ-излучения (бактерицидная увиолевая лампа, покрытая кожухом из кварцевого стекла) помещается внутри водопровода и обтекается водой. Данный способ стерилизации больших объемов воды для инъекций считается наиболее экономичным. В аппаратах с непогруженными лампами они помещаются над поверхностью облучаемой воды. В связи с тем что обычное стекло практически непроницаемо для ультрафиолетовыхлу^чей, водопровод в местах облучения изготавливают из кварцевого стекла, а это значительно повышает стоимость аппарата. В настоящее время разработан способ, при применении которого имеется возможность замены кварцевого стекла полиэтиленовым, свободно пропускающим УФ-радиацию. Как положительный фактор 'следует отметить, что при стерилизации воды не происходит накопления пероксидных соединений и под действием УФ-излучения инактивируются некоторые пирогенные вещества, попавшие в воду. Стерилизация ИК- и лазерным излучением. Электронная стерилизация. Эти перспективные виды стерилизации практически не находят сегодня применения, хотя возможности для этого имеются. Облучение инъекционных водных систем инфракрасным (ИК) излучением в областях поглощения воды (К—2,1 мкм) может быть эффективным средством ее нагрева и тем самым является, по сути, еще одним вариантом тепловой стерилизации. Наличие достаточно мощных источников ИК-излучения позволяет надеяться на возможность создания оборудования для высокопроизводительной технологии. Преимуществом этого метода перед традиционным автоклавированием может считаться возможность отказа от небезопасного в обслуживании и нетехнологичного перегретого пара. Принципиально возможны способы стерилизации с применением лазерного и электронного излучения, при этом можно достигнуть высокой эффективности стерилизации как путем интенсивного нагрева вследствие поглощения мощного излучения в воде, так и за счет селективного поглощения излучения макромолекулами микроорганизмов в многоквантовых процессах. Однако исчерпывающих исследований применительно к какой-либо конкретной системе, совокупность которых дала бы основание о создании хотя бы основ таких методов стерилизации, пока не проведено. Вопрос 3. пустырник сердечный (п. обыкновенного) — LeonuruscardiacaL и п. пятилопастного (п. мохнатого) — LquinquelobatusGilib. (L. villosusDesf. ex Spreng.) из сем. губоцветных — Lamiaceae(Labiatae); используют в качестве лекарственного средства и лекарственного сырья. |
