Білети з біологічної хімії (пмк 2) Введення в біохімію. Біохімічні компоненти клітин
 Скачать 0.76 Mb. Скачать 0.76 Mb.
|
3. Послідовність компонентів дихального ланцюга мітохондрій. Молекулярні комплекси внутрішніх мембран мітохондрій. Дихальний ланцюг мітохондрій – сукупність молекулярних компонентів (ферментів, коферментів, додаткових електроно-транспортних білків), що здійснюють дегідрування органічних субстратів та послідовний перенос відновлювальних еквівалентів (протонів та електронів) на кисень через ряд проміжних переносників - транспортерів протонів та електронів. Окремі білки та небілкові переносники відновлювальних еквівалентів, які складають дихальний (електроно-транспортний) ланцюг, структурно об'єднані між собою в надмолекулярні мультиензимні комплекси, вбудовані в ліпідний матрикс внутрішніх мітохондріальних мембран, що створює стеричні умови, необхідні для ефективного перебігу окислювально-відновлювальних реакцій. До складу дихального (електроно-транспортного) ланцюга мітохондрій входять чотири білкові комплекси (комплекси І, II, III та IV), що функціонують як переносники протонів та електронів. До складу комплексів входять також залізо-сіркові білки, що містять іони негемового заліза (у вигляді FeS), асоційовані з флавопротеїнами або цитохромом b. Крім білкових комплексів, у функціонуванні електроно-транспортних ланцюгів беруть участь два рухомі переносники - убіхінон (коензим Q) та цитохром с. Комплекси дихального ланцюга:
4. Окисне фосфорилювання: пункти спряження транспорту електронів та фосфорилювання, коефіцієнт окисного фосфорилювання. Окисне фосфорилювання – процес, шляхом якого хімічна енергія, що вивільняється під час транспортування електронів упродовж дихального (електронотранспортного) ланцюга мітохондрій, уловлюється та використовується для синтезу аденозинтрифосфату (АТФ) з аденозиндифосфату (АДФ) та неорганічного фосфату (Фн). Синтез АТФ з АДФ та неорганічного фосфату отримав назву спряження дихання (електронного транспорту в мітохондріях)та окисного фосфорилювання. Синтез однієї молекули АТФ з АДФ та Фн потребує витрат хімічної енергії, що дорівнюють + 7,3 ккал (+ 30,5 кДж). Очевидно, що енергії, яка вивільняється за умов транспорту електронів у дихальному ланцюгу мітохондрій, достатньо для синтезу декількох молекул АТФ. Безпосередніми біохімічними дослідженнями доведено, що за умов окислення субстратів через НАДН: коензим Q-редуктазу утворюється 3 молекули АТФ, при дії сукцинат: коензим Q-редуктази - 2 молекули АТФ. Коефіцієнт окисного фосфорилування — відношення кількості зв'язаного (етерифікованого) неорганічного фосфату (моль) до кількості поглинутого мітохондріями кисню (моль) (позначається як Фн (Рi)/O) - кількісно дорівнює числу молекул АТФ, що утворюються при перенесенні двох відновлювальних еквівалентів на один атом кисню, тобто АТФ/О: 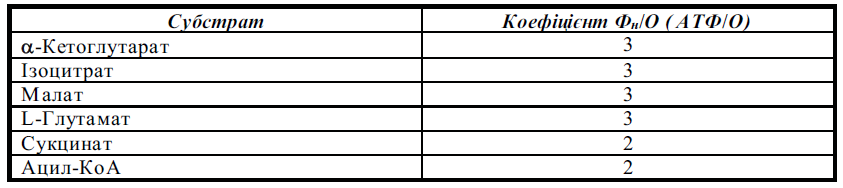 Пункти спряження транспорту електронів та окисного фосфорилування . Утворення АТФ з АДФ та Фн може відбуватися тільки в певних ділянках електронотранспортного ланцюга мітохондрій, в яких величина хімічної енергії, що виділяється при транспортуванні пари електронів між двома редокс-системами (компонентами дихального ланцюга), достатня для синтезу 1 молекули АТФ (тобто > 7,3 ккал, або 30,5 кДж). Ділянки дихального ланцюга мітохондрій, де вивільнення хімічної енергії достатнє для синтезу молекули АТФ: Комплекс І (НАДН → коензим Q) 12,2 ккал 51,0 кДж Комплекс III (цитохром b → цитохром с1) 9,9 ккал 41,4 кДж Комплекс IV (цитохром а3 → О2) 23,8 ккал 99,6 кДж Зазначені ділянки електронотранспортного ланцюга називаються пунктами спряження дихання (електронного транспорту) з окисним фосфоритуванням. 5. Хеміосмотична теорія окисного фосфорилювання, АТФ-синтетаза мітохондрій. 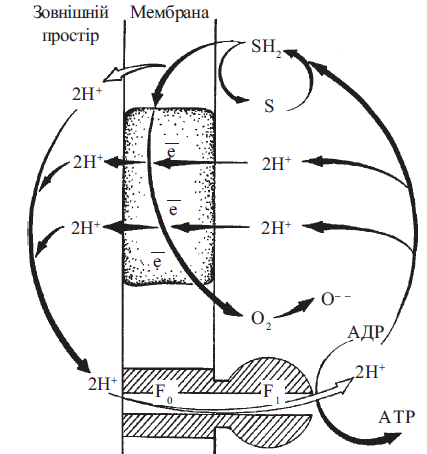 Молекулярні механізми генерації АТФ в ході біологічного оксилення в мітохондріях поснюється хеміоосмотичною теорією, яка передбачає, що:
Таким чином, згідно з хеміосмотичною теорією, спряження між переносом електронів в дихальному ланцюгу та синтезом АТФ здійснюється за рахунок утворення при функціонуванні протонних помп градієнта концентрації Н+ між двома поверхнями мітохондріальної мембрани. АТФ-синтетаза, транспортуючи протони у зворотному напрямку (за електрохімічним градієнтом) призводить до вивільнення хімічної енергії, за рахунок якої утворюються макроергічні зв'язки АТФ. 6.Інгібітори транспорту електронів та роз'єднувачі окисного фосфорилювання. Певні хімічні сполуки здатні специфічним чином порушувати електронний транспорт (інгібітори електронного транспорту) та окисне фосфорилування (інгібітори та роз'єднувачі окисного фосфорилування) в мітохондріях. Дані сполуки взаємодіють з певними компонентами дихального ланцюга або системи окисного фосфорилування, порушуючи їх біохімічні функції. Інгібітори електронного транспорту – сполуки цього класу порушують функціонування дихального ланцюга мітохондрій за рахунок зв'язування з окремими ферментними білками або коферментами, що беруть безпосередню участь у переносі електронів від субстратів біологічного окислення на O2. При надходженні в організм людини або тварин ці речовини діють як клітинні отрути, спричиняючи феномен тканинної гіпоксії. Ротенон - інгібітор транспорту електронів через НАДН:коензим Q-редуктазний комплекс. Ротенон застосовується як інсектицид. Амобарбітал (амітал) та близький до нього за структурою секобарбітал (секонал). Ці похідні барбітурової кислоти (барбітурати) застосовуються у фармакології як снодійні засоби. Разом з тим, барбітурати, подібно до ротенону, є активними інгібіторами клітинного дихання, блокуючи електронний транспорт на рівні НАДН:коензим Q-редуктази. Пієрицидин А – антибіотик, що також блокує НАДН:коензим Q-редуктазний комплекс за рахунок конкурентної взаємодії з убіхіноном. Антиміцин А – антибіотик, що блокує дихальний ланцюг мітохондрій на рівні переносу електронів через комплекс III (цитохром b - цитохром с1). Ціаніди (іони CN-) – потужні клітинні отрути, що є інгібіторами транспорту електронів на термінальній ділянці дихального ланцюга мітохондрій (у цитохромоксидазному комплексі). Іони CN- утворюють комплекси з фери (Fе3+)-формою молекул гему цитохромоксидази, блокуючи їх відновлення до феро (Fе2+)-форм. Монооксид вуглецю (CO) - інгібує цитохромоксидазу шляхом зв'язування з ділянкою гема, що взаємодіє з молекулою кисню. Інгібітори окисного фосфорилування – блокують як окислення субстратів, так і фосфорилування АДФ у мітохондріях. Олігоміцин – антибіотик, що протидіє як фосфорилюванню АДФ до АТФ, так і стимуляції поглинання O2, що спостерігається після додавання до мітохондрій АДФ (феномен "дихального контролю"). Механізм дії олігоміцину полягає в інгібуванні функції АТФ-синтетази. Роз'єднувачі окисного фосфорилування – сполуки цього класу спричиняють "неконтрольоване" дихання мітохондрій, яке не залежить від функціонування системи фосфорилування АДФ. В присутності роз'єднувачів спостерігається активне поглинання мітохондріями О2, незважаючи на зниження швидкості (або відсутність) генерації АТФ з АДФ та Фн. Згідно з хеміосмотичною теорією, роз'єднувачі спричиняють втрату мембраною протонного потенціалу – рушійної сили генерації макроергічних зв'язків АТФ. До них належать: - 2,4-динітрофенол та сполуки, близькі до нього за хімічною структурою (динітрокрезол, пентахлорфенол); -карбонілціанід-м-хлорфенілгідразон - сполука, що в 100 разів перевищує за специфічною активністю 2,4-динітрофенол. Здатність роз'єднувати дихання та окисне фосфорилування в мітохондріях мають також гормони щитовидної залози (тироксин, трийодтиронін). Порушення синтезу АТФ спостерігається в умовах дії на організм людини і тварин багатьох патогенних факторів хімічного (природні та синтетичні токсини), біологічного та фізичного (іонізуюча радіація) походження, які спричиняють роз'єднання дихання та окисного фосфорилування за рахунок порушення спроможності створювати і підтримувати протонний потенціал на спрягаючих мембранах мітохондрій. 7. Мікросомальне окислення: цитохром Р-450; молекулярна організація ланцюга переносу електронів. І фаза біотрансформації токсичних р-н йде за рахунок Ė (мікросомальних оксигеназ) ЕПС гепатоцитів з участю Р-450. Методом диференційного центрифугування отримують т.з. мікросомальну фракцію гепатоцитів, де містяться вищеназвані компоненти. Мікросомальні оксигенази каталізують монооксигеназні р-ції – включення одного атома кисню в молекулу субстрату: R-H + 1/2O2→ R-OH. Така р-ція вимагає донора електронів НАДФН: НАДФН + R-H + O2→ НАДФ+ + R-OH + Н2О. Оскільки атом кисню включається не тільки до субстрату, а і в молекулу води, то ці ферменти ще називають мікросомальні оксигенази мішаної ф-ції. Р-450 – цитохром, гемопротеїн. Ферментні системи, що каталізують р-ї І фази детоксикації – окислення гідрофобних субстратів, є електронно транспортними ланцюгами: НАДФ→ ФАД-вмісний фавопротеїн→ цитохром b3→ Р-450. У різних біологічних об`єктах та тканинах виявлено більше 300 ізоформ Р-450, що відрізняються за субстратною специфічністю і первинною структурою. Ф-ція Р-450 – захист від низькомолекулярних токсинів. Залежно від хімічної природи субстрату та умов процесу виділяють такі типи р-цій мікросомального окислення за участю Р-450: 1) окислювальне гідроксилювання аліфатичних сполук: R-СH3→ R-СH2ОН; 2) окислювальне гідроксилювання циклічних сполук за типом гідроксилювання бензолу: бензол (–СН=)→ фенол (–СОН=); 3) окислювальне дезалкілування, наприклад: а) N-дезалкілування: R-NH-CH3→ R-NH-CH2OH→ R-NH2 + HCHO (формальдегід); б) О-дезалкілування: R-O-CH3→ R-O-CH2OH→ R-OH + HCHO; 4) р-ї відновлення (протікають без участі О2): ССІ4(тетрахлорметан)→ СНСІ3 (хлороформ), проміжними метаболітами таких р-цій можуть бути вільні радикали, що спричиняють перекисне окислення біомолекул і цим призводять до важких некрозо-дистрофічних уражень печінки, нирок, міокарда. Феномен індукції Р-450 полягає в тому, що при надходженні в організм низькомолекулярних гідрофобних сполук активуються окремі гени, що відповідають за синтез певних лізоформ цитохрому→ ↑детоксикуючої здатності печінки. Метаболізм вуглеводів та його регуляція 1. Аеробне та анаеробне окислення глюкози , загальна характеристика процесів. 2. Анаеробне окислення глюкози. Послідовність реакцій та ферменти гліколізу. Ферментативні р-ції гліколізу:
3. Аеробне окислення глюкози. Етапи перетворення глюкози до CO2 , H2O. Аеробне окислення глюкози (С6Н12О6+ 6О2→ 6СО2+ 6Н2О) включає такі етапи:
4. Окислювальне декарбоксилювання пірувату. Ферменти, коферменти та послідовність реакцій в мультиферментному комплексі. Мультиферментний комплекс мічтиться у еукаріотів у мембрані мітохондрій, а у прокаріотів – у цитозолі. Для протікання р-цій необхідні такі Ė: Ė1 – піруватдегідрогеназа, Ė2 – дегідроліпоїлацетилтрансфераза, Ė3 – дигідроліпоїлдегідрогеназа; і проферменти: ТДФ, НАД, ФАД, НS-КоА, амід ліпоєвої к-ти.
|
