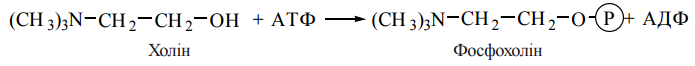|
|
Білети з біологічної хімії (пмк 2) Введення в біохімію. Біохімічні компоненти клітин
16. Пентозофосфатний шлях окислення глюкози: схема процесу та біологічне значення.
Пентозофосфатний шлях — метаболічний шлях перетворення глюкози, потрібний для отримання відновних еквівалентів НАДФH, що використовуються у процесах біосинтезу багатьох речовин, зокрема жирних кислот та холестерину, та рибозо-5-фосфату, який є важливим попередником в утворенні нуклеотидів. Відбувається у цитоплазмі клітин прокаріот, грибів, рослин та тварин. ПФШ відбувається у цитозолі клітин, він має кілька біологічних функцій. Однією з них є продукування рибозо-5-фосфату, що використовується для синтезу нукелотидів, які входять до складу РНК та ДНК, а також коферментів, таких як АТФ, НАД, ФАД,кофермент А. Через це ПФШ активно функціонує у клітинах, що швидко діляться: кісткового мозку, шкіри, слизової оболонки кишківника.
Загальна реакція пентозофосфатного шляху має такий вигляд:
3 Глюкозо-6-фосфат + 6 НАДФ+ + 3 Н2О →
6 НАДФH(H+) + 3 CO2 + 2 фруктозо-6-фосфат + гліцеральдегідфосфат
Пентозофосфатний шлях розділяють на дві стадії:
1)Оксинювальна, в ході якої глюкозо-6-фосфат дегідрогенізується та декарбоксилюється з утворенням НАДФH та рибулозо-5-фосфату, що ізомеризується до рибозо-5-фосфату;
2)Неокиснювальна, в реакціях якої рибулозо-5-фосфат перетворюється до проміжних продуктів гліколізу.
17. Метаболічні шляхи перетворення фруктози та галактози; спадкові ензимопатії їх обміну.
Фруктоза, що потрапляє в організм людини із фруктами та внаслідок розщеплення сахарози в більшості тканин, крім печінки, наприклад у м'язах та нирках, фосфорилюється гексокіназою до фруктозо-6-фосфату із використанням однієї молекули АТФ. У печінці вона має інший шлях перетворення: спочатку фруктокіназа переносить фосфатну групу на C-1 фруктози, утворений фруктозо-1-фосфат розщеплюється фруктозо-1-фосфатальдолазою до гліцеральдегіду та дигідроксиацетонфосфату. Обидві тріози перетворюються у гліцеральдгед-3-фосфат: перший — під впливом тріозокіназа, другий — під впливом гліколітичного ферменту тріозофосфатізомераза.
Роль:є енергетичним джерелом для руху сперматозоїдів,міститься у кришталику ока.
Спадкові ензимопатії: непереносимість фруктози,фруктоземія
Галактоза утворюється в організмі внаслідок розщеплення молочного цукру. Вона поступає у печінку і там перетворюється на глюкозо-6-фосфат за чотири кроки: спочатку галактокіназа каталізує фосфорилювання у першому положенні, на утворений галактозо-
1-фосфат переноситься уридильна група із УДФ-глюкози за участю ферменту галактозо-1-фосфатуридилтрансферази. Продуктами другої реакції є глюкозо-1-фосфат та УДФ-галактоза. Глюкозо-1-фосфат під впливом фосфоглюкомутази перетворюється у глюкозо-6-фосфат і поступає в гліколіз, а УДФ-галактоза використовується для регенерації УДФ-глюкози, що каталізується УДФ-галактоза-4-епімеразою. Дефект будь-якого із ферментів метаболічного шляху перетворення галактози у глюкозу викликає захворювання галактоземію. Галактоземія проявляється в дитячому віці і виявляється нездатністю перетворювати галактозу в глюкозу,що проявляється розумовою відсталістю,збільшенням печінки,помутнінням кришталика.
Метаболізм ліпідів та його регуляція
1. Катаболізм триацилгліцеролів в адипоцитах жирової тканини: послідовність реакцій, механізми регуляції активності тригліцеридліпази.
Триацилгліцероли(нейтральні жири, жири) потрапляють до організму людини як компоненти тваринної і рослинної їжі. Ліпіди цього класу розщеплюються в травному каналі до моно гліцеридів, вільних жирних кислот та гліцерилу. Основне місце локалізації резервних тригліцеридів в організмі людини – адипоцити жирової тканини(ліпоцити).
Ферментативний гідроліз (ліполіз) триацилгпіцеролів в адипоцитах та інших клітинах, де накопичуються нейтральні жири, є фізіологічним механізмом, що має суттєве значення як резервне джерело енергії, особливо в умовах вичерпання вуглеводних резервів та при стресових ситуаціях. Процес розщеплення триацилгліцеролів із вивільненням жирних кислот, які виходять у кров, отримав назву мобілізації жирних кислот із жирової тканини. Внутрішньоклітинний ліполіз триацилгліцеролів (ТГ) здійснюється в декілька стадій, продуктами яких є діацилгліцероли (дигліцериди — ДГ), моноацилгліцероли (моногліцериди — МГ), іліцерол та вільні жирні кислоти.
Молекулярної основою регуляції активності тригліцеридліпази адипоцитів є її ковалентна модифікація шляхом оберненого фосфорилювання – дефосфорилювання. Фосфорильована форма ТГ-ліпази є каталітично активною, дефосфорильована- неактивною.Фосфорилювання відповідного білка здійснюється за рахунок АТФ при участі ферменту цАМФ-залежної протеїнкінази.
2. Нейрогуморальна регуляція ліполізу за участю адреналіну, норадреналіну, глюкагону та інсуліну.
Адреналін та норадреналін — катехоламіни, що активують ліполіз у жировій тканині за рахунок стимуляції цАМФ-залежного каскадною механізму регуляції активності ТГ-ліпази адипоцитів. Ліполітична дія цих гормонів реалізується за умов фізіологічних (фізичне напруження, зниження температури навколишнього середовища) та психологічних (страх, тривого) стресів, що супроводжуються вивільненням з мозкового шару наднирникових залоз адреналіну, а також стимуляцією симпатичної нервової системи та вивільненням у синапсах нейронів норадреналіну, що взаємодіють із адренергічними рецепторами мембран адипоцитів.
Глюкагон — панкреатичний гормон, що стимулює ліполітичну систему в жировій тканині за механізмом, подібним до дії катехоламінів, тобто за рахунок підвищення в адипоцитах вмісту цАМФ, пов’язаного з активацією аденілатциклази. Дія глюкагону проявляється в умовах зниження концентрації глюкози в крові через зменшення її надходження з кишечника або посиленого використання в тканинах.У цілому за рахунок розглянутих біохімічних механізмів метаболічні ефекти катехоламінів та глюкагону призводять до швидкої стимуляції глікогенолізу в печінці і м’язах та ліполізу в жировій тканині, що забезпечує підвищені енерготичні потреби організму за умов стресу або голодування.
На відміну від зазначених гуморальних факторів, що активують ТГ-ліпазу адипоцитів, спричиняючи мобілізацію НЕЖК із жирової тканини, гормон інсулін гальмує процес ліполізу та вивільнення жирних кислот. Інгібіруюча дія інсуліну відносно ліполізу в адипоцитах реалізується за рахунок двох біохімічних механізмів: а) зменшення концентрації цАМФ, що може бути пов’язаним з активацією фосфодіестерази цАМФ; б) збільшення проникності мембран адипоцитів до піюкози, результатом чого є активація в жировій тканині гліколізу і, відповідно, накопичення гліколітичних метаболітів діоксіацетонфосфату та 3-фосфотліцеринальдегіду. Ці метаболіти, в свою чергу, є попередниками іліцерол-3-фосфату, що необхідний для реетерифікації жирних кислот при біосинтезі триацилпгліцеролів. Таким чином, стимульоване інсуліном підвищене надходження в адилоцити глюкози переключає метаболізм жирних кислот на використання їх здебільшого в синтетичних реакціях і зменшує їх вихід у кров.
3. Реакції окислення жирних кислот (β-окислення); роль карнітину в транспорті жирних кислот в мітохондрії.
Окислення ЖК відбувається в матриксі мітохондрій. Перед цим ЖК активується в цитозолі за участю Ė ацил-КоА-синтетаз (тіокіназ): R-СООН + КоА-SН + АТФ→ R-CO-S-KoA (ацил-КоА) + АМФ + ФФн. Власне β-окислення:
R-CH2-CH2-CH2-CO
S-KoA (ацил-КоА) + ФАД→ R-CH2-CH=CH-CO
S-KoA + ФАДН2, Ė ацил-КоА-дегідрогеназа.
R-CH2-CH=CH-COS-KoA + Н2О→ R-CH2-CH(ОН)-CH2-COS-KoA (3-оксиацил-КоА), Ė еноїл-КоА-гідратаза;
R-CH2-CH(ОН)-CH2-COS-KoA + НАД→ R-CH2-CО-CH2-COS-KoA (3-кетоацил-КоА) + НАДН2, Ė 3-оксиацил-КоА-дегідрогеназа.
R-CH2-CО-CH2-COS-KoA + SH-KoA→ R-CH2-COS-KoA + CH3-COS-KoA (ацетил-КоА), Ė β-кетоацил-КоА-тіолаза.
Внутрішня мембрана мітохондрій не проникна дла ацил-КоА, тому існує спеціальна транспортна система з участю карнітину. На зовнішній поверхні мембрани карні тин з`єднається з ацил-КоА: ацил-S-KoA + карнітин→ ацилкарнітин + HS-KoA, Ė карнітин-ацилтрансфераза І. Спеціальна транслоказа (транспортний білок) переносить ацилкарнітин церез мембрану, а там відбувається зворотна реакція за участі Ė карнітин-ацилтрансфераза ІІ. Вільний карнітин проходить без перешкод через мембрану.
4. Енергетична вартість β-окислення жирних кислот в клітинах.
На активацію ЖК йде 1АТФ. Один цикл β-окислення дає 1ацетил-КоА, (який у ЦТК дає12АТФ), і по одному ФАДН2(2АТФ) і НАДН (3АТФ), які дають АТФ тут же в мітохондріях у результаті окисного фосфорилювання. Тобто один цикл – 12+2+3 АТФ. При окисленні пальмітинової к-ти (С16): (-1)(на активацію)+(12+2+3)*7(циклів)+12(останній ацетил-КоА)= 130АТФ.
5. Окислення гліцеролу: ферментативні реакції, біоенергетика.
Активація гліцерину: гліцерин + АТФ→ гліцерол-3-ф (α-гліцеролфосфат) + АДФ, Ė гліцеролфосфокіназа.
Окислення в мітохондріях: α-гліцеролфосфат + НАД→ гліцеральдегід-3-ф, Ė гліцерофосфатдегідрогеназа.
Подальші реакції – як у гліколізі: г-3-ф→ 1,3-диФГ→ 3-ФГ→ 2-ФГ→ ФЕП→ піруват.
6. Кетонові тіла. Реакція біосинтезу та утилізації кетонових тіл, фізіологічне значення.
АцетоацетатСН3-СО-СН2-СООН;β-гідроксибутиратСН3-НС(ОН)-СН2-СООН;ацетонСН3-СО-СН3. У крові – 10-20 мг/л. Синтез:
У цитозолі: ацетил-КоА + ацетил-КоА→ СН3-СО-СН2-СОS-КоА (ацетоацетил-КоА) + НS-КоА, Ė тіолаза.
У мітохондріях (у печінці – в цитозолі): ацетоацетил-КоА + ацетил-КоА→ НООС-СН2-(НО-)С(-СН3)-СОS-КоА (β-гідрокси-β-метилглутарил-КоА/ β-ГОМК), Ėβ-ГОМК-синтетаза.
β-ГОМК→ ацетоацетат+ ацетил-КоА, Ėβ-ГОМК-ліаза.
β-ГОМКутворюється з ацетоацетату: ацетоацетат + НАДН+Н+→ β-ГОМК + НАД+, Ėβ-гідроксибутиратдегідрогеназа. Ацетон утворюється з ацетоацетату в крові за рахунок не ферментативного декарбоксилування або дії Ėацетоацетатдекарбоксилази.
Утилізації передує активація КТ двома шляхами:
ацетоацетат + сукциніл-КоА→ ацетоацетил-КоА + сукцинат.
ацетоацетат + SН-КоА + АТФ→ ацетоацетил-КоА + АМФ + ФФн.
Далі ацетоацетил-КоА розщеплюється Ė тіолазоюна 2 ацетил-КоА→ ЦТК.
При зменшенні обсягу утилізації ацетил-КоА в ЦТК він іде на синтез кетонових тіл. Такі умови створюються під час голодування та цукрового діабету.
7. Порушення обміну кетонових тіл за умов патології (цукровий діабет,голодування).
У нормі концентрація кетонових тіл у крові та більшості тканин незначна ( в середньому 10-20мг-л).Проте, за умов голодування та цукрового діабету створюються метаболічні умови, за яких кількість кетонових тіл у тканинах різко підвищується за рахунок значної
активації їх синтезу.При цьому значно зростають як концентрація кетонових тіл у крові(кетонемія), так і їх виділення з сечею(кетонурія). Біохімічною основою зростання вмісту кетонових тіл в умовах патології зменшення ступеня утилізації атецил-КоА в
циклі три карбонових кислот внаслідок порушення вуглеводного обміну.
8. Біосинтез вищих жирних кислот: реакції біосинтезу насичених жирних кислот (пальмітату) та регуляція процесу.
Проходить в цитозолі за рахунок мультиферментного комплексу синтетази жирних к-т. 8 СН3-СОS-КоА + 14НАДФН (зі ПФЦ в цитозолі) + 7АТФ→ пальмі тат + 14НАДФ + 7АДФ + 7Фн + 6Н2О + НS-KoA
9. Біосинтез моно- та поліненасичених жирних кислот в організмі людини.
Мононенасичені кислоти — пальмітоолеїнова (CH3–(CH2)5–СН=СН–(CH2)7–СООН) та олеїнова (CH3–(CH2)7–CH=CH–(CH2)7–COOH), містять подвійний зв’язок між 9-м та 10-м атомами вуглецю. Ці жирні кислоти можуть утворюватися в організмі людини за рахунок дегідрування відповідних насичених кислот (пальмітинової С15Н31СООН та
стеаринової C17H35COOH).
Утворення зазначеного подвійного зв’язку здійснюється за участю системи десащраціїжирних кислот (ацил-Ко А - оксигенази), що належить, за механізмом дії, до мікросомальних монооксигеназ (оксигеназ мішаної функції‖), які потребують для свою функціонування НАДФН (або НАДН) та включають цитохром b5 електронтранспортного ланцюга, локалізованого в мембранах ендоплазматичного ретикулума гепатоцитів:
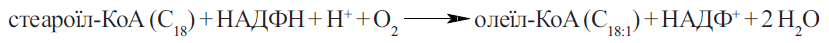
Поліненасичені жирні кислоти — лінолева CH3–(CH2)4–CH=CH–CH2–CH=CH–(СН2)7–СООН та α -ліноленова CH3–CH2–CH=CH–CH2–CH=CH–CH2–CH=CH–(СН2)7–СООН — попередники в утворенні інших, життєво необхідних ацилів, не можуть синтезувалися в клітинах людського організму у зв’язку з відсутністю ферментних систем, що необхідні для утворення додаткових подвійних зв’язків між (трикутник)9-подвійним зв’язком і метильним кінцем жирної кислоти. Зазначені ферменти присутні в багатьох рослинних організмах, і тому існує потреба в постійному надходженні лінолевої та α -ліноленової кислот в організм як компонентів рослинної їжі, що є незамінними
факторами харчування («есенціальні жирні кислоти»).
10. Біосинтез триацилгліцеролів та фосфогліцеридів.
Біосинтез триацилгліцеролів.
1.Утворення активованої форми гліцеролу — гліцерол-3-фосфату (α -гліцерофосфату). Цей процес може відбуватися за одним із двох механізмів:
1.1. Шляхом фосфорилювання гліцеролу за участю ферменту гліцеролфосфокінази:
гліцерол + АТФ → гліцерол-3-фосфат + АДФ
1.2. Шляхом відновлення діоксіацетонфосфату — інтермедіату гліколітичного розщеплення глюкози. Реакція каталізується НАДН-залежною гліцерол-3-фосфатдегідрогеназою (α -гліцерофосфатдегідрогеназою):
діоксіацетонсфосфат+НАДН+Н → гліцерол-3-фосфат+НАД
2.Ацилювання гліцерол-3-фосфату з утворенням фосфатидної кислоти за рахунок двох молекул активованих жирних кислот — ацил-КоА. Процес відбувається в два етапи:
2.1. Перше ацилювання за участю ферменту гліцерол-3-фосфатацилтрансферази з утворенням 1-ацилгліцерол-З-фосфату (лізофосфатидсопу).
2.2. Друга ацилювання за участю ферменту 1-аципгліцерол-З -фосфатацилтрансферази з утворенням 1,2- діацилгліцерол -3-фосфату (фосфатидноої кислоти).
У цьому ацилюванні бере участь залишок ненасиченої жирної кислоти.
3.Гідроліз фосфатидної кислоти до 1,2-діацил-гліцеролу (дигліцериду) за
участю ферменту фосфатидат-фосфогідролази.
4.Ацилювання 1,2-діацилгліцеролу третьою молекулою ацил-КоА (фермент діацилглїцеролацилтрансфераза) з утворенням триацилгліцеролу.
Біосинтез фосфогліцеридів.
Фосфогліцериди (гліцерофосфоліпіди) — фосфатидилхолін, фосфатидилетаноламін, фосфатидилсерин і кардіоліпін належать до структурних ліпідів, що складають ліпідний матрикс біологічних мембран. Це — складні ліпіди, побудовані на основі гліцеролу, тому перші етапи їх біосинтезу є однаковими з розглянутими вище ферментативними реакціями утворення триацилгліцеролів, а саме:
гліцерин → гліцерол-3-фосфат→ фосфатидна кислота
Після утворення фосфатидної кислоти реакції синтезу триацигліцеролів та
фосфогліцеридів дивергують. Розглянемо схему синтезу найбільш поширених мембраннних фосфогліцеридів на прикладі утв фосфатидилхоліну та фосфатидилетаноламіну. У разі біосинтезу зазначених фосфогліцеридів до 1,2-діацилгліцеролу, що утворюється в результаті гідролізу фосфатидної кислоти, приєднується гідрофільна голівка, яка містить аміноспирт (холін або етаноламін). Особливістю процесу є використання в реакції активованих форм аміноспиртів — комплексів холіну (етаноламіну) з нуклеозиддифосфатом з ЦДФ, які утворюються за рахунок таких реакцій:
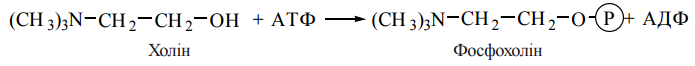
1) активації холіну (етаноламіну) шляхом АТФ-залежного фосфорилювання аміноспирту;
2) взаємодії фосфохоліну (або фосфоетаноламіну) з нуклеозидтрифосфатом ЦТФ з утворенням ЦДФ-холіну (ЦДФ-етаноламіну);
3) взаємодії ЦДФ-холіну (ЦДФ-етаноламіну) з 1,2-діацилгліцеролом з утворенням фосфатидилхоліну (фосфатидилетаноламіну).
11. Метаболізм сфінголіпідів. Генетичні аномалії обміну сфінголіпідів-сфінголіпідози.
Сфінголіпіди — складні ліпіди біологічних мембран, що побудовані на основі
високомолекулярного спирту сфінгозину. Ці ліпіди — сфінгомієліни та гліко-
сфінголіпіди в найбільшій кількості наявні в структурах центральної та перифе-
ричної нервової системи, зокрема в мієлінових оболонках нервів.
Катаболізм здійснюється шляхом послідовною розщеплення їх молекул за участю лізосамальних гідролаз.
1.Сфінгомієліни розщеплюються до цераміду та фосфохоліну за участю сфінгомієлінази: сфінгомієлін→ церамід + фосфохолін
2. Глікосфінголіпіди. Розщеплення глікосфінголіпідів починається із поступовою
відщеплення моносахаридних залишків від олігосахаридною кінця молекул.
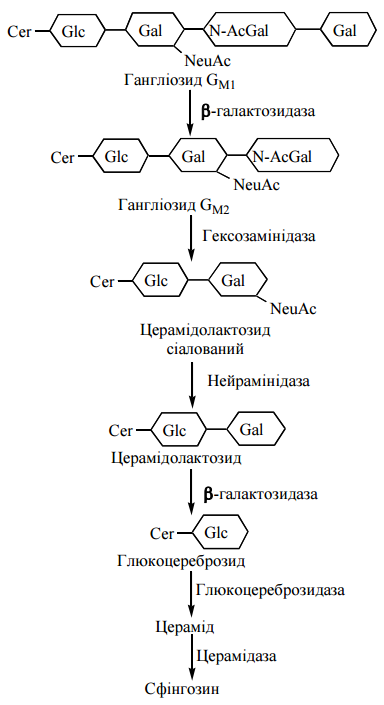
Послідовність етапів катаболізму глікосфінголіпідів
На схемі подані сіаловані гангліозиди (тобто такі, що зв’язані з N-ацетилнейраміновою кислотою — NeuAc).
Сфінголіпідози – спадкові хвороби, пов’язані з аномальним накопиченням в головному мозку та інших тканинах сфінголіпідів та продуктів їх метаболізму, структурним компонентом яких є цераміди. Сфінголіпідози є ензимонатіями з класу ліпідозів, що, подібно до глікозидозів, належать до ―лізосомальних хвороб, спричинених генетичними дефектами в синтезі певних гідролітичних ферментів катаболізму складних біомолекул. Найбільш поширеними є такі сфінголіпідози:
Хвороба Німана-Піка
|
спричинений порушенням синтезу сфінгомієлінази, що супроводжується накопиченням у головному мозку, селезінці та печінці хворих сфінгомієліну
|
Хвороба Тея-Сакса (гангліозидоз GM2)
|
генетична хвороба, спричинена дефектом у синтезі гексозамінідази, що відщеплює термінальний N-ацетилгалактозамін від гангліозиду GM2, який в аномальних кількостях накопичується в головному мозку
|
Гангліозидоз GM1
|
сфінголіпідоз, що спричиняється порушенням синтезу лізосомальної β-галактозидази, яка відщеплює термінальний залишок галактози в гангліозиді GM1 і кератансульфатах із накопиченням у нервовій системі відповідних сполук
|
Хвороба Гоше (глюкоцереброзидний ліпідоз)
|
сфінголіпідоз, генетичний дефект при якому полягає в недостатньому синтезі глюкоцереброзидази — ферменту, що відщеплює залишок глюкози відмолекул глюкоцереброзидів, які накопичуються в ретикулоендотеліальній системі.
|
|
|
|
 Скачать 0.76 Mb.
Скачать 0.76 Mb.