Білети з біологічної хімії (пмк 2) Введення в біохімію. Біохімічні компоненти клітин
 Скачать 0.76 Mb. Скачать 0.76 Mb.
|
|
4. Непереносність дисахаридів. Аглікогеноз (дефіцит глікогенсинтетази) характеризується гіпоглікемією з судомами, блюванням, порушенням розумового розвитку. 5.Мукополісахаридози – спадкові захворювання, обумовлені порушенням обміну речовин, що входять до складу сполучної тканини.
6. Гемолітичні анемії, зумовлені дефіцитом ферментів обміну вуглеводів в еритроцитах. 7. Муковісцидози (дефіцит ферментів обміну глікопротеїнів) – спадкові захворювання, що характеризуються ушкодженням залоз внутрішньої секреції, патологічними змінами органів дихання й травлення, наявністю в’язкого слизу у вивідних протоках екзокринних залоз (переважно підшлункової та бронхіальних). 1. Еритропоетичні порфірїі: а) природжена еритропоетична порфіріл, або хвороба Гюнтера (дефіцит уропорфіриноген ІІІ-косинтази). б) еритропоетична копропорфірія (дефіцит ферменту копропорфіриногеноксидази). в) еритропоетична протопорфірія (дефіцит ферохелатази). г) змішана природжена порфірія (дефіцит ферохелатази й уропорфіриногендекарбоксилази). Ензимопатії при обміні білків 1. Фенілпіровиноградна олігофренія (дефіцит фенілаланін-4-монооксигенази. Відсутність у печінці фенілаланін-4-монооксигенази призводить до розвиту фенілкетонурії. 2. Алкаптонурія (дефіцит гомогентизинат-1,2-діоксигенази). Це спадкове захворювання розвивається внаслідок генетичного дефекту гомогентизинат-1,2-діоксигенази — ферменту катаболізму фенілаланіну. 3. Тирозиноз, тирозинеміяі типу (дефіцит фумарилацетоацетатгідролази), тирозинемія II типу (синдром Ріхнера—Ханхарта) і тирозинемія новонароджених (транзиторна тирозинемія). 4. Альбінізм (дефіцит тирозинази) — молекулярна хвороба. Спадкова відсутність тирозинази призводить до альбінізму. 5. Гіперамоніємія (дефіцит ферментів синтезу сечовини: карбамоїлфосфатсинтази, аргініносукцинатліази, орнітинкарбамоїлтрансферази, аргініносукцинатсинтетази, аргінази). 6. Гіпергістидинемія (дефіцит гістидинази). Це спадкове захворювання виникає внаслідок відсутності гістидинази, що каталізує окисне дезамінування гістидину. 13. Ензимодіагностика патологічних процесів та захворювань. Ензимодіагностика – це дослідження активності ферментів плазми крові, сечі, слини з метою діагностики тих або інших захворювань. Прикладом може служити фермент лактатдегідрогеназа (ЛДГ), визначення його активності в плазмі крові необхідно при захворюваннях серця, печінки, скелетної мускулатури. Збільшення активності α-амілази в плазмі крові та сечі спостерігається при запальних процесах в підшлунковій і слинних залозах. З іншого боку, захворювання тих чи інших органів завжди супроводжуються специфічним "ферментативним профілем". Наприклад, інфаркт міокарда супроводжується збільшенням активності лактатдегідрогенази, креатинкінази, аспартатамінотрансферази. 14. Ензимотерапія – застосування ферментів, їх активаторів та інгібіторів в медицині. Ензимотерапія — використання ферментів як лікарських засобів проводиться переважно в разі нестачі в організмі якогось ферменту, коферменту або як допоміжний засіб при деяких захворюваннях. Найпоширенішими ферментативними препаратами є комплекси ферментів шлунково-кишкового тракту (Фестал, Панзинорм форте, Мезим форте, Ензістал і т.п.), що містять пепсин, трипсин, амілазу і т.п., і використовувані для замісної терапії при порушеннях травлення речовин в шлунково-кишковому тракті. Тканинної фермент гіалуронідаза потрібна організму для оборотного зміни проникності міжклітинної речовини, в основі якого знаходиться гіалуронова кислота. Лікарську форму гіалуронідази - лідазу - вводять для розм'якшення рубців, появи рухливості в суглобах, розсмоктування гематом. Цитохром с - білок, який бере участь у процесах тканинного дихання. Його застосовують при асфіксії новонароджених, астматичних станах, серцевої недостатності, різних видах гепатиту і т.п. Рибонуклеаза і дезоксирибонуклеаза входять до складу очних крапель для лікування вірусних кон'юнктивітів. При нанесенні на рану вони розріджують гній, при інгаляціях зменшують в'язкість слизу, деполімерізуя нуклеїнові кислоти в мокроті. Трипсин інгалюють при бронхо-легеневих захворюваннях для розрідження густого і в'язкого мокротиння. Фіцин використовується у фармацевтичній промисловості в якості добавки до зубних паст для видалення зубного нальоту. Колагеназу застосовують для прискорення відторгнення некротизованих тканин, для очищення трофічних виразок. 15. Принципи та методи виявлення ферментів у біооб’єктах.Одиниці виміру активності та кількості ферментів. Оскільки кількість ферменту в біологічному об'єкті у більшості випадків визначити неможливо, для характеристики швидкості біохімічної реакції, що каталізується певним ферментом, за умов сталості інших показників середовища (фізико-хімічних параметрів, концентрації активаторів та інгібіторів) користуються значеннями активності ферменту. Активність ферменту - це умовна величина, що прямо пропорційна швидкості біохімічної реакції, яку каталізує певний фермент. У свою чергу, як легко зрозуміти, швидкість ферментативної реакції можна визначити або за кількістю субстрату (S), що перетворився за певний проміжок часу, або за кількістю накопиченого за цей час продукту реакції (Р). У біохімічній практиці для кількісної характеристики реакцій, що каталізуються ферментами, використовують умовні величини - одиниці ферменту. Загальновживаними є такі одиниці ферменту: 1. За одиницю ферменту U (unit, англ.), що рекомендована Міжнародним біохімічним союзом (МБС), приймають таку його кількість, яка каталізує перетворення 1 мкмоль субстрату за 1 хвилину: 2. При використанні одиниць системи СІ (SI) активність ферменту виражають у каталах (кат). 1 Катал (кат) - така кількість ферменту, яка каталізує перетворення 1 моля субстрату за 1 с: 3. Розповсюдженою одиницею є питома активність ферменту, яка визначається кількістю одиниць ферментної активності, що припадають на 1 мг білка в біологічному об'єкті (U/мг білка). У медичній ензимології активність ферменту часто виражають в одиницях (U) на 1 л досліджуваної біологічної рідини - сироватки крові, слини, сечі тощо (U/л). Основні закономірності обміну речовин. Цикл трикарбонових кислот 1. Обмін речовин (метаболізм) – загальні закономірності протікання катоболічних та анаболічних процесів. Метаболізм, що є найбільш характерною ознакою та неодмінною умовою існування будь-якої біологічної системи, поділяється на анаболізм (асиміляцію, синтез) та катаболізм (дисиміляцію, розщеплення молекул). Процеси катаболізму являють собою сукупність реакцій розщеплення хімічних сполук, що надходять в організм у вигляді продуктів харчування та містять чужорідні вуглеводи, ліпіди, білки тощо. Крім того, в будь-якій клітині постійно відбувається розщеплення власних біомолекул. Катаболізм є екзергонічним процесом, тобто таким, що призводить до вивільнення хімічної енергії, яка частково використовується організмом в ході анаболізму. Ця хімічна енергія звільняється в результаті реакцій окислення біомолекул - проміжних продуктів внутрішньоклітинного розщеплення моносахаридів: переважно глюкози, жирних кислот, гліцерину та деяких амінокислот. Основні реакції біологічного окислення, що вивільняють енергію, необхідну для процесів життєдіяльності, відбуваються в мітохондріях (саркосомах), у мембранах яких локалізовані також складні ферментні та йонтранспортуючі системи, які реалізують накопичення енергії окислювальних процесів у вигляді високоенергетичних (макроергічних) зв'язків АТФ. Анаболізм являє собою постійний синтез молекул та побудову структур власного організму з органічних сполук, що надходять з навколишнього середовища у вигляді продуктів харчування та продуктів їх перетворення (інтермедіатів). Процеси анаболізму є ендергонічними, тобто такими, що потребують витрат хімічної енергії, яка постачається за рахунок реакцій катаболізму, переважно у формі молекул АТФ. Таким чином, живі організми за термодинамічними закономірностями їх функціонування є не тепловими машинами, а хімічними машинами, тобто системами, в яких різні види роботи здійснюються за рахунок хімічної енергії молекул, до того ж при сталій температурі (у людини близько 37 °С). При цьому джерелом хімічної енергії для ендергонічних процесів синтезу та побудови нових клітинних структур є екзергонічні реакції біологічного окислення, що відбуваються в електротранспортних ланцюгах мітохондрій та акумулюють цю енергію в ході окисного фосфорилування. 2. Спільні стадії внутрішньоклітинного катаболзму біомолекул: білків, вуглеводів, ліпідів. У катаболізмі розрізняють три стадії: 1) Полімери перетворюються на мономери (білки - в амінокислоти, вуглеводи в моносахариди, ліпіди – в гліцерин і жирні кислоти). Хімічна енергія при цьому розсіюється у вигляді тепла. 2) Мономери перетворюються на загальні продукти, в переважній більшості в ацетил-КоА. Хімічна енергія частково розсіюється у вигляді тепла, частково накопичується у вигляді відновлених коферментних форм (НАДН, ФАДН2), частково запасається в макроергічних зв'язках АТФ (субстратне фосфорилювання). Перша і друга стадії катаболізму відносяться до специфічних шляхів, які унікальні для метаболізму білків, ліпідів і вуглеводів. 3) Заключний етап катаболізму, зводиться до окислення ацетил-КоА до СО2 і Н2О в реакціях циклу трикарбонових кислот (циклу Кребса) - спільний шлях катаболізму. Виділені атоми водню з'єднуються з НАД і ФАД і відновлюють їх. Після цього НАДН і ФАДН2 переносять водень в ланцюг дихальних ферментів, розташований на внутрішній мембрані мітохондрій. Окислювальні реакції загального шляху катаболізму пов'язані з ланцюгом тканинного дихання. При цьому енергія (40-45%) запасається у вигляді АТФ (окисне фосфорилювання). В результаті специфічних та загальних шляхів катаболізму біополімери (білки, вуглеводи, ліпіди) розпадаються до СО2, Н2О і NH3, які є основними кінцевими продуктами катаболізму. 3. Цикл трикарбонових кислот. Локалізація, послідовність ферментативних реакцій, значення в обміні речовин. Цикл трикарбонових кислот (ЦТК) – загальний кінцевий шлях окислювального катаболізму клітини в аеробних умовах. Реакції і ферменти ЦТК локалізовані в матриксі та внутрішній мембрані мітохондрій. Вони функціонально та біохімічно спряжені з мітохондріальними електроно- транспортними ланцюгами, що використовують для відновлення атомів кисню відновлювальні еквіваленти від НАДН (НАДН2) та ФАДН2 або ФМНН2, і утворюють АТФ у ході окисного фосфоритування. Цикл починається з взаємодії молекули ацетил-КоА з чотири вуглеводневою дикарбоновою кислотою щавелевооцтовою (оксалоацетата), в результаті утворюється шести вуглеводнева три карбонова кислота - лимонна. Далі йде серія реакцій, в ході яких відбувається вивільнення двох молекул СО2 і регенерація оксалоацетата. Оскільки кількість оксалоацетата, необхідне для перетворення великого числа ацетильних одиниць в СО2 досить невелика, можна вважати, що оксалоацетат виконує каталітичну роль. Цикл лимонної кислоти є механізмом, що забезпечує вловлювання більшої частини вільної енергії, що звільняється в процесі окислення вуглеводів, ліпідів і білків. В процесі окислення ацетил-КоА завдяки активності ряду специфічних дегідрогеназ відбувається утворення відновних еквівалентів у формі водню або електронів. Останні надходять в дихальний ланцюг; при функціонуванні цього ланцюга відбувається окисне фосфорилювання, тобто синтезується АТФ. 4. Енергетичний баланс циклу трикарбонових кислот. Фізіологічне значення реакцій ЦТК. Біохімічний підсумок циклу трикарбонових кислот полягає в утворенні двох молекул СО2 (в ізоцитратдегідрогеназній та α-кетоглутаратдегідрогеназній реакціях) та чотирьох пар атомів водню, три з яких акцептуються НАД+ та одна — ФАД. Відновлені коферменти окислюються в дихальному ланцюзі мітохондрій, утворюючи за рахунок окисного фосфорилювання по 3 молекули АТФ на кожну молекулу НАДН і по 2 молекули АТФ на кожну молекулу ФАДН2. Крім того, одна молекула АТФ утворюється в субстратному фосфорилюванні при перетворенні сукциніл-КоА в сукцинат. Сумарний баланс молекул АТФ, що утворюються при функціонуванні цитратного циклу 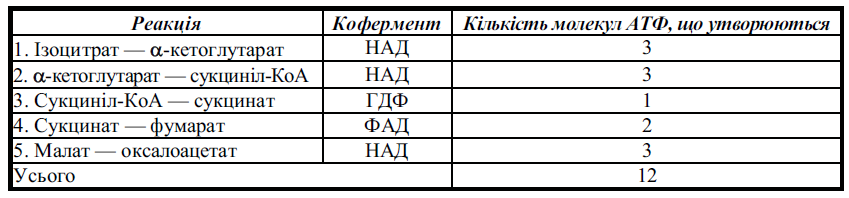 Отже, при повному окисленні однієї молекули ацетил-КоА до СО2 та Н2О в циклі трикарбонових кислот генерується 12 молекул АТФ. 5. Субстратне фосфорилювання ЦТК. Субстратне фосфорилювання – процес синтезу АТФ, який відбувається як результат окиснення субстратів без участі дихального ланцюга мітохондрій. У цьому разі перетворення субстрату в продукт супроводжується фосфорилюванням АДФ з утворенням АТФ. В організмі є три реакції субстратного фосфорилювання (дві – в гліколізі, одна – в ЦТК). Тобто субстратне фосфорилювання у ЦТК Кребса відбувається на рівні перетворення сукциніл КоА в сукцинат. Отже, кожна з реакцій субстратного фосфорилювання супроводжується утворенням лише одної молекули АТФ. Цей процес можливий як в аеробних, так і анаеробних умовах і відбувається в цитоплазмі і матриксі мітохондрій. Молекулярні основи біоенергетики 1. Реакції біологічного окислення; типи реакцій (дегідрогеназні, оксидазні, оксигеназні) та їх біологічне значення. Тканинне дирхання. Р-ції біологічного окислення складають молекулярну основу тканинного дихання - поглинання О2 живими тканинами. Джерелом кисню для цього процесу ж О2, який надходить в тканини за умов нормальної діяльності системи зовнішнього дихання та кисень транспортувальної ф-ції гемоглобіну крові та через плазматичні мембрани дифундує всередину клітин. У результаті тканинного дихання, яке відбувається мітохондріях, атоми кисню включаються в молекулу води, а вуглець біоорганічних сполук, що окислюються, виділяється у формі двоокису вуглецю. Усі окислювально-відновні р-ції, що відбуваються в живих клітинах, каталізуються ферментами з класу оксидоредуктаз. Типи реакцій: 1)Р-ції, повязані з передаванням субстратом, що окислюється (SH2), певному акцептору (А), водню (тобто протонів та електорнів: SH2 +А S+АН2 Р-ції такого типу називаються реакціями дегідрування, а ферменти, що їх каналізують – дегідрогеназами. 2)Р-ції, що відбуваються з передаванням від субстрату до акцептора електронів (одного або двох): Sе- +АS + Ае- Р-ції такого типу каталізуються цитохромами дихального ланцюга мітохондрій. 3)Р-ції, що полягають у безпосередньому приєднанні до субстрату, який окислюється, одного або двох атомів кисню. Такі р-ції дістали назву оксигеназних, а відповідні ферменти, що їх каналізують – оксигеназ. Залежно від к-сті атомів кисню, що взаємодіють із субстратом, оксигеназні р-ції подіялють на: -монооксигеназні SH+ ½ О2S-OH -діоксигеназні S+O2SO2 2. Ферменти біологічного окислення в мітохондріях: піридин-, флавін-залежні дегідрогенази, цитохроми. Ферменти біологічного окислення в мітохондріях: 1)Піридинзалежні дегідрогенази – коферментами цих дегідрогеназ є нуклеотидли НАД+ або НАДФ+, у структурі молекул яких міститься похідне піридину – нікотинамід. Зв*язок між НАД+ (або НАДФ+) та білковою частиною ферменту (апоферментом) у складі піридин залежних дегідрогеназ нестійкий: він утворюється та руйнується в процесі каталітичного циклу, що дозволяє вважати нікотинамідні нуклеотиди скоріше субстратами, ніж простетичними групами. Р-ції, що каталізуються НАД(Ф)-залежними дегідрогеназами: SH2 +НАД+S+НАДН+Н+ SH2+ НАДФ+S+ НАДФН+Н+ Активною структурою в молекулі НАД+ або НАДФ+ є піридинове кільце нікотинаміду. У ході ферментативної реакції субстрат відщеплює 2 атоми водню (2Н++ 2е-), один з яких у формі гідрид-іону: Н-(тобто Н++2е-) приєднується до піридинового кільця НАД(Ф)+, а другий у вигляді протону (іону Н+) надходить у реакційне середовище. 2)Цитохроми – залізовмісні білки мітохондрій, що належать до класу гемо протеїнів. У цитохромах іон заліза входить до складу металопорфіринового комплексу (гемінове залізо). За рахунок оберненої зміни валентності гемінового заліза цитохроми виконують функцію транспорту електронів у ланцюгах біологічного окислення в аеробних клітинах: Цитохром (Fe3+) + е- Цитохром (Fe2+) Залежно від характерних особливостей спектрів поглинання, розрізняють три класи цитохромів (a,b,c). В ендоплазматичному ретикулумі гепатоцитів містяться цитохром Р-450 та b5, що беруть участь у р-ціях окислювального гідроксилювання. 3)Флавінзалежні дегідрогенази – дегідрогенази цього типу за хімічною природою є флавопротеїнами, простетичними групами, в яких є флавінаденіндинуклеотид (ФАД) та флавінмононуклеотид (ФМН). У більшості флавін залежних ферментів коферменти (ФАД та ФМН) міцно зв*язані з білковою частиною і не відщеплюються від неї на жодній стадії каталітичного циклу. Виключенням є ФАД-залежна оксидаза D-амінокислот, у складі якої білок має низьку спорідненість із коферментом. Загальні рівняння окислення субстратів за участю флавін залежних дегідрогеназ: SH2 +ФАДS+ ФАДН2 SH2+ФМН S+ФМН-Н2 |
