Білети з біологічної хімії (пмк 2) Введення в біохімію. Біохімічні компоненти клітин
 Скачать 0.76 Mb. Скачать 0.76 Mb.
|
|
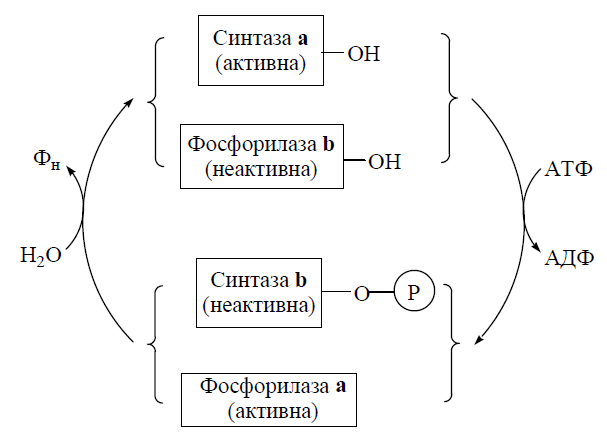
5. Гліколітична оксидоредукція: субстратне фосфорилювання та човникові механізми окислення гліколітичного НАДН. Суть процесу полягає в тому, що НАДН, який утворюється в цитозолі не може самостійно прникнути в мітохондрії для окислення, тому він відновлює у цтиозолі певну речовину, яка йде в мітохондрії і там окислюється (замість НАДН), відновлюючи внутрішньомітохондріальний НАД+, і знову повертається в цитозоль; цикл повторюється. Малат-аспартатна човникова система. У цитозолі відновлюється оксалоацетат до малату. Малат іде в мітохондрії і там окислюється знову до оксалоацетату, відновлюючи НАД+. Гліцерофосфат на човникова система. У цитозолі відновлюється діоксиацетонфосфат до гіцерол-3-ф, який іде в мітохондрії і там окислюється до діоксиацетонфосфату. Суть процесу полягає в тому, що НАДН, який утворюється в цитозолі не може самостійно прникнути в мітохондрії для окислення, тому він відновлює у цтиозолі певну речовину, яка йде в мітохондрії і там окислюється (замість НАДН), відновлюючи внутрішньомітохондріальний НАД+, і знову повертається в цитозоль; цикл повторюється. Малат-аспартатна човникова система. У цитозолі відновлюється оксалоацетат до малату. Малат іде в мітохондрії і там окислюється знову до оксалоацетату, відновлюючи НАД+. Гліцерофосфат на човникова система. У цитозолі відновлюється діоксиацетонфосфат до гіцерол-3-ф, який іде в мітохондрії і там окислюється до діоксиацетонфосфату. 6. Порівняльна характеристика біоенергетики аеробного та анаеробного окислення глюкози, ефект Пастера. У процесі анаеробного окислення глюкози витрачається 2 молекули АТФ (при фосфорилюванні глюкози з утворенням глюкозо-6-фосфату і при перетворенні фруктозо-6-фосфату на фруктозо-1,6-дифосфат), а синтезується 4 АТФ (по дві у реакціях гліцеральдегід-3-фосфат → 3-фосфогліцерат та фосфоенолпіруват → піруват). Різниця у затраченій і утвореній кількості АТФ складає +2 молекули. Сумарне рівняння: С6Н12О6 + 2АДФ + 2Фн→ 2С3Н4О3(С3Н6О3) + 2АТФ. При аеробному окисленні глюкози (повне окислення до СО2 і Н2О): генерується 2АТФ на етапі аеробного гліколізу; гліколітичний НАДН за рахунок окислення в мітохондріях дає 2НАДН*3АТФ=6АТФ; окисне декарбоксилювання ПВК дає 2НАДН, які в мітохондріях окислються з утворенням 2НАДН*3АТФ= 6АТФ; в ЦТК 2 ацетил-КоА (із попереднього декарбоксилування ПВК) дають 2ац-КоА*12АТФ=24АТФ. Сумарне рівняння: С6Н12О6 + 6О2 + 38АДФ + 38Фн→ 6СО2 + 6Н2О + 38АТФ. Ефект Пастера – не утворення лактату в присутності О2, через те, що в умовах активного клітинного дихання пригнічується активність фосфофруктокінази і піруваткінази. 7. Фосфоролітичний шлях розщеплення глікогену в печінці та мязах. Регуляція активності глікогенфосфорилази.  У мязах.адреналін-стимулює глікогеноліз шляхом:а)активації глікогенфосфорилази за рахунок її ЦАМФ-залежного фосфоритування.б)інгібування глікогенсинтетази за рахунок її ЦАМФ-залежного фосфоритування.Інсулін-стимулює глікогенез і гальмує глікогеноліз шляхом:а)підвищення проникності мембран м’язових клітин для глюкози,що викор для синтезу глікогену.б)зменшення внутрішньокліт.рівня цапф за рахунок активації її розщеплення фосфодіестеразою.У печінці.Глюкагон-стимулює глікогеноліз та гальмує глікогенез за механізмом аналогічним дії адреналіну в кліт.мязів.Інсулін-підвищує активність ферментативних реакцій синтезу глікогену за рахунок біохім.механізмів.3)інгібітори трансляції у прокаріотів та еукаріотів.антибіотики.механізмом контролью процесів трансляції в кліт.еукаріотів є ковалентна модифікація білкового фактора ініціації трансляції ,який може бути в дефосфорилованій (активній)та фосфоризованій(неактивній) формах.регуляція здійсн.за такою схемою:1.в ініціації синтезу глобіну бере участь фактор ініціації eIF-2,який може бути в дефосфорилованій та фосфоризованій формах.2.фосфорилування а-субодиниці фактора ініціації синтезу глобіну eIF-2 специф. eIF-2-протеїкіназою ін активує фактор і тим самим блокує процес ініціації трансляції.3.активність eIF-2-кінази що фосфоризує фактор eIF-2 контролюється іншою протеїкіназою яка є цапф залежною.4.каталітична активність цапф-залежної протеїкінази негативно контролюється гемом,який є інгібітором цієї кінази,блокуючи вивільнення її каталітичної субодиниці.Антибіотики.1.у клінічній практиці винайшли застосув.антибіотики на різних етапах трансляції:1.інгібітори ініціації :стрептоміцин,ауринтрикарбоксилова к-та.2.інгібітори елонгації:аміцетин,хлорамфенікол,еритроміцин,циклогексимід,пуроміцин,тетрацикліни3.інгібітори термі нації:анізоміцин,хлорамфенікол,еритроміцин,лінкоцин,стрептоміцин.потужним інгібітором трансляції в еукаріотів є дифтерійний токсин. 8. Біосинтез глікогену: ферментативні реакції, фізіологічне значення. Регуляція активності глікогенсинтази. Глюкоза→ г-6-ф, Ė гексокіназа або глюкокіназа; г-6-ф→ г-1-ф, Ė фосфоглюкомутаза. Утворюється активна форма глюкози, для синтезу глікогену: г-1-ф + УТФ↔ УДФ-1-г, Ė УДФ-глюкозопірофосфорилаза. Синтез глікогену (утворення α-1,4-глікозидних зв`язків): УДФ-1-г + термінальний залишок глюкози(С6Н10О5)n→ УДФ + (С6Н10О5)n+1; Ė глікогенсинтаза (УДФ-глікогентрансфераза). Розгалуження утворюються переносом кінцевого фрагменту полісахариду з 6-7 мономерів на кілька мономерів далі; Ė аміло(1,4-1,6)глікозилаза. У той час, як глікогенфосфорилаза фосфорилюється і стає активною – глікогенсинтаза теж фосфорилюється (цАМФ-залежною протеїнкіназою), але в цьому стані – неактивна. 9. Механізми реципрокної регуляції глікогенолізу та глікогенезу за рахунок каскадного цАМФ-залежного фосфорилювання ферментних білків. Стимуляція каскаду фосфоролізу глікогену адреналіном або глюкагоном, яка супроводжується зростанням концентрації в клітинах цАМФ та активності цАМФ-залежних протеїнкіназ, призводить до фосфорилювання глікогенсинтази і її інактивації, тобто до пригнічення реакцій синтезу глікогену. Таким чином, глікогенфосфорилаза і глікогенсинтаза регулюються реципрокно: активація глікогенфосфорилази (і фосфоролізу глікогену) відбувається в умовах інактивації глікогенсинтази (і синтезу глікогену). Ця реципрокна регуляція метаболізму є яскравим проявом молекулярної логіки живих організмів, які включають катаболічні ферментні системи при необхідності забезпечення клітин енергією (м’язова діяльність вимагає розщеплення резервних вуглеводів) і переключають біохімічні реакції на шляхи анаболізму (в даному випадку — синтезу глікогену) в період фізіологічного спокою:
10. Роль адреналіну, глюкагону та інсуліну в гормональній регуляції обміну глікогену в мязах та печінці. У мязах. Адреналін-стимулює глікогеноліз та гальмує глікогенез шляхом: А)Активації глікогенфосфорилази за рахунок її цАМФ-залежного фосфорилювання Б)Інгібірування глікогенсинтази за рахунок її цАМФ-залежного фосфорилювання Інсулін- стимулює глікогенез і гальмує глікогеноліз шляхом: А)Підвищення проникності мембран м*язових клітин для глюкози,що використ.для синтезу глікогену. Б)Зменшення внутрішньоклітинного рівня цАМФ за рахунок активації її розщеплення фосфодіестеразою У печінці. Глюкагон-стимулює глікогеноліз та гальмує глікогенез за механізмом,аналогічним дії адреналіну в клітинах м*язів Інсулін-підвищує активність ферм.реакцій синтезу глікогену за рахунок біохімічних механізмів,близьких до розглянутих вище. Таким чином: -переважання інсуліну сприяє утворенню в організмі резервів вуглеводів у формі глікогену печінки. -переважання глюкагону сприяє мобілізації запасів глікогену печінки в умовах зниження рівня глюкоземії,яке спостерігається через декілька годин після споживання їжі. 11. Генетичні порушення метаболізму глікогену (глікогенози, аглікогенози). Глікогенози – спадкові хвороби, молекулярною основою виникнення яких є уроджена недостатність синтезу певних ферментів глікогенолізу, пов’язана з дефектами в генетичній системі клітин. При глікогенозах у внутрішніх органах та тканинах (здебільшого в печінці, м’язах, клітинах крові) спостерігається накопичення аномально надмірної кількості глікогену, іноді зі зміненою молекулярною структурою, який не може використовуватися у метаболічних процесах. Клінічно глікогенози проявляються важкою гіпоглюкоземією внаслідок нездатності глікогену печінки розщеплюватися з вивільненням молекул глюкози.
Аглікогенози – спадкові хвороби накопичення глікогену, молекулярною основою яких є генетичні дефекти, що призводять до порушення утворення ферменту глікогенсинтази. Аглікогеноз (гіперглікемічні судоми) супроводжується різкою гіпоглікемією, судомами вранці, відсутністю глікогену в печінці. Первинний біохімічний дефект - ушкодження ферментів, відповідальних за синтез глікогену: глікогенсинтетази й уридиндифосфат-глюкозо-глікоген-трансферази. Судомних станів уникають шляхом частих годувань, у тому числі вночі. Аглікогеноз успадковується за АР-типом. 12. Глюконеогенез: субстрати, ферменти та фізіологічне значення процесу. Глюконеогенез — синтез вуглеводів із невуглеводних попередників: піровіноградної, молочної та щавлевооцтової кислот. Всі перетворення глюконеогенезу локалізується у цитоплазмі, проте в еукаріот перша реакція цього шляху має місце у мітохондріях Реакції глюконеогенезу відбуваються переважно в печінці та кірковому шарі нирок.Біосинтез глюкози забезпечує її нормальну концентрацію в умовах зменшеного надходження моносахариду із зовнішнього середовища та вичерпання глікогену печінки та м*язів. Реакції та ферменти глюконеогенезу: 1.Перетворення пірувату у фосфоенолпіруват. Відбувається у 2 етапи: І)Перетворення пірувату в оксалоацетат за участю піруваткарбоксилази піруват+СО2+АТФ=оксалоацетат+АДФ+Фн ІІ)Перетворення оксалоацетату в фосфоенолпіруват за участюфосфоенолпіруваткарбоксикінази оксалоацетат+ГТФ=ФЕП+СО2+ГДФ 2.Перетворення фруктозо-1,6-дифосфату в фруктозо-6-фосфат за участю фруктозо-1,6-дифосфотази фруктозо-1,6-дифосфат+Н2О = фруктозо-6-фосфат + Фн 3.Перетворення глюкозо-6-фосфату в глюкозу за участю глюкозо-6-фосфатази Глюкозо-6-фосфат+Н2О = глюкоза + Фн Субстрати глюконеогенезу. Основними попередниками (субстратами) є піруват (лактат) та мінокислоти (переважно аланін), що утворюються, головним чином, у функціонуючих скелетних мязах, еритроцитах та клітинах деяких інших тканин. Фізіологічне значення процесу. Реакції глюконеогенезу відбуваються переважно в печінці та, в деякій мірі, в кірковому шарі нирок, оскільки в клітинах саме цих органів присутній повний набір необхідних ферментів. За добу в організмі дорослої людини синтезується до 80 г глюкози. Біосинтез глюкози забезпечує її нормальну концентрацію в умовах зменшеного надходження моносахариду із зовнішнього середовища та вичерпання головного акумульованого джерела глюкози — глікогену печінки та м’язів. 13. Глюкозо-лактатний (цикл Корі) та глюкозо-аланіновий цикли. Глюкозо-лактатний (цикл Корі) – це процес утворення лактату в клітинах м’язової тканини в ході анаеробного гліколізу, його виходу у кров крізь плазматичні мембрани м’язових клітин і використання лактату (після окиснення в піруват) у гепатоцитах печінки для глюконеогенезу. При максимальній активності м’язів у результаті посилення інтенсивності процесу гліколізу надлишок молочної кислоти з кров’ю потрапляє до печінки, де використовується як субстрат для синтезу глюкози шляхом глюконеогенезу. Утворена глюкоза використовується для синтезу глікогену. Глікоген у печінці розщеплюється до глюкози, яка з кров’ю надходить у м’язи, де здійснюється ресинтез глікогену, який є джерелом глюкози. Глюкоза використовується як енергетичний субстрат, необхідний для діяльності м’язової тканини. Цикл Корі забезпечує перерозподіл глікогену між печінкою та м’язами, економне використання вуглеводів в організмі та сприяє підтримці нормального вмісту глюкози в крові.  Глюкозо-аланіновий цикл функціонує в м'язах при голодуванні. При дефіциті глюкози, АТФ синтезується за рахунок розпад білків і катаболізму амінокислот в аеробних умовах, при цьому глюкозо-аланіновий цикл забезпечує: 1) видалення азоту з м'язів в нетоксичної формі; 2) синтез глюкози (печінка).  14. Глюкоза крові (глюкоземія): нормоглікемія , гіпо- та гіперглікемії, глюкозурія. Цукровий діабет- патологія обміну глюкози. Нормоглікемія – нормальна кількіть глюкози в крові. Норма глюкози в крові становить від 3,3 до 5,5 ммоль /л. Гіпоглікемія – зменшена кількість глюкози в крові нижче 3 ммоль / л. Причини гіпоглікемії можуть полягати в ендокринному порушенні, вродженої патології, сильному стресі, фізичному навантаженні або просто незбалансованому харчуванні. Симптоми реактивної гіпоглікемії: паніка, запаморочення, тахікардія, нудота і блювота, сильний голод. Гіперглікемія – збільшена кількість глюкози в крові. Головною причиною, що обумовлює виникнення гіперглікемії, є низька кількість інсуліну (гормону, що знижує концентрацію глюкози в крові). Іноді також інсулін не може правильно взаємодіяти з клітинами організму, щоб утилізувати глюкозу. Також причиною може бути переїдання, вживання калорійної їжі, що містить підвищену кількість простих і складних вуглевод Глюкоземія – наявність глюкози в сечі. Цукровий діабет — група ендокринних захворювань, що розвиваються внаслідок абсолютної чи відносної недостатності гормону інсуліну, внаслідок чого виникає стійке підвищення рівня глюкози в крові —гіперглікемія. Захворювання характеризується хронічним перебігом і порушенням усіх видів обміну речовин: вуглеводного, жирового,білкового, мінерального і водно-сольового. Характерними симптомами є невгамовна спрага (полідипсія) та надмірне сечовиділення (поліурія), однак ці симптоми можуть бути слабко вираженими, якщо рівень глюкози в крові підвищений помірно. 15. Гормональна регуляція концентрації та обміну глюкози в крові. Адреналін-стимулює глікогеноліз та гальмує глікогенез шляхом: А)Активації глікогенфосфорилази за рахунок її цАМФ-залежного фосфорилювання Б)Інгібірування глікогенсинтази за рахунок її цАМФ-залежного фосфорилювання Інсулін- стимулює глікогенез і гальмує глікогеноліз шляхом: А)Підвищення проникності мембран м*язових клітин для глюкози,що використ.для синтезу глікогену. Б)Зменшення внутрішньоклітинного рівня цАМФ за рахунок активації її розщеплення фосфодіестеразою Глюкагон-стимулює глікогеноліз та гальмує глікогенез за механізмом,аналогічним дії адреналіну в клітинах м*язів Інсулін-підвищує активність ферм.реакцій синтезу глікогену за рахунок біохімічних механізмів,близьких до розглянутих вище. Таким чином: -переважання інсуліну сприяє утворенню в організмі резервів вуглеводів у формі глікогену печінки. -переважання глюкагону сприяє мобілізації запасів глікогену печінки в умовах зниження рівня глюкоземії,яке спостерігається через декілька годин після споживання їжі. |