Білети з біологічної хімії (пмк 2) Введення в біохімію. Біохімічні компоненти клітин
 Скачать 0.76 Mb. Скачать 0.76 Mb.
|
|
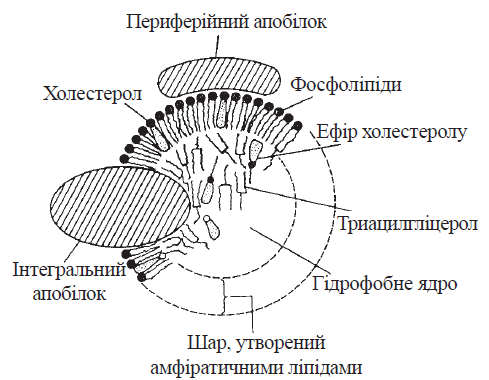
12. Біосинтез холестерину: схема реакцій, регуляція синтезу холестерину. Схема реакцій біосинтезу холестерину. 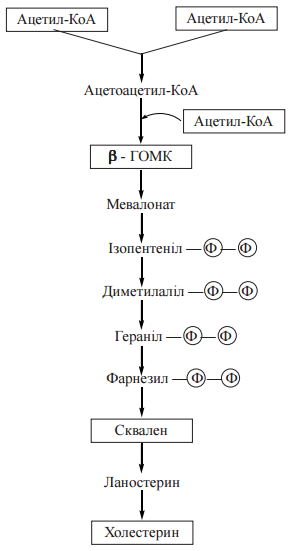 Сумарне рівняння біосинтезу холестерину (С27Н46О) з ацетил-КоА можна подати таким чином: 18 СН3СО-SKoA + 13 НАДФН + 13 Н+ + 3 О2 + 18 АТФ → С27Н46О + 13 НАДФ+ + 18 KoASH + 9 СО2 + 18 АДФ + 6 Н4Р2О7 + + 6 Н3РО4 + Н2О Регуляція біосинтезу холестерину. Лімітуючим етапом у процесі біосинтезу холестерину є реакція утворення мевалонату з бета-ГОМК, що каталізуєтьсяб бета-ГОМК-редуктазою. Гальмування швидкості процесу здійснюється за принципом негативною зворотного зв’язку, коли накопичення кінцевою продукту анабопічного шляху- холестерину зменшує його утворення. Інгібітором ферменту є холестерин або холестерино вмісний ліпопротеїн ЛПНЩ. Відповідно до таких механізмів, споживання холестерину з їжею гальмує його утворення в печінці, а безхолестеринова дієта, навпаки, активує ендогенний синтез холестерину в гепатоцитах. 13. Шляхи біотрансформації холестерину: етерифікація; утворення жовчних кислот, стероїдних гормонів , вітаміну D3. Холестерин, що синтезувався в організмі, або надійшов із продуктами харчування, підлягає численним метаболічним перетворенням — біотрансформації, в результаті чого утворюються біологічно активні сполуки стероїдної природи, а також створюються умови для екскреції надлишків стеролу. Етерифікація холестерину. Синтез ефірів холестерину в плазмі крові та в клітинах відбувається за різними механізмами. 1. Зовнішньоклітинна етерифікація холестерину здійснюється ферментом лецитин (фосфатидилхолін)-холестерин-ацилтрансферазою (ЛХАТ) плазми. ЛХАТ каталізує реакцію перенесення ацильного залишку з 2-го (β-) положення фосфатидилхоліну на гідроксильну групу холестерину: холестерол + фосфатидилхолін → холестерол-ефір + лізофосфатидилхолін Для етерифікації холестерину використовуються ненасичені жирні кислоти: лінолеваС18:2 (переважно) та олеїноваС18:1. Найбільш активно реакція відбувається в ліпопротеїнах крові ЛПВЩ. 2. Внутрішньоклітинна етерифікація холестерину перебігає за участю ацил- КоА-холестерин-ацилтрансферази (АХАТ): холестерол + ацил-КоА → холестерол-ефір + KoA-SH Утворення жовчних кислот. У гепатоцитах холестерин перетворюється нажовчні кислоти — важливі компоненти жовчі, що беруть участь у перетравленні харчових жирів у кишечникулюдини і тварин.Жовчні кислоти є гідроксильованими похідними холанової кислоти;до них належать такі сполуки: холева(3,7,12-триоксихоланова), дезоксихолева (3,12-діоксихоланова), хенодезоксихолева (3,7-діоксихоланова) талітохолева (3-оксихоланова) кислоти. 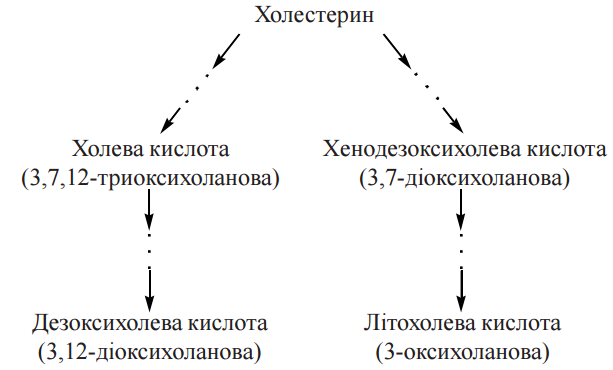 Основним, щодо кількості, представником жовчних кислот у жовчі людини є холева кислота, яка бере участь в емульгуванні жирів у кишечнику у вигляді натрієвої та калієвої солей її кон’югованих форм — глікохолевої та таурохолевої кислот. Глікохолат і таурохолат містять в своїй структурі гідрофільні (радикали гліцину та таурину) та гідрофобні (стероїдне ядро) молекулярні групи, і завдяки своїй амфіпатичній будові є високоактивними детергентами, що необхідні для емульгування жирів у кишечнику. Утворення стероїдних гормонів Стероїдні гормони містять у своєму складі 21 (кортикоїди, прогестерон) і менше (19 — андрогени, 18 — естрогени) атомів вуглецю, тому їх утворення з С27-стероїду холестерину включає, крімокисного гідроксилювання, і розщеплення вуглеводневого бічного ланцюга, реакції окислення, відновлення та ізомеризації. Першим етапом на шляху синтезу з холестерину стероїдних гормонів надниркових залоз (кортикостероїдів) є утворення С21-стероїду прегненолону — безпосереднього попередника прогестагену прогестерону (С21), який у клітинах надниркових залоз перетворюється на кортикостероїди (С21): глюкокортикоїд кортизол та мінералокортикоїд альдостерон. Гормони чоловічих та жіночих статевих залоз також утворюються з холестерину через стадію прегненолону та прогестерону, який у цих органах перетворюється в 17-α-гідроксипрогестерон — попередник андрогену (С19) — тестостерону та естрогенів (С18) — естрону та естрадіолу. Утворення вітаміну D3 Перетворення холестерину у вітамін D3 — холекальциферол — потребує розщеплення кільця циклопентанпергідрофенантрену з утворенням провітаміну D3, який підлягає реакціям окисного гідроксилювання з утворенням біологічно активної форми вітаміну — 1,25-дигідроксихолекальциферолу (кальцитріолу). Схема біотрансформації холестерину з утворенням жовчних кислот та біологічно активних стероїдів: 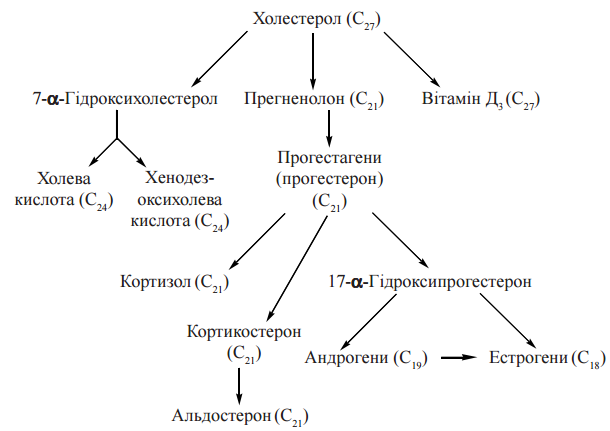 14. Циркуляторний транспорт та депонування ліпідів у жировій тканині. Ліпопротеїнліпаза ендотелію. Під дією панкреатичної ліпази та за участю жовч них кислот, які виробляються в печінці, триацилгліцероли продуктів харчування розщеплюються з утворенням 2-моноацилгліцеролів (моногліцеридів) та двох молекул вільних жирних кислот, що можна подати таким сумарним рівнянням: 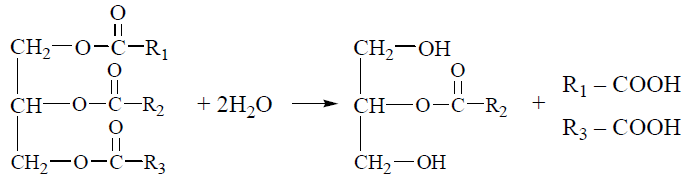 Зазначені продукти гідролізу (вищі жирні кислоти, моногліцериди) абсорбуються клітинами слизової оболонки тонкої кишки (ентероцитами). Холестерин продуктів харчування всмоктується у вільному стану, холестериди — після відповідного гідролізу холестеролестеразою. Усередині ентероцитів продукти гідролізу триацигліцеролів, що всмокталися, беруть участь у двох біохімічних процесах, які є передумовою подальшого надходження нейтральних жирів у кров, біотранспорту та їх тканинного депонування, а саме реестерифікації вищих жирних кислот з утворенням нових молекул триацилгліцеролів та формування транспортних форм триацилгліцеролів — хіламікронів. Ресинтез триацилгліцеролів в ентероцитах. Оскільки 2-моноацилгліцероли е основними продуктами гідролізу триацилгліцеролів, що абсорбуються епітеліоцитами кишечника, реетерифікація жирних кислот усередині цих клітин перебігає моногліцеридним шляхам, що включає такі реакції: Утворення 1,2-моноацилгліцеролів (реакція каталізується кишковим ферментом моноацилгліцерол-ацилтрансферазою): 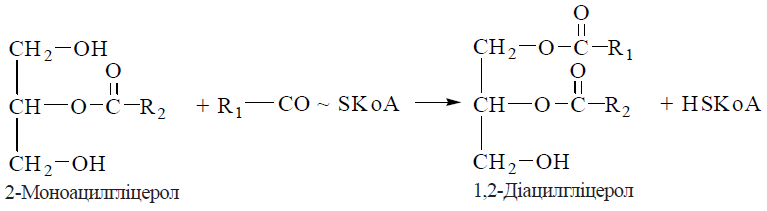 Утворення триацилгліцеролів за участю діацигліцерол-ацилтрансферази: 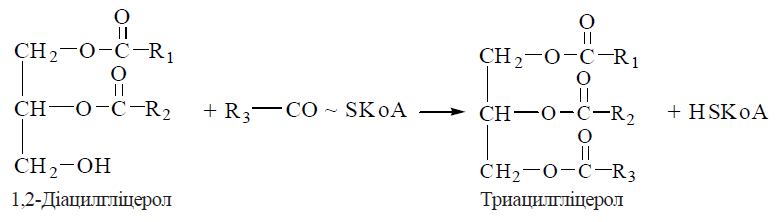 Хіломікрони є основною молекулярною формою, у вигляді якої нейтральні жири (триацилгліцероли) проходять через латеральну мембрану ентероцитів і через систему лімфатичних судин (лактеалей) потрапляють у лімфатичний протік, а потім — у кров (через v.subclavia sin.). Ліпопротеїнліпаза— ферментний білок, адсорбований на глікозамінгліканах поверхні ендотелію і має центр зв’язування ліпопротеїнів крові та каталітичний центр гідролізу триацилгліцеролів. Під дією ліпопротеїнліпази утворюються вільні жирні кислоти та гліцерин, що проникають через судинну стінку всередину клітин, де окислюються з вивільненням енергії (в міоцитах тощо) або депонуються у вигляді резервних триацилгліцеролів (в адипоцитах жирової тканини). Ліпопротеїни, що утворюються внаслідок деліпідизації ХМ та ЛПДНЩ — залишкові, або ремнантні ліпопротеїни, збагачені (порівняно з ХМ та ЛПДНЩ) вільним та етерифікованим холестеролом. Ремнанти ХМ поглинаються з крові клітинами печінки, які використовують більшість холестерину цих ліпопротеїнів для синтезу жовчних кислот. Ремнанти ЛПДНЩ отримали назву ЛППЩ і є безпосередніми попередниками в утворенні ЛПНЩ. 15. Ліпопротеїни плазми крові: ліпідний та білковий (апопротеїни) склад. Гіперліпопротеїнемії. За своєю молекулярною будовою ліпопротеїни плазми крові — це кулеподібні структури — міцели, всередині яких міститься гідрофобна ліпідна серцевина (ядро), що складається переважно з триацигліцеролів та ефірів холестерину. Гідрофобне ядро вкрите шаром полярних амфіпатичних фосфолілідів, периферичних та інтегральних білків.
підвищення (порівняноз нормою для певної популяції) концентрації певних класів ліпопротеїнів, а також триацилгліцеролів та холестерину. За механізмом походження виділяють:
16. Патології ліпідного обміну: атеросклероз, ожиріння, цукровий діабет. Атеросклероз — хвороба, головним проявом якої є відкладання в судинних стінках ліпідних утворень - бляшок, основними біохімічними компонентами яких є холестерин та його ефіри. Навкруги ліпідних бляшок в інтимі судин виникає клітинна реакція, що включає в себе утворення фіброзної тканини та проліферацію гладенько-м’язових клітин. Атеросклеротичні бляшки спричиняють звуження кровоносних судин, посиленне згортання крові в ділянках їх локалізації та, як результат, порушення кровопостачання відповідних органів і тканин. Як наслідок атеросклерозу розвиваються ішемічна хвороба серця, інфаркт міокарда й порушення церебрального кровообігу, що стають важливою причиною смерті людей дорослого та похилого віку. Біохімічною основою розвитку атеросклерозу є підвищена концентрація в крові людини холестерину— гіперхолестеринемія,спричинена різними факторами —дієтарними, ендокринними, генетичними. Ожиріння – стан, що характеризується надмірним накопиченням у жировій тканині триагцигліцеролів. Ожиріння розвивається внаслідок перевищення надходження та біосинтезу в тканинах нейтральних жирів (та інших біомолекул, які можуть перетворюватися в жири) над реальними енергетичними потребами організму в цих видах метаболічного палива. Найбільш несприятливе значення для розвитку ожиріння має постійне надмірне надходження з продуктами харчування вуїлеводів (особливо глюкози та фруктози) в кількостях, більших за ті, що безпосередньо окислюються в клітинах і можуть депонуватися у вигляді резервів глікогену. Цукровим діабет традиційно розглядається як патологія, що первинно пов’язана з порушеннями вуглеводного обміну. Дійсно, найбільш характерним біохімічним проявом різних типів цукровою діабету в клініці гіперглікемія(гіперглюкоземія), яка розвивається внаслідок втрати специфічною виливу інсуліну на проникність клітинних мембран для глюкози. Але метаболічні ефекти інсуліну розповсюджуються на багато аспектів обміну глюкози, ліпідів та амінокислот, у зв’язку з чим цукровий діабет є хворобою, при якому відбуваються глибокі порушення не тільки вуплеводного, але й ліпідного та білкового обмінів. Розрізняють інсулінозалежний цукровий діабет (діабет І типу, ювенільний діабет) та інсулінонезалежний цукровий діабет (діабет 2го типу, діабет похилого віку). ЗАДАЧІ
|