ответы 50-99. 50. Окислювальне фосфорилювання
 Скачать 370.05 Kb. Скачать 370.05 Kb.
|
50.Окислювальне фосфорилювання Окиислювальне фосфорилювання — один з найважливіших компонентів клітинного дихання, що приводить до отримання енергії у вигляді АТФ. Субстратами окислювального фосфорилювання виступають продукти розщеплення органічних сполук — білки, жири та вуглеводи. У процесі реакцій спряженого окислювального фосфорилювання перенос пари електронів та протонів водню через систему дихального ланцюга, за аеробних умов, приводить до утворення трьох молекул АТФ, а перенос пари електронів та протонів за анаеробних умов призводить до утворення однієї молекули АТФ. Завдяки процесам окислювального фосфорилювання енергія окисних процесів трансформується у енергію зв'язків макроенергічних сполук. 51. Шляхи утворення АТФ в організмі АТФ утворюється при окисленні вуглеводів, жирів і білків. АТФ утворюється при наступних умовах. 1. Окислення вуглеводів, головним чином глюкози, і окислення інших Сахаров, але в меншій кількості, наприклад окислення фруктози; ці процеси спостерігаються в цитоплазмі клітин при анаеробних процесах гліколізу і в мітохондріях при аеробномуокисленні в циклі лимонної кислоти (циклі Кребса). 2. Окислення жирних кислот в мітохондріях клітин при бета-окисленні. 3. Окислення білків, які попередньо повинні гидролизоваться до амінокислот з подальшим розщепленням амінокислот до проміжних продуктів циклу лимонної кислоти і потім - до ацетил-КоА і вуглекислого газу. 52.Загальна характеристика вуглеводів. Значення для живих організмів, їх класифікація. Вуглеводи – біохімічні сполуки, які утворюються в рослинах як первинні продукти фотосинтезу та є важливою складовою частиною живих організмів. Вуглеводи входять до складу всіх рослинних клітин. На долю вуглеводів припадає біля 80% сухої речовини рослин і біля 20% — у тваринних клітинах. Утворення вуглеводів у рослинних організмах є результатом фотосинтезу, до найважливіших продуктів якого відноситься крохмаль і сахароза (буряковий або тростинний цукор). Функції вуглеводівв організмі людини: енергетична – забезпечують організм на 60% енергією; пластична – беруть участь у синтезі багатьох речовин, необхідних для життєдіяльності організму (нуклеопротеїди, ліпоїди, складні ферменти і ін.); регуляторна – регулюють (клітковина) функцію шлунково-кишкового тракту; специфічна – виконують (окремі представники) в організмі особливі функції, наприклад, беруть участь у проведенні нервових імпульсів, утворенні антитіл; функція харчових речовин – відкладаються в організмі у вигляді запасного вуглеводу глікогену, який витрачається в міру необхідності; захисна – в’яжучі секрети, які виділяються різними залозами і багаті на мукополісахариди, захищають стінки деяких порожнистих органів від механічних пошкоджень і від проникнення патогенних бактерій і вірусів. Вуглеводи, особливо крохмаль та сахароза, забезпечують основну частину калорійності раціону та суттєво впливають на сенсорне оцінювання харчових продуктів. Вуглеводи вносять вагомий вклад в текстуру продуктів, оскільки вони здатні впливати на в’язкість, кристалізацію, гелеутворення, стабільність. Вони впливають на приємні відчуття у ротовій порожнині завдяки солодкості, на колір та аромат харчових продуктів завдяки їх здатності вступати в хімічні перетворення з утворенням зафарбованих та ароматичних речовин. Під час виробництва багатьох харчових продуктів вуглеводи складають один із головних сировинних ресурсів для фізичних, хімічних, біохімічних та мікробіологічних процесів, керування якими надасть можливостей отримати широкий спектр продуктів харчування різного призначення та з різними властивостями. Класифікація вуглеводів. Прості вуглеводи - моносахариди, складні вуглеводи – низькомолекулярні (олігосахариди) та високомолекулярні полісахариди. Моносахариди – вуглеводи, які не піддаються гідролізу; гарно розчиняються у воді з утворенням істинних розчинів, солодкі за смаком, оптично активні. Більшість цих речовин має склад, що відповідає загальній формулі СnH2nOn. 53.Характеристика моносахаридів. Їх фізичні та хімічні властивості (явище таутомерії, мутаротації). Оксикарбонільні та циклічні форми. Представники. Моносахариди або монози — найпростіші вуглеводи, вони не піддаються гідролізу. Це безбарвні кристалічні сполуки, добре розчинні у воді, але не розчинні у неполярних розчинниках, переважно солодкі на смак. Типова будова молекули моносахариду така: нерозгалужений карбоновий скелет, що містить від 3-ох до 9-ти атомів, до одного із яких подвійним зв'язком приєднаний атом оксигену, формуючи карбонільну групу, до решти атоми оксигену приєднані одинарними зв'язками, формуючи гідроксильні групи. Якщо карбонільна група розташована на кінці молекули — сполука є альдозою, а якщо посередині — кетозою. Найпростіші моносахариди — це тріози (містять три атоми карбону): гліцеральдегід (альдотріоза) і дигідроксиацетон (кетотріоза). Прості цукри із 4-ма атомами карбону називаються тетрозами, з 5-ма — пентозами, 6-ма — гексозами, 7-ма — гептозами і так далі. Найпоширеніші у природі гексози, до цієї групи належить глюкоза (альдогексоза) і фруктоза (кетогексоза). Моносахариди являють собою сполуки зі змішаними функціями. Так, як в розчинах вони існують в декількох таутомерних формах, зв'язаних між собою в рівновагу, в залежності від умов і природи діючого реагенту в реакцію можуть вступати або оксикарбонільна форма, або циклічні напівацетальні форми. При цьому рівновага буде безперервно посуватися в бік утворення той форми, яка вступає до взаємодії. 1) Окислення. В реакції окислення моносахариди вступають в оксикарбінільній формі, по альдегідній групі. Використовують м'які окислювачі, тому що під дією сильних окислювачів утворюються більш складні продукти. Наприклад, при окисленні Д-глюкози бромною водою, утворюється Д-глюконова кислота. Окислювач НОBr (кислота), яка утворюється в водному розчині брому: 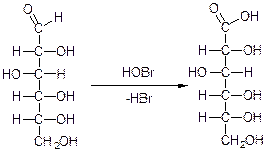 Д-глюкоза Д-глюконова кислота Якісними реакціями на моносахариди є реакції окислення аміачним розчином оксиду срібла та рідиною Фелінга. При цьому утворюється осад металевого срібла в першому випадку або цегляного – червоний осад Cu2O у другому випадку: 2) Відновлення. При відновленні D-глюкози воднем при наявності kat (Ni) утворюється шестиатомний спирт – Д-сорбіт: 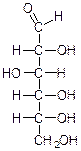 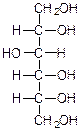 Д-глюкоза Д-сорбіт Цю реакцію також дає і фруктоза. Сорбіт використовують, як замінник сахарози в харчуванні людей, хворих на цукровий діабет. 3) Утворення простих ефірів. Завдяки присутності в молекулах моносахаридів декількох гідроксильних груп, моносахариди проявляють властивості багатоатомних спиртів. Найбільше значення мають реакції етерифікації (утворення складних ефірів). Серед гідроксильних груп моносахаридів найбільш активний в реакціях напівацетальний гідроксил, висока рухомість атома водню в цьому гідроксилі обумовлена здібністю перетворення напівацетальних форм у оксикарбонільні. При взаємодії моносахаридів зі спиртами утворюються неповні прості ефіри – глікозиди. В цій реакції приймає участь лише напівацетальний гідроксил, який називають глікозидним гідроксилом. Інші спиртові гідроксильні групи в цих умовах ці спиртами не взаємодіють: 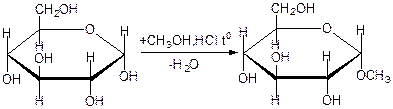 α-Д-глюкопіраноза метил-α-Д-глюкопіраноза Глюкозиди широко розповсюджені в природі і мають велике біологічне значення. В природних глікозидах моносахариди часто з'єднані з різноманітними не сахарними складними речовинами (барвники, алкалоїди). Не сахарний компонент, з'єднаний з глікозидом називають агліконом. При дії на моносахариди йодистих алкілів можна замістити алкільними радикалами водень не тільки напівацетальної, але й всіх інших гідроксильних груп. При цьому утворюються повні прості ефіри моносахаридів: 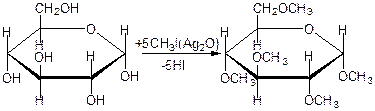 α-Д-глюкопіраноза пентаметил-α-Д-глюкопіраноза 4) Утворення складних ефірів. При дії на глюкозу оцтового ангідриду утворюються її пентаацетальні похідні – повні складні ефіри. 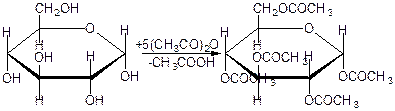 α-Д-глюкопіраноза пентаацетил-α-Д-глюкопіраноза В природі зустрічаються і мають велике значення неповні складні ефіри ортофосфорної кислоти і моносахаридів. Фосфати Д-глюкози і Д-фруктози утворюються як проміжні продукти при спиртовому бродінні. Фосфати беруть участь в утворенні нуклеїнових кислот. 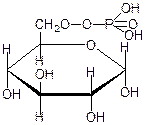 6-фосфат-α-Д-глюкопіранози 5) Бродіння моносахаридів. Бродінням називають розщеплення цукрі під впливом біологічних каталізаторів – ферментів. Процеси бродіння відбуваються складними шляхами через ряд проміжних продуктів. Існують різні види бродіння, основні з них: а) спиртове бродіння: С6Н12О6→2СН3-СН2-ОН+2СО2↑ б) маслянокисле: С6Н12О6→СН2-СН2-СН2СООН+2Н2+2СО2↑ в) молочнокисле: ОН
С6Н12О6→2СН3-СН-СООН г) лимоннокисле: ОН С6Н12О6+3О→НООС-СН2-С-СН2-СООН+2Н2О
СООН 54.Характеристика дисахаридів. Їх фізичні та хімічні властивості. Представники. Дісахаріди – продукти реакції діконденсаціі однакових або різних молекул моносахаридів. Дісахаріди є одним з різновидів олигосахаридов (в освіті їх молекул бере участь невелика кількість молекул моносахаридів (однакових або різних). Найважливішим представником дисахаридів є сахароза (буряковий або тростинний цукор). Сахароза – продукт взаємодії альфа -D- глюкопіраноз (альфа- глюкози) і бета -D- фруктофуранози (бета- фруктози). Її формула в загальному вигляді С12Н22О11. Сахароза – один з численних ізомерів дисахаридов. Це біле кристалічні речовина, яка існує в різних станах: крупнокристалічного («цукрові голови»), дрібнокристалічному (цукровий пісок), аморфному (цукрова пудра). Добре розчиняється у воді, особливо в гарячій (порівняно з гарячою водою, розчинність сахарози в холодній воді відносно невелика), тому сахароза здатна утворювати « перенасичені розчини» – сиропи, які можуть « зацукровують», тобто відбувається утворення дрібнокристалічних суспензій. Концентровані розчини сахарози здатні утворювати особливі стеклообразниє системи – карамелі, що використовується людиною для отримання певних сортів цукерок. Сахароза – солодке речовина, але інтенсивність солодкого смаку у неї менше, ніж у фруктози. Найважливішим хімічною властивістю сахарози є її здатність до гідролізу, при якому утворюється альфа- глюкоза і бета- фруктоза, які вступають в реакції обміну вуглеводів. Для людини сахароза є одним з найважливіших продуктів харчування, так як вона – джерело глюкози. Однак надмірне вживання сахарози шкідливо, бо це призводить до порушення вуглеводного обміну, що супроводжується появою захворювань: діабету, хвороб зубів, ожиріння. 55.Характеристика полісахаридів (крохмаль, целюлоза, гепарин). Полісахариди (або поліцукриди) або полімери цукрів — вуглеводи, які багато в чому відрізняються від моносахаридів і дисахаридів, не мають солодкого смаку і майже не розчинні в воді. Крохмаль – це представник групи полісахаридів. Склад молекули крохмалю виражається формулою (C6H10O5)n. Це природний полімер, що синтезується в рослинах з глюкози: nC6H12O6 → (C6H10O5)n + nH2O. Полімерні ланцюги крохмалю неоднорідні. Серед них є лінійні та розгалужені, довгі та короткі. Число ланок у полімері коливається від кількох сотень до п’яти тисяч і більше. Крохмаль поширений у природі. Для різних рослин він запасний поживний матеріал і міститься в них у вигляді крохмальних зерен. Масова частка його у бульбах картоплі становить приблизно 20 %, у зернах пшениці – близько 70 %, рису – близько 80 %. Крохмаль – білий порошок, що не розчиняється в холодній воді. У гарячій воді він набрякає, утворюючи клейстер. Характерною реакцією на крохмаль є утворення синього забарвлення при взаємодії з розчином йоду. Найважливіша хімічна властивість крохмалю – його гідроліз. Кінцевим продуктом гідролізу є глюкоза: (C6H10O5)n + nH2O → nC6H12O6. Проміжні продукти гідролізу крохмалю – суміш декстринів і глюкози (патоку) використовують у кондитерській промисловості для виготовлення цукерок, додають у тісто для випікання пряників. Крохмаль є сировиною для виробництва етилового спирту. У текстильній промисловості крохмаль використовують для проклеювання тканин, у паперовій – для склеювання паперу і картону, у медицині – для виготовлення присипок, паст, капсул для лікарських препаратів. Целюлоза – природний полісахарид. Загальна формула її молекули (C6H10O5)n. Ступінь полімеризації целюлози набагато більший, ніж у крохмалю, і становить від 10 000 до 40 000. Макромолекули целюлози лінійної форми, ниткоподібні, через це вони можуть утворювати волокна. Целюлоза, або клітковина – ще більш поширений вуглевод, ніж крохмаль. З неї складаються в основному стінки рослинних клітин. Масова частка целюлози у деревині становить близько 60 %, у ваті і фільтрувальному папері – 90 %. Целюлоза – тверда волокниста речовина, нерозчинна у воді й органічних розчинниках. Подібно до крохмалю, целюлоза при нагріванні з розбавленими кислотами піддається гідролізу, утворюючи глюкозу: (C6H10O5)n + nH2O → nC6H12O6. Целюлоза легко взаємодіє з нітратною кислотою, утворюючи моно-, ди- та тринітратцелюлози: [C6H7O2(OH)3]n + 3nHONO2 → [C6H7O2(ONO2)3]n + 3nH2O тринітратцелюлоза З оцтовою кислотою целюлоза утворює естери- моно-, ди та триацетатцелюлози: [C6H7O2(OH)3]n +3nCH3COOH → [C6H7O2(OCOCH3)3]n + 3nH2O. триацетатцелюлоза У вигляді бавовнику, льону, прядива целюлоза йде на виготовлення тканин – бавовняних, льняних. Великі кількості її витрачаються на виготовлення паперу. Хімічно переробляючи целюлозу, виробляють кілька видів штучного шовку. Гепари́н (от др.-греч. ἧπαρ — печень) — кислый серосодержащий гликозаминогликан; впервые выделен из печени. В клинической практике известен как прямой антикоагулянт, то есть как вещество, препятствующее свёртыванию крови. Применяется для профилактики и терапии тромбоэмболических заболеваний, при операциях на сердце и кровеносных сосудах, для поддержания жидкого состояния крови в аппаратах искусственного кровообращения и гемодиализа, а также для предотвращения свертывания крови при лабораторных исследованиях. Синтезируется в тучных клетках, скопления которых находятся в органах животных, особенно в печени, лёгких, стенках сосудов. Гепарин относится к семейству гликозаминогликанов; его молекула представлена несколькими полисахаридными цепями, связанными с общим белковым ядром. Белковое ядро же включает в свой состав в основном остатки двух аминокислот: серина и глицина. Приблизительно две трети сериновых остатков как раз и связывается с полисахаридными цепями. В основе последних лежит цепочка из повторяющихся дисахаридов - α-D-глюкозамин и уроновая кислоты, соединенные 1-4 гликозидными связями. Большинство остатков α-D-глюкозамина сульфатировано по амино- и гидроксильной группе; небольшая часть аминогрупп м. б. ацетилирована. Звенья уроновой кислоты представляют собой остатки L-идуроновой кислоты (90%) или эпимерные остатки D-глюкуроновой кислоты (10%). Благодаря наличию значительного количества отрицательно заряженных сульфатных и карбоксильных групп, молекула гепарина представляет собой сильный природный полианион, способный к образованию комплексов со многими белковыми и синтетическими соединениями поликатионной природы, несущими суммарный положительный заряд. Длина полисахаридных цепей эндогенного гепарина может быть разной, а, значит, и молекулярная масса его тоже колеблется в широких пределах - от 3000 до 40000 дальтон. Средняя молекулярная масса «коммерческих» гепаринов, используемых в качестве лекарственных препаратов, колеблется в более узких пределах - от 12000 до 16000 дальтон. В последнее время была получена группа низкомолекулярных гепаринов, обладающая дополнительными свойствами. Часто количество гепарина измеряется в единицах действия (ЕД) по его физиологической активности - способности предотвращать свертывание плазмы крови. Одна единица действия равна 0,0077 мг международного стандарта гепарина (в 1 мг препарата 130 ЕД). Субстратами для биосинтеза гепарина являются глюкоза и неорганический фосфат. Присоединение сульфатных групп осуществляется после полимеризации, но некоторые ученые (Rice et al, 1967) предполагают, что сульфатирование происходит на более ранних этапах, то есть ещё на уровне низкомолекулярных предшественников. Среди ферментов участвующих в биосинтезе гепарина выделяют различные гликозилтрансферазы, сульфотрансферазы, эпимеразы, многие из которых выделены в чистом виде. Есть ряд фактов, указывающих на то, что биосинтез гепарина происходит в тучных клетках: Гепарин обнаружен в гранулах тучных клеток; В самих тучных клетках содержатся ферменты, участвующие в биосинтезе кислых гликозаминогликанов; Меченые предшественники включаются в гепарин гранул тучных клеток, но предварительно меченый гепарин в последних не обнаруживается. Последний факт опровергает также версию, где тучные клетки рассматриваются всего лишь в качестве накопителей гепарина.[3] Матрица для формирования гепарина - белок серглицин 56.Методи визначення концентрації глюкози. Методы определения глюкозы в крови подразделяют на три группы: редуктометрические, колориметрические и энзиматические. 1. Редуктометрические методы: титрометрический способ Хагедорна Йенсена основан на свойстве сахара восстанавливать при кипячении в щелочной среде железистосинеродистую и железосинеродистую соли калия. По степени этого восстановления титрометрически исследуют концентрацию сахара в крови. Важным преимуществом метода является дешевизна и возможность использования в любой лаборатории; основанные на восстановлении нитробензолов, например, пикриновой кислоты в пикраминовую; метод, основанный на способности глюкозы восстанавливать соли меди. Образующаяся одновалентная медь выступает в качестве промежуточного вещества. Окисляясь кислородом воздуха, она восстанавливает мышьяковомолибденовую или фосфорновольфрамовую кислоту, которые служат окончательным хромогеном. Однако следует иметь в виду, что методы этой группы дают завышенные результаты (примерно на 20 25%), так как в крови присутствует ряд соединений, не относящихся к углеводам, но обладающих восстановительными свойствами (мочевая кислота, глутатион, креатинин, аскорбиновая кислота); 2. Колориметрические методы. К ним относятся: метод Сомоджи — реакция восстановления меди, находящейся в составе меднотартронового реактива, до закиси меди. Метод трудоемок, многостадиен, неспецифичен и в настоящее время практически не используется; метод Фолина Ву — реакция восстановления тартрата меди в закись. Метод прост, недостатком является отсутствие строгой пропорциональности между интенсивностью получаемой окраски и концентрацией глюкозы; определение концентрации глюкозы по Моррису и Роэ — дегидратация глюкозы под действием серной кислоты и превращение ее в оксиметилфурфурол, который конденсируется с артроном в соединение синего цвета. Требует чистейших реактивов и четкого соблюдения постояной температуры реакции; ортотолуидиновый метод Гультмана в модификации Хиваринена-Никкила, состоящий в определении интенсивности окрашивания раствора, возникающего при взаимодействии ароматического амина ортотолуидина с альдегидной группой глюкозы в кислой среде. Этот способ точен и дает возможность более специфичного определения содержания глюкозы. анилиновый метод, сохраняет чувствительность ортотолуидинового метода, но еще более специфичен. 3. Ферментативные методы: основанный на гексокиназной реакции. Глюкоза под действием гексокиназы фосфорилируется за счет АТФ, образовавшийся Гл 6 Ф в присутствии дегидрогеназы восстанавливает НАДФ. Количество последнего определяют по увеличению светопоглощения в ультрафиолетовой области. Метод слишком дорогостоящий для практических лабораторий. основанные на окислении глюкозы до глюкуроновой кислоты с помощью фермента глюкозооксидазы и образовании в ходе реакции перекиси водорода, которая (в разных модификациях): ◊ определяется химическим путем; ◊ при участии пероксидазы окисляет бесцветный ортотолидин, превращая его в окрашенное соединение зелено голубого цвета, прямолинейность зависимости окраски от концентрации глюкозы сохраняется в диапазоне от 1,1 до 22 ммоль/л; ◊ в присутствии фенола при участии пероксидазы окисляет 4 аминоантипирин в окрашенное соединение розово-малинового цвета; ◊ в присутствии ионов меди окисляет фенолфталин до фенолфталеина, который в щелочной среде окрашен в красный цвет. 4. Электрохимические методы, в которых используются электроды, содержащие иммобилизованные ферменты, в частности, глюкозооксидазу. Реакция регистрируется по количеству образованной перекиси водорода или по убыли кислорода, израсходованного на окисление глюкозы. 5. Диагностические полоски, использующие глюкозооксидазно пероксидазную реакцию и производные бензидина в качестве хромогена. В качестве унифицированных принято три метода: титрометрический метод Хаггедорна-Йенсена, ортотолуидиновый метод и глюкозооксидазный метод с окислением о толидина. | ||||||||
