ШПОРЫ ОХТ. Цели и задачи курса Общая химическая технология Объект изучения курса
 Скачать 3.94 Mb. Скачать 3.94 Mb.
|
|
48. Технологические характеристики твердых катализаторов. Катализаторы очень специфичны по отношению к различным химическим реакциям. Эту специфичность объясняют рядом энергетических и геометрических факторов, в результате влияния которых данный катализатор воздействует на скорость только одной реакции или очень узкой группы реакций. Твердые катализаторы - высокопористые вещества с развитой внутренней поверхностью, характеризующихся определенной пористой и кристаллической структурой, активностью, селективностью и рядом других технологических характеристик. Некоторые характеристики твердых катализаторов.
Катализаторы сравнивают по скорости реакции, по степени превращения реагентов, по количеству реагентов, вступающих во взаимодействие в единицу времени на единице поверхности катализатора (по производительности или напряженности катализатора) и т.п .Если каталитическая реакция имеет такой же порядок что и некаталитическая, то есть их константа скоростиk` иk - имеют одинаковые единицы измерения, то активность А катализатора можно определить, как отношение констант: (3), где 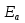 и и 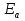 – энергии активации каталитической и некаталитической реакций соответственно. Из уравнения(3) следует, что активность тем выше, чем больше снижается энергия активации в присутствии катализатора. – энергии активации каталитической и некаталитической реакций соответственно. Из уравнения(3) следует, что активность тем выше, чем больше снижается энергия активации в присутствии катализатора.
А R 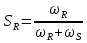 S последовательная схема А RS 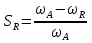 Интегральная селективность: 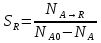 , ,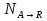 - количество А превратившегося в R - количество А превратившегося в R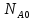 - исходное количество А - исходное количество А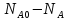 - общее количество А превратившегося при реакции. - общее количество А превратившегося при реакции.Селективность зависит не только от выбранного катализатора, но и от условий проведения процесса, от области протекания гетерогенно-каталитического процесса (кинетической, диффузионной) и т.д.
Важным свойством катализатора является пористая структура, которая характеризуется размерами и формой пор, пористостью (отношением свободного объема пор к общему объему), удельной поверхностью катализатора (то есть приходящейся на единицу массы или объема). Важную роль играет доступность поверхности катализатора для реагирующих газов. Чем больше для каждого данного катализатора поверхность, доступная для реагирующего газа, тем выше скорость расходования реагентов в единицу времени при использовании того же количества катализатора. Скорость превращения реагентов в конечные продукты может уменьшаться вследствие затруднения диффузии внутри пор. Большое значение имеет кристаллическая структура катализаторов. Различные кристаллические модификации одного и того же вещества могут обладать сильно отличающейся каталитической активностью
Часто введение очень небольшого количества (долей процента) какой-либо посторонней добавки к основному катализатору приводит либо к резкому повышению его активности, либо, наоборот, к снижению активности на несколько порядков. Практическому использованию каталитических процессов часто препятствует снижение активности катализатора при воздействии на него веществ, называемых каталитическими ядами. Каталитические яды блокируют активные центры, образуя с ними поверхностные химические соединения .Отравление бывает обратимым и необратимым. При обратимом отравлении активность катализатора постепенно восстанавливается. При необратимом отравлении активность восстановить не удается. С целью удлинения срока службы катализатора предусматривают тщательную очистку реагирующих веществ от примесей, являющихся каталитическими ядами. В ряде случаев катализатор отравляется побочными продуктами реакции. 49. Основные стадии и кинетические особенности гетерогенно-каталитических процессов. Гетерогенно-каталитическая реакция на поверхности твердого катализатора - это сложный многостадийный процесс. Наблюдаемая общая скорость каталитической реакции зависит от относительных скоростей нескольких различных по своей физической и химической природе стадий. На рисунке дана схема и структура гетерогенно-каталитического процесса: Пс К – катализатор, П- пора катализатора 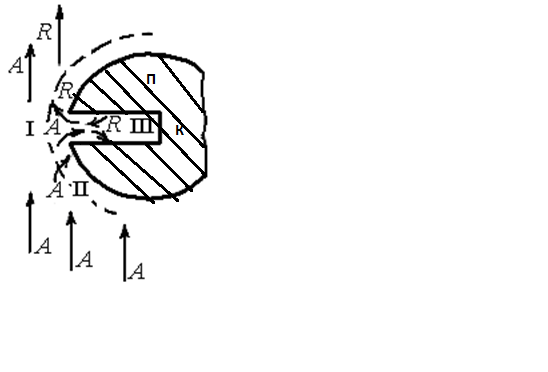 Пс - пограничный слой, А- поток исходного реагента,R-продукт реакции I, II, III, IV- этапы процесса Сначала реагенты диффундируют из газового объема А через пограничный слой Пс к наружной поверхности частицы катализатора К (этап I); Затем проникают в его поры П (этап II),при движении в которых на их поверхности протекает реакция (этап III). Продукты R удаляются обратным путем (этап IV). Основные стадии процесса взаимодействия газообразного реагента с зерном пористого катализатора 1 стадия (стадией внешней диффузии)– диффузия газообразного реагента А из основного потока к внешней поверхности зерна катализатора К через пограничный слой Пс, в котором концентрация А ниже, а концентрация продукта R выше, чем в основном потоке. 2 стадия(стадией внутренней диффузии) Основная часть молекул газообразного реагента А диффундирует внутри пор катализатора К (стадия внутренней диффузии).Скорость диффузии молекул через пористую среду во много раз меньше скорости их поступательного движения. Во время прохождения через катализатор молекулы сталкиваются со стенками пор и с другими молекулами, что приводит к беспорядочному их движению. 3 стадия. Молекулы реагента адсорбируются на поверхности катализатора. Адсорбция-это явление концентрирования вещества (адсорбента) из объема фаз на поверхности раздела между ними, например, из газа или раствора на поверхности или в объеме микропористого тела(адсорбента) или на поверхности жидкости. Различают физическую адсорбацию и темосорбацию в зависимости от того, какова природа сил, вызывающих это концентрирование молекул адсорбата на поверхности раздела фаз. При протекании каталитических процессов основная роль принадлежит хемосорбации или активированной адсорбации, результатом которого является образование активированного комплекса адсорбации -неустойчивого промежуточного соединения между реагентом и катализатором. 4 стадия. поверхностная химическая реакция, которая заключается либо в перегруппировке активированного комплекса адсорбации, либо во взаимодействии одного адсорбированного реагента с молекулами другого реагента. Механизм этой реакции может быть различным; от него зависит вид кинетического уравнения. В результате поверхностной реакции образуется адсорбированный продукт. 5 стадия. десорбция продукта с поверхности катализатора.На этом этапе также проявляются специфические свойства катализатора: энергия связи адсорбированного продукта и адсорбента должна быть такой, чтобы десорбция в объем не вызывала затруднений. Стадии 3,4,5 являются центральными в ходе каталитического процесса. Суммарно их можно рассматривать как поверхностную химическую реакцию. Эти стадии могут протекать одновременно с предыдущими- диффузионными стадиями - причем как на внешней поверхности зерна катализатора, так и, в основном на внутренней поверхности пор. 6 стадия. Десорбированные газообразные продукты диффундируют из пор к внешней поверхности катализатора (обратная внутренняя диффузия). 7 стадия. Газообразные продукты диффундируют от поверхности катализатора в газовый поток через пограничную пленку, окружающую зерно катализатора. Кинетическое уравнение контактного процесса, проходящего в изотермических условиях очень сложное. Считается, что одна из стадий оказывает основное сопротивление и лимитирует скорость процесса. Факторы, влияющие на гетерогенные каталитические процессы:
Для «медленных» химических реакций полезной оказывается практически вся внутренняя поверхность катализатора. В случае «быстрых» реакций на очень активном катализаторе реагирующие вещества превращаются в конечные продукты еще до того, как проникают в глубь пор.В зависимости от соотношения интенсивности двух параллельно протекающих процессов: диффузии в поры и химической реакции, внутренняя поверхность катализатора используется с большей или меньшей эффективностью.
Количественно эффективность использования поверхности катализатора оценивают коэффициентом эффективности – Е- отношение средней скорости расходования реагента в порах катализатора к максимальной скорости расходования, которая имела бы место в отсутствие тормозящего влияния внутренней диффузии.
4.Влияние характера адсорбции на кинетику гетерогенного катализа. Для расчета каталитического реактора необходимо иметь конкретный вид кинетического уравнения, то есть зависимость скорости процесса от концентрации реагентов, температуры и т. д. При аналогии с гомогенными системами скорость каталитической реакции зависит от поверхностных концентраций адсорбированных частиц. На практике известны не поверхностные, а объёмные концентрации компонентов в газовой фазе или их парциальные давления. Поэтому обычно кинетические уравнения гетерогенно-каталитических реакций представляют в виде зависимости скорости от концентраций реагентов в газовой фазе (или парциальных давлений. 50. Основные факторы, влияющие на гетерогенные и католитические процессы. 1.Влияние массопередачи в порах. Каталитическая рекция протекает в основном на пов-ти пор катализатора,т.к внутренняя пов-ть катализатора на несколько пор больше внешней. Поэтому условия транспорта реагентов в поры оказывают существенное влияние на протекание реакции. Если диффузия в порах катализатора протекает быстрее реакция то вся доступная поверхность катализатора принимает участие в реакции. Наблюдается установившийся диффузионный поток, перемещающий молекулы внутрь частиц катализатора и выводящий из них образующиеся молекулы. Для "медленных" химических реакций полезной оказывается практически вся внутренняя поверхность катализатора, в случае "быстрых" реакций вещества превращаются в конечные продукты еще до того, как проникают в глубь, т.е. реакция протекает почти целиком на внешней поверхности катализатора. 2.Эффективность использования внутренней поверхности катализатора. Эффективность использования поверхности катализатора зависит от условий проведения процесса - t-ры, давления и т.д., влияющих на константу скорости реакции и коэффициент диффузии. Количественно эффективность использования поверхности катализатора оценивают коэффициентом эффективности E- отношением средней скорости расходования реагента в порах катализатора к максимальной скорости расходования, которая имела бы место в отсутствие тормозящего влияния внутренней диффузии. 3.Стадия адсорбции. При физической адсорбции равновесие между адсорбированными частицами и частицами в газовой фазе устанавливается быстро. Физ.адсорбция вызывается теми же силами межмолекулярного взаимодействия ,что и конденсация паров. Эти силы неспецифичны. Теплота физ. адсорбции =10-40кДж\моль. Физ.адсорбция играет существенную роль тогда, когда t-ра 2 раза ниже критической, т.е.когда газ становится паром. хемосорбция отличается от физ.адсорбции значительно большей специфичностью ,т.е.зависимостью от природы адсорбента и адсорбата. Теплота хемосорбции близка к теплоте хим.реакции. В этом случае десорбция может сопровождаться хим.реакциями, хемосорбция протекает сравнительно медленно, со скоростью определяемой наличием активационного барьера(активированная адсорбция)Процесс хемосорбции состоит из 2 стадий: 1)быстрая физическая адсорбция; 2)медленная хим.реакция с поверхностью твердого тела. При низких t-рах скорость хемосорбции мала и наблюдается только физ.адсорбция. При высоких t-рах физ.адсорбция почти незаметно и происходит лишь хемосорбция. Скорость гетероенно-каталитической реакций пропорционально поверхности концнтрациям адсорбированных малекул. О поверхностных концентрациях реагентов можно судить по равновесному распределению молекул адсорбата между поверхностью твердого тела и газовой фазой. Равновесное распределение оценивают по изотерме адсорбции, показывающий, каким образом адсорбированного вещества зависит от равновесного парциального давления данного газапри постоянной t-ре. 4.влияние характера адсорбции на кинетику гетерогенного катализа.Для расчета каталитического реактора необходимо иметь конкретный вид кинетического уравнения ,т.е.зависимость скорости процесса от концентрации реагентов, t-ры и т.д. Скорость каталитической реакции зависит от поверхностных концентраций адсорбированных частиц. На практике известны не поверхностные, а объемные концентрации компонентов в газовой фазе или их прациальное давление. Поэтому кинетические уравнения гетероенно-каталитических реакций представляют в виде зависимости скорости от концентраций реагентов в газовой фазе(или парциальных давлений) 51. Тепловые явления в хим.процессе: гетерогенный процесса поверхности раздела фаз. До сих пор предметом рассмотрения являлись изотермические процессы (Т=constво всем объеме реактора). Химические реакции сопровождаются выделением или поглощением тепла. Это приводит к изменению температуры в месте протекания реакции и, соответственно к изменению скорости превращения. В гетерогенном химическом процессе тепловой эффект реакции приводит к возникновению градиента температуры и явлений переноса в месте протекания реакции. Рассмотрим случаи наиболее значимого влияния тепловых явлений на протекание химического процесса. Гетерогенный процесс на поверхности раздела фаз. Рассмотрим гетерогенные процессы, протекающие в системах «газ – полностью реагирующие твердые» (модель «сжимающаяся сфера») на непористом зерне катализатора, имеющие разные механизмы и одинаковые стадии взаимодействия газообразного компонента с поверхностью твердой частицы. Через пограничный слой у поверхности твердой частицы происходит не только массоперенос, но и отвод (подвод) теплоты, основные параметры которого – коэффициент теплопередачи между поверхностью зерна и потоком – α3 и скоростью теплообмена - α3 (Tn– T0), где Tn,T0 – температура на поверхности и в объеме частицы, и потока соответственно. Скорость тепловыделения, вследствие протекания реакции на поверхности равна – Qpr( Cn, Tn ), где Qp– тепловой эффект реакции , r – ее скорость, Сn – концентрация газообразного реагента у поверхности частиц. В стационарном режиме. α3 (Tn– T0) = Qpr( Cn, Tn) (1) Математическая модель реакционного взаимодействия газа с поверхностью частицы описывается уравнением: - β3 (С0 – Сn) = W(Cn), (2) Где β3 – коэффициент мАссообмена у поверхности зерна ( 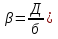 С0 – концентрация газообразного реагента в потоке. W(Cn)= W2 – скорость превращения газообразного реагента на единице поверхности твердой частицы. - β3 (С0 – Сn) = W1 – поток газообразного реагента к единице поверхности частицы: т.к. в стационарном режиме W1=W2то отсюда получаем выражение (2). Использую взаимосвязь скорости превращения вещества W и скорости реакции r: W(C,T) = -r(C,T), (3) Запишем уравнение (2) для взаимодействия вещества с поверхностью в виде: β3 (С0 – Сn) = r (Cn,Tn) (4) Выражение (1) и (4) – математическая модель процесса с учетом тепловыделения реакции.Разделив уравнение (1) на (4) получим соотношение между разогревом поверхности (Tn– T0) и превращением на ней исходного компонента (С0 – Сn): α3 (Tn– T0) =Qp β3 (С0 – Сn), (5) где Сnи С0 – концентрация исходного газообразного компонента на поверхности и в объеме соответственно. Механизм массо- и теплообмена между поверхностью и потоком одинаковы – это молекулярный перенос через пограничный слой с помощью диффузии и теплопроводности. Отсюда, использую теорию подобия, можно показать, что между коэффициентом массообмена у поверхности зерна β3и коэффициентом теплопередачи между поверхностью зерна и потоком α3 существует соотношение: β3 = α3 / Ср, (6) где Ср – теплоемкость газа при р=const. Концентрацию вещества на поверхности зерна выразим через степень его превращения: xn= 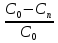 , или (С0 – Сn)= xn С0 . , или (С0 – Сn)= xn С0 .Используя соотношение (6) и последнее выражение (С0 – Сn)= xn С0 уравнение (5) приведет к виду: Tn – T0 = 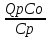 xn (7) Входящее в это уравнение Qp– выделившаяся при превращении единици качества исходного реагента, а произведение Qp·C0=qp– теплота, которая выделилась в единице количества реакционной смеси, содержащего С0этого реагента. Чтобы данную реакционную смесь нагреть на ∆Т градусов надо qT=∆TСртеплоты.В случае адиабатического процесса (когда qp=qT), смесь разогреется на ∆Tад= xn (7) Входящее в это уравнение Qp– выделившаяся при превращении единици качества исходного реагента, а произведение Qp·C0=qp– теплота, которая выделилась в единице количества реакционной смеси, содержащего С0этого реагента. Чтобы данную реакционную смесь нагреть на ∆Т градусов надо qT=∆TСртеплоты.В случае адиабатического процесса (когда qp=qT), смесь разогреется на ∆Tад= 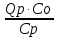 , градусов. , градусов.Эта величина в технологии называется адиабатическим разогревом: ∆Tад= 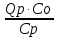 , (8) , (8)Адиабатический разогрев определяет изменение температуры реакционной смеси в ходе протекания реакции адиабатически до конца. Величина ∆Tад – важная характеристика химического процесса, её характерная величина для промышленных реакторов несколько сотен градусов. Подставив в уравнение (7) уравнение (8) получим Tn –T0 = ∆Tад·xn (9) Это уравнение показывает изменение температуры поверхности твердой частицы, равное адиабатическому разогреву при установившейся степени превращения вещества на поверхности xn. Если протекает эндотермическая реакция (Qp<0), температура поверхности Tn будет меньше температуры реакционной смеси, то есть Tn-T0<0. |

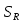 . Дифференциальная селективность по R – отношение скорости превращения исходного вещества в определенный продукт к общей скорости его превращения.
. Дифференциальная селективность по R – отношение скорости превращения исходного вещества в определенный продукт к общей скорости его превращения.