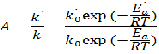ШПОРЫ ОХТ. Цели и задачи курса Общая химическая технология Объект изучения курса
 Скачать 3.94 Mb. Скачать 3.94 Mb.
|
Цель курса - знакомство с химическим производством –сложной химико –технологической системой, а также рассмотрение общих проблем анализы и синтеза химических производств. Задачи курса – общее знакомство с химическим производством, его структурой и компонентами; изучение основ химических производств и реакторов; освоение общих методов анализа и синтеза химического производства как химико- технологической системы; знакомство с некоторыми конкретными химическими производствами, на примере которых предметно демонстрируется теоретические положения курса. Значительное место уделяется физико- химическим и технологическим аспектам анализа процессов в химическом производстве, в химических реактора и организации химико- технологических процессов. Объектом изучения в курсе являются химические производство, как система взаимосвязанных процесстов.
Технология –совокупность знаний о способах и средствах обработки материалов, подразделяется на механическую, изучающую обработку материалов без изменения их состава и химическую, изучающую обработку и переработку материалов, связанную главным образом с изменением их состава. Химическая технология – естественно прикладная наука о способах и процессах производство продуктов, осуществляется с участием химических превращений, технически, экономически и социально целесообразным путем. Химическая технология как наука имеет: -Объект ( предмет) изучения – химическое производство ( способы и процессы переработки исходных веществ в полезные продукты). -Цель изучения – создание целесообразных способов производства необходимых человеку продуктов. -Методы исследования- эксперимент, моделирование и системный анализ. Как естественная наука химическая технология изучает материальное явления и объекты.
Химическую технологию классифицируют по различным признакам: по характеру технологических процессов; по используемому сырью или потребительским продуктом и т.д. По отраслям химическую технологию разделяют на две группы: А. Неорганическая химическая технология: 1. Основные неорганический синтез (пр-во кислой, щелочной и т.д.) 2. Тонкий неорганический синтез (пр-во реактивов редких элементов, лекарств и т.д.) 3. Ядерно- химическая технология (пр-во мат- ов ядерно- химического комплекса, радиоактивных препаратов и т.д) 4. Металлургия ( черная и цветная) 5. Технология электрохимических производств; 6. Технология силикатов Б. Органическая химическая технология. 1. Переработка нефти и газа (отчистка, первичн.разделения) 2. Нефтехимический синтез (пр-во оргинич.продуктов) 3. Основной органический синтез (пр-во органич.производств) 4. Биотехнология 5. Тонкий органический синтез (препараты, реактивы, лекарства) 6. Высокомолекулярная технология (полимеры, пластмассы) 7. Технология переработки растительного и животного сырья.
Химическое производство- совокупность процессов и операций переработки сырья в необходимые продукты с использование химических превращений осуществляемых в предназначенных для этого машинах и аппаратах. Основное назначение химического производства- получение продукта, при этом химического производства яв- ся многофункциональным, то есть включает в себя подготовку сырья; его переработку; выделения основного продукта; санитарную очистку и утилизацию отходов; подготовку вспомогательных материалов и водоподготовку; энергосистему; систему правления. Требования к химическому производству. 1.Получение и производство необходимого продукта. 2.Экологическая безопасность. 3.Безопасность и надежность эксплуатации оборудования. 4.Максимальное использование сырья и энергии. 5.Максимальная производительность труда.
1.Подготовка сырья –включает предварительную обработку сырья ( измельчение, отчистка от примесей и т.д.) 2.Переработку сырья- в результате образуется основной продукт производства 3.Выделение основного продукта- из образовавшегося в результате переработки сырья смол. 4.Санитарная счистка и утилизация отходов- перевод токсичных составляющих в безвредные; выделение полезных веществ. 5.Энергетическая система- обеспечивает распределение энергии по стадиям производства и ее возвращение после использования в проработке сырья. 6.Вспомогательные материалы- для обеспечения протекающих процессов (сорбенты, регуляторы кислотности и т.д.) 7.Водоподготовка- растворитель, теплоноситель и т.д. 8.Система управления- обеспечивает контроль за состояние производства, защиту от аварии и т.д. (АСУТП)
Переменные компоненты- постоянно потребляются или образуются в производстве; к ним относят: 1-сырье поступающих на ререработку; 2-вспомогательные материалы; 3-продукты- основной и дополнительной, как результат переработки сырья; 4-отходы производства; 5-энергия, обеспечивающая функционирование производства. Постоянные компоненты- заключается в производство (оборудование, конструкции) или участвуют в нем ( персонал) на весь или почти весь срок существования производства. Включают: 1-аппаратуру (аппараты, машины, емкости, трубопроводы и т.д.); 2-устройство контроля и управления; 3-стоительные конструкции (здания, сооружения); 4-обслуживающий персонал (рабочие; и т.д.) В компоненты производства не входят элементы инфраструктуры, как не участвующие непосредственно в производстве, не необходимые для его функционирования.
Состав химического производства обеспечивают его функционирование как производственной единицы. В него входит: 1-собственно химическое производство; 2-хранилища сырья, продуктов и других материалов; 3-система организации транспортировки сырья, продуктов, вспомогательных материалов, промежуточных веществ, отходов; 4-дополнительные здания и сооружения. 5-обслуживающий персонал производственного подразделения. 6-система управления, обеспечения и безопасности.
Совокупность операций и процессов переработки сырья в продукты называют технологическим процессом. Химико- технологический процесс- последовательность химических и физико- химических процессов целенаправленной переработки исходных веществ в продукт. В совокупном химико- технологическом процессе выделяют несколько видов отдельных процессов и операций, для проведения которых предназначены соответствующие аппараты им машин. Их подразделяют на основные и вспомогательные. Основные: 1.Механические и гидрохимические процессы ( перемен вращение, деформация и т.д.) 2.Теплообменные процессы. (нагрев, плавление, испарение) 3.Химические процессы (изменение хим. состава веществ) Вспомогательные процессы: 1.Энергетические процессы (преобразование энергии)тепло --> энергия 2.Информационно- управляющие процессы (обработка информации, синтез управляющих сигналов) В ходе химико- технологического процесса осуществляют подготовку исходных реагентов к проведению химических реакций, путем перевода их в наиболее реакционно способное состояние и затем, в результате химической реакции из подготовленных исходных реагентов получают смесь продуктов (целевых и побочных) и непрореагировавших веществ, которую затем разделяют.
Технологическим режимом- называют совокупность параметров, определяющих условия работы аппарата или системы аппаратов. Создавая технологический процесс, необходимо помнить что конечной целью является оптимальное решение с технико-экономической точки зрения. В этой связи оптимальное условие веления химико- технологического процесса- это сочетание основных параметров (температуры, давления, состава исходной реакционной смеси, катализатор и т.д.), позволяющие получить наибольший выход продукта с высокой скоростью и обеспечить наименьшую себе стоимость. Единичным процессы протекают в различных аппаратах, которые соединены в технологическую схему процесса.
В химической технологии используют различные виды классификации химических реакций. 1.По фазовому составу: гомогенные и гетерогенные. Различают двухфазные системы: «г-ж», «г-г», «ж-т», «ж-ж», «т-т» и различные варианты трехфазных систем. 2.По механизму осуществления реакции: простые (одностадийные) и сложные (многостадийные) реакции: параллельные, последовательные, последовательно- параллельные. 3.По молекулярности: сколько молекул участвуют в элементарном акте (1,2 или3) 4.По порядку: по данному веществу и общему или суммарному порядку реакции. Порядок реакции по данному веществу- показатель степени при концентрации этого вещества в кинетическом уравнении: r=kcana =cnв Величина na+nв+… - называется общим или суммарным порядком реакции. 5.По присутствии катализатора: каталитические и некаталитические. 6.По тепловому эффекту: экзо- и эндотермические.
Технические показатели- определяют качество химико- технологического процесса. 1.Производительность (мощность) производства- количество получаемого продукта, или количество перерабатываемого сырья в единицу времени: П=G/t П-производительность; G- кол-во полученного продукта или перерабатываемого сырья за время t. 2.Расходный коэффициент- показывает количество затраченного сырья, материалов или энергии на производство единицы продукта. Он не отражает эффективность использования расходуемых компонентов. 3.Выход продукта- отношение реального получаемого количества продукта из используемого сырья к максимальному количеству продукта, которая теоретически можно получить из того же количества сырья. 4.Интенсивность процесса- количество перерабатываемого сырья или обрабатываемого сырья или образуемого продукта в единице объема времени. Характеризует интенсивность процесса в аппарате и совершенство его организации. 5.Удельные капитальные затраты- затраты на оборудование, отнесенные к единице его производительности. Этот показатель характеризует эффективность организации процесса в отдельных аппаратах и в производстве в целом, совершенство используемых конструкций. 6.Качество продукта- определяет его потребительские свойства и товарную ценность. Оценивается разными характеристиками такими как: содержание (состав и количество) примесей; физические и химические показатели; внешний вид и размеры; цвет; запах и прочее.
Экономические показатели определяют экономическую эффективность производства. Они включают: 1.Себестоимость продукции- суммарные затраты на получение единицы продукции. Общая структура себестоимости С: C=(∑ЦiGi+k3k+3t)/Gn где Цi и Gi – соответственно цена и количество израсходованного сырья, энергии, материалов на производства продукта в количестве Gn; Зк- капитальные затраты; k- коэффициент окупаемости капитальных затрат (исходя, отнесенная на время производства продукта. В среднем k=0,15 в расчете на годовую производимость); Зт– оплаты труда. 2.Производительность труда- количество продукции, производимой в единицу времени в пересчете на одного работающего характеризует эффективность производства относительно затрат труда. Экономические показатели рассчитывают на основе технических показателей, причем технические показатели (производительность, расходные коэффициенты, удельные капитальные затраты), которые можно представить в денежном выражении называют техноэкономическим показателем.
Эксплуатационные показатели- определяют влияние отклонений от регламентированных условий и состояний, возникающих при работе производства, на показатели процесса, возможность управления им. Они включают: 1.Надежность-характеризует среднее время безаварийной работы, либо число аварийных остановок оборудования или производства в целом за определенный отрезок времени. Этот показатель зависит от качества используемого оборудования и правильности его эксплуатации и обслуживания. 2.Безопасность функционирования- вероятность нарушений приводящих к нанесению вреда или ущерба обслуживающему персоналу, оборудованию, окружающей среде и населению. 3.Чувствительность к нарушениям режима и изменению условий эксплуатации- определяется отношением изменения эксплуатационных показателей к этим отклонениям. 4.Управляемость и регулируемость- характеризуют возможность поддержания показателей процесса в допустимых пределах. Эксплуатационные показатели определяют величину допустимых изменений условий процесса и управляющих параметров, обеспечивающих процесса и управляющих параметров, обеспечивающих поддержание показателей процесса в допустимых условиях. Они так же учитывают взаимовлияние управляющих параметров и сложность управления.
Социальные показатели- определяют комфортность работы на данном производстве и его влияние на окружающую среду.Они включают: 1.Безвредность обслуживания- оцениваются сопоставлением санитарно- гигиенических условий для обслуживающего персонала с соответствующими нормами по загазованности, запыленного, уровню шума и т.д. 2.Степень автоматизации и механизации- определяется ручного и тяжелого труда в производстве. 3.Экологическая безопасность- степень воздействия производства на окружающую среду и экологическую обстановку в регионе.
1 Физико- химические признаки 1.1.Тип химической реакции 1.1.1.прямое химическое взаимодействие. 1.1.2.с химическим воздействием (каталитическая реакция). 1.1.2.с физическим воздействием (свет, электрич.ток и т.д) 1.2.Термодинамические показатели 1.2.1.тепловой эффект (эндо и экзотермический процесс) 1.2.2.обратимость (необратимая и обратимая реакция) 1.3.Кинетические характеристики 1.3.1 Схема превращения (простая реакция; сложная реакция: параллельная схема; последовательная схема; включающая обе схемы) 1.3.2.Кинетическая модель (виды кинетической модели) 2.Физические признаки 2.1.Фазовый состав реагентов 2.1.1.число участвующих фаз с реагентами (однофазный процесс; многофазный процесс. 2.1.2.состояние фаз (газ; жидкость; твердое). Сочетание разных признаков проявляется в особенностях, свойствах химического процесса.
Стехиометрические уравнения показывают в каких соотношениях в-ва вступают в химическое взаимодействие. Общий вид стехиометрического уравнения: VAA+VAB+…=VRR+VSS+…, (1) Где A,B- исходные вещества; R,S- продукты: VA VR VR VS-стехиометрические коэффициенты. Стехиометрические уравнения (1) устанавливает соотношение между количеством превратившихся веществ: (NAO-NA)/VA=(NBO-NB)/VB=(NR-NRо)/VR=(NS-NSО)/VS (2) Где NAO,NBO,NRO,NSO- исходное кол-во компонентов A,B,R,S [моль]; NA,NB,NR,NS- кол-во тех же компонентов после превращения[моль]; (NAO-NA),(NBO-NB)-кол-во превратившихся(израсходованных) в-в A и B; (NR-NRO), (NS-NSO)- кол-во образовавшихся продуктов R и S [моль]. Поскольку стехиометрическое уравнение устанавливает соотношение между количеством превратившихся в-в оно является балансовым и предназначено для расчета состава реагирующей смеси после химического превращения, то есть для расчета материального баланса реакционных процессов.
Если превращение протекает по нескольким направлениям, то стехиометрических уравнений всегда (1) VA A+VB B+….=VR R+VR S (1) будет несколько. Простая реакция описывается одним стехиометрическим уравнением. Сложная реакция – несколькими. Пример простой реакции-окисление диоксида серы: SO2 + 0,5O2=SO3-одна схема (направления) Пример сложной реакции -окисление метанола: Первая схема: 2CH3OH+O2=2CH2O+2H2O Вторая схема: 2CH3OH+3O2=2CO2+4H2O Здесь вид превращения определяется количеством стехиометрических уравнений (т.е. количеством схем превращения) Однако, простыми и сложными реакции могут быть также по механизму их протекания (одностадийный и многостадийные) С этой точки зрения окисление диоксида серы-многостадийная реакция , сложная по механизму , но простая по схеме превращения. Стехиометрические уравнения показывают соотношения количеств реагирующих в-в, но не отвечают действительно протекающим взаимодействиям, хотя и могут совпадать, например, для простых по механизму реакции.
Стехиометрическое уранение: VaA+VbB+….= VRR+VsS+…. Как уравнение , связывающее количество прореагировавших веществ, для простой по схеме превращения реакции можно представить в алгебраической форме: 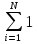 ViAi=0 ViAi=0(1) Vi<0 для веществ которые расходуются и Vi>0 – которые образуются. Ai-вещества участвующие в реакции Vi- стехиометрический коэффициент вещества Если в реакции ионной смеси присутствуют инертные в-ва то для них Vi=0. Для сложной реакции стехиометрические уравнения в алгебраической форме имеют вид:… 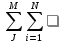 ViAi=0, j=1,2 (2) ViAi=0, j=1,2 (2)j- индекс(номер) стехиометрического уравнения . Vij- стехиометрический коэффициент i-го в-ва в j-м уравнении. Vij=0-если вещество не входит в j-е уравнение. Из уравнений (1) получают соотношения между кол-во превратившихся в-в (N1-N10)/V1=(N2-N20)/V2=……..=(Ni-Ni0)/V1=const (3) N10… исходное кол-во компонентов [моль] N1… кол-во компонентов после превращения [моль] Исходные компоненты убывают (Ni-Nio)<0, продукты образуются ( Ni-Nio)>0
Число стехиометрических уравнений Т.к. стехиометрические уравнения-уравнения алгебраические то их система должна быть определённой, т.е. число уравнений должно быть равно числу веществ. Для определения состава прореагировавших в-в необходимо следующее количество уравнений У. У=B-(Э-1) (1) Где B-число участвующих в превращении в-в исходных и конечных Э- число элементов из которых состоят эти в-ва. В ОВР соблюдается баланс по электронам, поэтому уравнение(1) принимает вид: У=В-Э (2) Уравнения для обменных (1) и окислит-восстановит (2) реакций определяют число стехиометрических уравнений, которые делают возможным расчёт состава прореагировавшей смеси. Однако следует учитывать, что в число Э могут входить не только химические элементы, но и устойчивые в реакции группы (радикалы). Это актуально, особенно в органической химии.
Система алгебраических уравнений имеет решение, если уравнения, входящие в нее линейно независимы и число уравнений равно числу неизвестных Исходя из этого: определения состава реагирующей смеси возможно в случае использования только стехиометрически независимых уравнений. Базисная система стехиометрических уравнений, однозначно и полно описывающая процесс, должна содержать число стехиометрически независимых уравнений, определяемое уравнениями: Y=B-(Э-1) (1) и Y=B-Э (2), Где Y- количество уравнений; B- число веществ; Э- число элементов. В этом случае принципиально не важно, какие уравнения использованы. Возможность выбора любых стехиометрических уравнений для расчета образующихся веществ позволяет для удобства использовать такие, в каждом из которых одно и тоже вещество является исходным. Используют систему уравнений, в левые части которых входит исходное вещество.
Степень превращения X отношение количества превратившегося исходного вещества (NO- N) к его первоначальному количеству NO например для А по реакции XA=NAO-NA/ NAO (1) гдеNA количество А после превращения. Выход Е продукта показывает долю всего вещества, при худящуюся на образование данного продукта например, для R: ER=NA→R/NAO (2) NA->R -это кол-во А превратившегося в R. Избирательность (селективность) S процесса показывает, какая доля превращающегося исходного вещества расходуется на образование заданного продукта. Например для R: SR=(NA→R)/(NAO-NA) (3) Из выражений (1), (2) и (3) можно получить ER=SR XA (4) Селективность процесса и выход продукта характеризуют эффективность химического процесса по использованию сырья получения нужного продукта.
Изменение химического состава реагирующей смеси приводит к изменению ее теплосодержания дэльта Нт, которое рассчитывают через энтальпии образования компонентов (дэльта Нт) обр (следствие из закона Гесса): ∆HT= 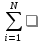 Vi(∆H)обрi (1) Vi(∆H)обрi (1)При этом необходимо помнить, что Qp=-дельтаНт (2) где Qp- тепловой эффект реакции [Дж]- термохимия, дэльта Нт – изменение энтальпии реакции [Дж] – гермодинамики. ∆HT<0;Qp>0-реакция экзотермическая; ∆HT>0;Qp<0-реакция эндотермическая Тепловой эффект реакции входит в запись термохимического уравнения, представляющего собой стехиометрическое уравнение с указанием его теплового эффекта: VAA+VBB+…..= VКК+Vss+…..+Qp(или ±∆H) Знание теплового эффекта реакции необходимо для определения тепловых явлений в технологического процесса. Количество выделившейся(поглощённой )теплоты qp зависит от колипревращенного вещества дельта N: qp=Qp∆NA/VA
Химический процесс процесс принципиально осуществим, если реакция протекает с уменьшением энергии Гиббса G. Возможность протекания реакции определяется из следующих условий: при ∆GT,P<0 протекании реакции возможно при ∆GT,P>0 протекании реакции невозможно при ∆GT,P=0 реакционная система находится в равновесии ,(1) Где дельта G,P – изменение энергии Гиббса при превращении исходных веществ в продукты при температуре T и давленииP. По уравнению ∆G0T,P= 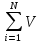 i(∆G0298)обрi i(∆G0298)обрiгде (∆G0298)обрi→стандартная энергия Гиббса образования исходных веществ и продуктов ( в справочниках дана) Использование условий (1) позволяет определить возможность получения желаемого продукта. Другое использование условий (1) – нахождение возможности предоставить протекания нежелательных реакций.
Химическое равновесие, при котором скорость прямой и обратной реакций равны определяют из условия дельтаGP,T=0, где дельтаGP,T – изменении энергии Гиббса при превращении исходных веществ в продукты при температуре T и давлении Р. Энергия Гиббса зависит от состава реакционной смеси по уравнениям: ∆GP,T=∆G0T+RTln 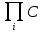 iVi iVi∆GP,T=∆G0T+RTln 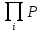 iVi (2) где iVi (2) где 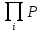 iVi ; iVi ;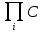 iVi - соответственно произведения концентрайии и парциальных давлений компонентов в степенях равных их стехиометрическим коэффициентам в уравнении реакции. iVi - соответственно произведения концентрайии и парциальных давлений компонентов в степенях равных их стехиометрическим коэффициентам в уравнении реакции.При химическом равновесии состав смеси и концентрация компонентов являются равновесными, т.к. дельтаGT0= дельтаНт0-ТдельтаSTo (3) и учитывая (1) выражение (2) можно записать следующим образом: ∆HT0-T∆S0T=-RTln 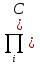 iVi)равн iVi)равн(4) индекс «равны» означает, что это равновесные концентрации. Т.о. KP= 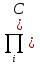 iVi)равн (5) есть константа равновесия с учетом(4) Kp=eхр(∆S0T /R)*exp(-∆H0T/RT) (6) выражение (6) справедливо для идеальных смесей. Для неидеальных смесей используют уравнение: iVi)равн (5) есть константа равновесия с учетом(4) Kp=eхр(∆S0T /R)*exp(-∆H0T/RT) (6) выражение (6) справедливо для идеальных смесей. Для неидеальных смесей используют уравнение: Kp=Kpo*exp(-∆H0T/RT)=Kpoexp(Qp/Aг) (7) где KPo-предэкспоненциальной множитель. Изменение хим равновесия достигают изменением внешних условий. Направленность влияния определяют принципом Ле Шателье: Если на систему, находящуюся в равновесии, оказывается воздействие, то в результате протекающих в ней процессов равновесие сместится в таком направлении, что оказанное воздействие уменьшается |