ШПОРЫ ОХТ. Цели и задачи курса Общая химическая технология Объект изучения курса
 Скачать 3.94 Mb. Скачать 3.94 Mb.
|
|
71. Неизотермический процесс в химическом реакторе. Температурный режим в проточном реакторе идеального смешения. Анализ процесса. Математическая модель процесса. Сi-Ci0/Ԏ=Wi(C, Т) (1) 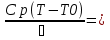 Qpr(c,Т)-Кt Fуд(Т-Тx) Qpr(c,Т)-Кt Fуд(Т-Тx)Тx – температура теплоносителя; Кt – коэффициент теплопередачи; Fуд= 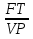 - удельная поверхность теплообмена (FT – площадь поверхности теплообмена; VP – объем реактора); - удельная поверхность теплообмена (FT – площадь поверхности теплообмена; VP – объем реактора);Ԏ= 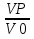 – условное время реакции (V0 – объем потока реагентов, входящих в реактор в единицу времени); Сp – теплоемкость; – условное время реакции (V0 – объем потока реагентов, входящих в реактор в единицу времени); Сp – теплоемкость;x= 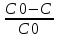 - степень превращения. - степень превращения.Используя выражения для адиабатического разогрева ∆Tад= 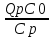 ; ;параметра теплоотвода B= 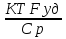 ; и отношения скорости реакции к исходной концентрации ; и отношения скорости реакции к исходной концентрации 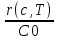 = r(x,Т) получим из (1): = r(x,Т) получим из (1):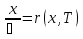 (2) (2) 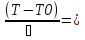 ∆Tад r(x,Т)-B(Т-Тx) ∆Tад r(x,Т)-B(Т-Тx) В адиабатическом режиме (B=0) получим: 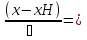 r(x,Т) (3) r(x,Т) (3) 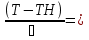 ∆Tад r(x,Т) ∆Tад r(x,Т)(xH – степень превращения на входе в реактор) С0 – начальная концентрация исходного компонента в непрореагировавшей смеси и CH – концентрация исходного компонента на входе в реактор не всегда одинаковы. Если в реактор подается частично прореагировавшая смесь xH≠0. Разделив второе уравнение на первое в (3) получим: (T – TH)  ∆Tад(x – xH) (4), отсюда, Температура и степень превращения в реакторе будут иметь ступенчатое распределение профили степени превращения x(Ԏ) и температуры T(Ԏ)представлены на рис 1а и 1б соответственно. ∆Tад(x – xH) (4), отсюда, Температура и степень превращения в реакторе будут иметь ступенчатое распределение профили степени превращения x(Ԏ) и температуры T(Ԏ)представлены на рис 1а и 1б соответственно.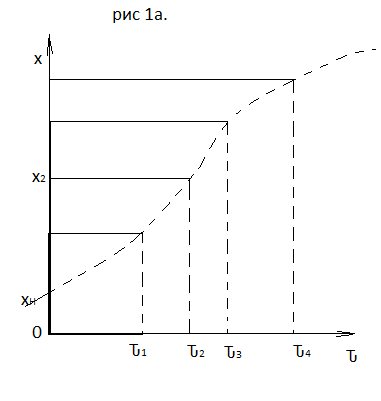 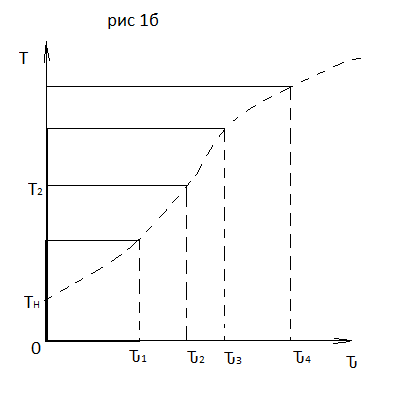 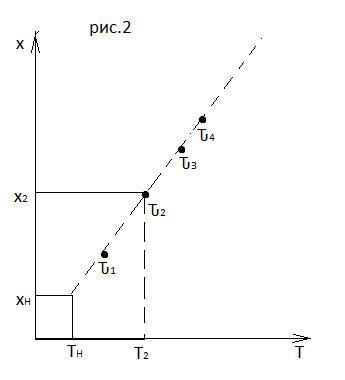 Кривые х(Ԏ) и Т(Ԏ) есть графическое отображение функции (4), и эти зависимости надо представлять, как набор значений x и Т устанавливаются в различных реакторах. В координатах «T – x» режим процесса в реакторе будет описываться линией, соединяющей две точки между исходным состоянием смеси при Ԏ, то есть последовательность точек при разных Ԏ будет лежать на прямой адиабаты T=TH+∆Tад(x – xH) (см.(4)), показанной на рис.2 штриховой линией. График «Т – х» для проточных реакторов ИС-н с различными значениями условного времени Ԏ (реакция экзотермическая) представлен на рис.2. 72. Неизотермический процесс в химическом реакторе. Температурный режим в проточном реакторе идеального смешения. Число стационарных режимов. Математическая модель процесса в адиабатическом режиме 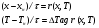 (1) (1) 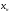 - степень превращения на входе в реактор. - степень превращения на входе в реактор.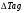 -адиабатический разогрев; -адиабатический разогрев; 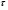 - условное время - условное времяПроанализируем решение системы (1) в случае протекания реакции первого порядка при 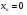 : : 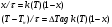 (2) (2)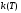 показывает, что константа скорости реакции зависит от температуры. показывает, что константа скорости реакции зависит от температуры.Перейдем от системы двух уравнений к одному, для чего:
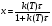 (3) (3)
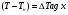 (4) (4)
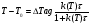 (5) (5)qtqp Левая часть уравнения (5) представляет собой теплоотвод (qt), а правая часть отвечает тепловыделению в результате протекания реакции (qp). Если заменить 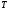 на на 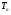 (температура на поверхности) и (температура на поверхности) и 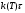 на на 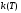 , где , где 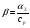 ( (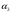 - коэффициент теплопередачи, - коэффициент теплопередачи, 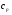 - теплоемкость), то уравнение (5) будет совпадать с уравнением, описывающим неизотермический процесс на поверхности твердой частицы в гетерогенном процессе и имеющим 1 или 3 корня. - теплоемкость), то уравнение (5) будет совпадать с уравнением, описывающим неизотермический процесс на поверхности твердой частицы в гетерогенном процессе и имеющим 1 или 3 корня.Т.о. решение уравнения (5) также имеет 1 или 3 корня, а, следовательно, в проточном адиабатическом реакторе идеального смешения возможно существование одного или трех стационарных режимов, представленных на рисунке. 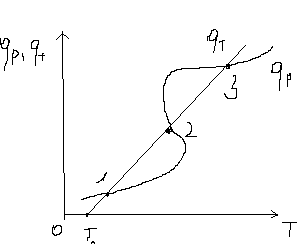 Зависимости qp (T) иqt (T) в проточном реакторе идеального смешения ИС-н. Положительная обратная связь между тепловыделением в реакторе и отводом теплоты из него с нагретым прореагировавшим потоком обуславливает возможность появления неоднозначности стационарных режимов. Низкотемпературный режим (1) на рисунке характеризуется небольшими степенями превращения в реакторе. Наиболее полное превращение осуществляется в режиме 3, когда температура в реакторе достигает значение равному адиабатическому разогреву. Самый привлекательный – среднетемпературный режим 2. 73. Неизотермический процесс в химическом реакторе. Температурный режим в проточном реакторе идеального смешения. Устойчивость стационарных режимов. Допустим процесс находится в стационарном режиме с температурой Т1(рис.1) 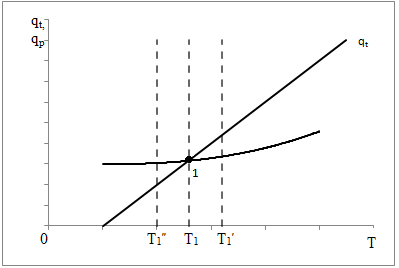 рис.1 рис.1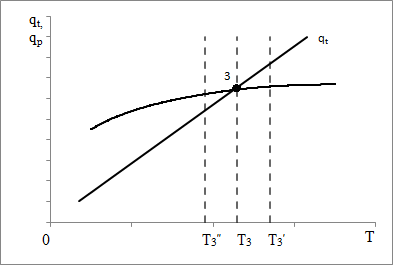 рис 2 рис 2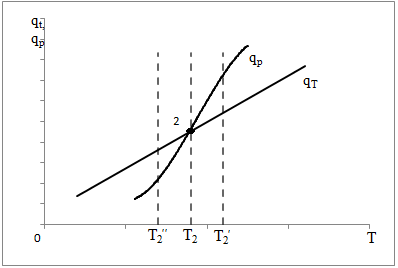 рис3 рис3Увеличение температуры до Т1׳, вызванное внешним возмущением, приводит к повышению тепловыделения qp и теплоотвода qt, причём qt возрастает больше, чем qp. Если источник возмущения будет устранен, то превращающий теплоотвод qt приведет к снижению температуры и режим самопроизвольно вернется в первоначальное состояние с температурой Т1. Если температура в реакторе уменьшится до Т1 ׳׳, то тепловыделение qp станет больше теплоотвода qt и реактор будет разогреваться до температуры стационарного режима Т1. dqp/dT Такие стационарные состояния, где выполняется условие: (1) называют стационарными. В среднетемпературном режиме 2 (рис.3) повышение температуры от Т2 до Т2׳ вызывает более сильно возрастание тепловыделения qp, нежели теплоотвода, что приведет к дальнейшему увеличению температуры в реакторе вплоть до установления высокотемпературного стационарного состояния. Результатом понижения температуры до Т2 ׳׳ будет дальнейшее остывание реактора вплоть до достижения низкотемпературного состояния. Подобное нарушение среднетемпературного режима будет происходить при любых малых изменениях температуры Т, первоначальный стационарный режим самопроизвольно восстанавливаться не будет. Такой режим называют неустойчивым, для него: dqp/dT>dqT/dT (2) Таким образом устойчивое стационарное состояние характеризуется самопроизвольным восстановлением первоначального состояния системы, нарушение которого вызвано внешним возмущением. Неустойчивое стационарное состояние после внесения в него возмущения самопроизвольно не восстанавливается. Следовательно, среднетемпературный режим не реализуется. 74. Неизотермический процесс в химическом реакторе. Температурный режим в проточном реакторе идеального смешения. Процесс с теплоотводом. Математическая модель процесса: x/τ = r (x, T) (T – TH) / τ = ∆ Tад r (x, T) – B(T-Tx) (1) В- параметр теплоотвода; ∆ Tад-адиабатический разогрев; х- степень превращения; TH- температура на входе в реактор; Tx- температура теплоносителя; τ- условное время реакции. При протекании реакции первого порядка приведем систему (1) к следующему виду: Т-Т0 (qТ) = 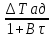 * * 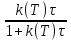 (qр) (qр)(2) k(T)- константа скорости реакции как функция температуры; qТ- теплоотвод; qр- тепловыделение в результате протекания реакции. Для принципиального упрощения анализа примем в (1) Тх = ТН. Из (2) следует, что наличие теплоотвода эквивалентно уменьшению величины адиабатического разогрева ∆ Tад , т.е. максимальный разогрев реактора будет меньше адиабатического и равен 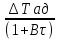 . на рисунке сплошными линиями показаны зависимости qр (Т) и qТ(Т) в адиабатическом режиме (В=0), а штриховыми – в режиме с теплоотводом (В= 0). В последнем случае S- образная кривая qр (Т) более пологая. На рисунке значения параметра теплоотвода В (штриховые линии) растут по направлению стрелки. . на рисунке сплошными линиями показаны зависимости qр (Т) и qТ(Т) в адиабатическом режиме (В=0), а штриховыми – в режиме с теплоотводом (В= 0). В последнем случае S- образная кривая qр (Т) более пологая. На рисунке значения параметра теплоотвода В (штриховые линии) растут по направлению стрелки.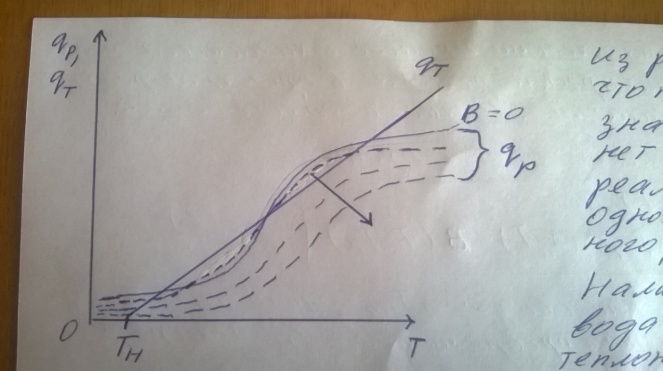 Из рисунка видно, что при некотором значении В станет возможной реализация только одного стационарного режима. Наличие теплоотвода к внешнему теплоносителю в проточном реакторе идеального смешения позволит реализовать стационарный режим процесса в нем практически для любой степени превращения. Неоднозначность и неустойчивость стационарных режимов проявляется при масштабном переходе от лабораторных исследований к промышленному реактору. Из рисунка видно, что при некотором значении В станет возможной реализация только одного стационарного режима. Наличие теплоотвода к внешнему теплоносителю в проточном реакторе идеального смешения позволит реализовать стационарный режим процесса в нем практически для любой степени превращения. Неоднозначность и неустойчивость стационарных режимов проявляется при масштабном переходе от лабораторных исследований к промышленному реактору. Вследствие больших тепловых потерь, вызванных малым масштабом лабораторного реактора, температуру поддерживают искусственно, при этом практически любой режим является устойчивым. Однако, в промышленном реакторе режим, подобранный по лабораторным испытаниям, по этой причине может быть не реализуем. 75. Неизотермический процесс в химическом реакторе. Сопоставление адиабатического процесса в проточных режимах идеального смешения и вытеснения. Сопоставим адиабатические процессы в режимах идеального смешения и вытеснения. Предположим, что в режиме ИС-н реализуются все возможные степени превращения и сопоставим интенсивности процессов по зависимостям « x – τ », полученных при одинаковых параметрах и условиях. Зависимости x(τ) (a) и T(τ) (б) в проточных реакторах идеального вытеснения ИВ (сплошные линии) и смешения ИС-н (штриховые линии) в экзотермическом процессе приведены на рисунке. 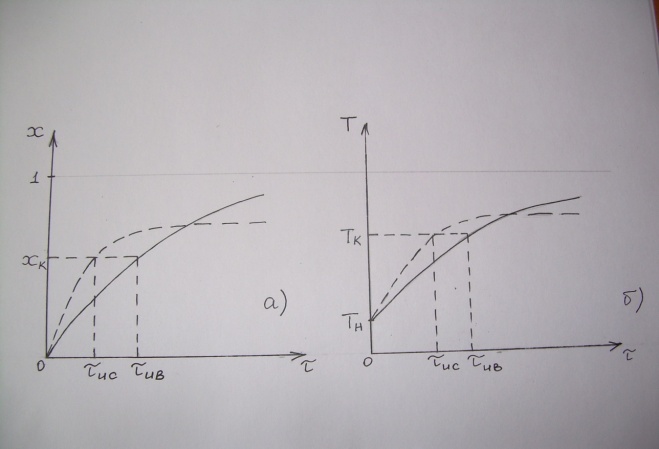 В режиме идеального смешения процесс протекает при конечных (температура и концентрация) условиях, а в режиме идеального вытеснения условия протекания процесса в ходе превращения меняются от начальных до конечных. Следовательно, по сравнению с режимом идеального смешения в режиме идеального вытеснения средняя концентрация исходных веществ больше, а средняя температура меньше. Температурное влияние на скорость превращения – положительное и более сильное, чем отрицательное влияние концентрации. Таким образом, режим идеального смешения более интенсивен, чем режим идеального вытеснения. Для достижения одинаковой степени превращения необходимое условие время τ для протекания реакции в реакторе, работающем в режиме ИС, меньше. Лишь при достаточно больших степенях превращения, когда влияние концентрационного фактора будет превалирующим, интенсивность процесса в режиме ИС падает и даже уступает режиму ИВ. Это отражено на рисунке: при малых значениях τ превращение, совершающееся в режиме ИС (штриховые линии), больше, чем в режиме Ив, при больших τ (вблизи полного превращения) интенсивнее режим ИВ. Эндотермический процесс сопровождается охлаждением реакционной смеси. Средняя температура в режиме ИВ выше, чем при ИС, и поэтому адиабатический эндотермический процесс всегда протекает интенсивнее в режиме ИВ. 76. Химическое производство как химико-технологическая система. Любое химическое производство содержит совокупность машин,аппаратов,связанных между собой трубо-,газо- и паропроводами, а также электиречскими,транспортными, телекоммуникационными линиями связи для совместного функционирования,результатом которого является получении продукции и выполнение других функций производства. Такой объект является системой. Система- совокупность элементов и связей между ними, функционирующих как единое целое. Система взаимодействует с внешней средой и обладает сложным внутренним строением, большим числом составных частей и элементов (машин, аппаратов), взаимосвязанных технологическими потоками (связями) и действующих как единое целое. Элемент - самостоятельная условно неделимая единица. Элемент изменяет свойства и состояние входящих в состав него потоков. Выходящие потоки передаются по связям в другие элементы, в которых происходят их последующее изменения. В химическом производстве элемент это машина или аппарат, в котором протекает какой-либо типовой процесс (химический, диффузионный, тепловой и т.п.), связями являются трубо -, газо- и паропроводы. Связь между элементами отражает перенос материальных, тепловых и энергетических потоков от элемента к элементу. Это позволяет представить химическое производство как химико-технологическую систему(ХТС). ХТС- совокупность аппаратов, машин и других устройств(элементов) и материальных,тепловых,энергетичесих и других потоков(связей) между ними, функционирующая как единое целое и предназначенная для переработки исходных веществ(сырья) в продукты. Элементы ХТС может быть представлен отдельным аппаратом или их совокупность. Степень детализации элемента зависит от задачи исследований. Совокупность аппаратов также можно представить как ХТС. По отношению ко всей ХТС это подсистема как часть большой системы. Подсистема- группа элементов(агрегатов) обладающая определенной целостностью и целенаправленностью. Это самостоятельно функционирующая часть системы. Как между элементами, так между подсистемами существуют различные виды связей- материальная, энергетическая, тепловая, информационная и т.д. Цель исследования определяет состав ХТС. Подсистемы могут быть выделены как по масштабу, так и функционально. Реакционный узел- малая по масштабу, но значимая во всем технологическом процессе переработки сырья подсистема. Энергетическая подсистема- по масштабу охватывает все производство, но ее роль сводится к выполнению определенной функции. Фактически исследования сложных ХТС сводится к изучению ее подсистем. Таким образом,ХТС представляет собой модель химического производства или химико-технологического процесса, отображающую его структуру и позволяющую предсказывать те или иные свойства и показатели. 77. Системный анализ химико-технологической системы. ХТС-как совокупность элементов и связей функционирует как единое целое. Для исследования таких объектов, их свойств и особенностей функционирования развита теория систем. Конкретная реализация и приложение теории систем к исследованию ХТС называется системный анализ ХТС. Системный анализ ХТС-совокупность методов и средств изучения сложных ХТС. Системный анализ-результат успешного применения к исследованию и разработке ХТС опыта изучения, создания и эксплуатации химических производств с привлечением методов, используемых в различных областях науки и техники, в инженерно-технических исследованиях и разработках; обобщение и систематизация «ноу-хау» в теории и практике химических производств. Основополагающие принципы системного подхода следующие: 1.представление объекта как системы 2.исследование его в том аспекте, в котором он представлен как система Т.е. стратегия исследования должна заключаться в направлении от целого к частностям, от системы к элементам. Элементы ХТС находятся в бесчисленном множестве связей и отношений между собой. Степень интенсивности связи или отношения зависит от их существенности. Задача исследования заключается в том, чтобы определить, какие связи существенные, определяющие систему, а какие-нет. Использование общесистемных закономерностей, связь системного анализа с общей теорией систем-одно из преимуществ системного исследования. В системном анализе выделяют следующие этапы при исследовании и анализе ХТС: 1.Выделение элементов, определяющих свойства ХТС, изучаемых на проводимом этапе исследования и разработки технологического процесса. 2.Установление зависимости выходных потоков от входных для каждого элемента,т.е. получение математической модели, основанной на физико-химических и физических закономерностях протекающих процессов, и определение её свойств и особенностей. 3.Выделение связей между элементами , ответственных за проявление необходимых свойств ХТС. Т.о. определяется структура ХТС-совокупность элементов и их связей. Математическое описание элементов создает основу для количественных расчетов при исследовании системы 4.Исследование ХТС-расчёт показателей, определение свойств(особенностей), изучение эволюции ХТС для улучшения её показателей и свойств. На этом этапе применяют методы различных областей наук-кибернетики,топологии,факторного анализа теории информатики,игр,катастроф и т.п. Большое значение имеют эвристические решения, использующие накопленный опыт исследования химических производств. Описание системы, состоящей из сотен элементов и связей, включает сложную систему алгебраических, дифференциальных и интегральных уравнений,поэтому основное средство системного анализа-электронные вычислительные машины,компьютеры. 78.подсистемы химико-технологической системы Исследовать хим. Производство в целом, при всем многообразии его составных частей- задача малоэффективная и сложная. Представив хим.производство как ХТС приведем систематизацию частей производства, представленных в структуре ХТС, Цель такой систематизации- выделить подсистемы ХТС для их исследования. Подсистемы выделяют по функциональному и масштабному признакам. А. Функциональные подсистемы обеспечивают выполнение функций производства и его функционирование в целом. К ним относятся: 1)технологическая подсистема-часть производства, где осуществляется переработка сырья в продукты- химико-технологический процесс; 2)энергетическая подсистема- служит для обеспечения энергией химико-технологического процесса; 3)подсистема управления- осуществляет получение информации о функционировании производства и управляет им. Это автоматизированная система управления технологическим процессом (АСУТП). Совокупность функциональных подсистем образует состав ХТС, Б, Масштабные подсистемы выполняют определенные функции в последовательности процессов переработки сырья в продукты как отдельные части химико-технологического процесса. Их систематизируют в виде иерархической последовательности. Иерархическая структура ХТС дана на рисунке.. Элементом минимального масштаба в структуре ХТС является отдельный аппарат. Это низший масштабный уровень 1. Объединение нескольких аппаратов, выполняющих вместе какое-либо преобразование потока, образует один элемент подсистемы 2-го масштабного уровня (реакционный узел и т.п.). Совокупность подсистем второго уровня в виде элементов, подобных отделениям или участкам производства, образует подсистему 3-его уровня. К этим же подсистемам могут относиться водоподготовка, регенерация отработанных вспомогательных материалов, утилизация отходов и т.п. Совокупность отделений и участков образует химико-технологическую подсистему производства в целом(4 уровень). Масштабный уровень  Описанное выделение подсистем условно. Иерархическая структура ХТС позволяет на каждом этапе сохранить размерность исследуемой задачи, а результаты изучения подсистемы одного производства использовать в исследованиях другого. Иерархическую структуру масштабных подсистем можно представить также для функциональных подсистем. 79.Эелементы и связи химико-технологической системы Рассмотрим элементы, находящиеся на нижней ступени иерархической структуры и предназначенные для определенного изменения состояния потока. А. Классификация элементов ХТС по назначению. 1.механические и гидромеханические элементы 2.теплообменные элементы 3.массообменные элементы 4.реакционные элементы 5.энергетические элементы 6. элементы контроля и управления В каждый из перечисленных элементов могут входить различные по назначению устройства и протекать разнообразные процессы. Б. Классификация связей (потоков) Потоки ХТС, связывающие аппараты (связи между элементами), классифицируют по их содержанию: 1.материальные (вещественные) потоки 2.энергетические потоки (тепловые, силовые, электрические, топливные) 3.информационные потоки В. Структура связей Последовательность прохождения потоков через элементы ХТС определяет структуру связей и обеспечивает определенные условия работы элементов системы. Рассмотрим основные типы структуры связей. Здесь прямоугольники- элементы, стрелки- связи и направления потоков 1.последовательная связь: 2.разветвленная связь: 3.параллельная связь: 4.обводная связь(байпас): VБ V0 Величину байпаса β определяют как долю основного потока V0 проходящего мимо аппарата β= VБ / V0 VБ- поток проходящий мимо аппарата 5.обратная связь или рецикл Vр V V0 Р- Система разделения Р Б) Т В) Теплообменник Г) Через аппарат, в который направляется рецикл VP проходит больший поток V по сравнению с основным V0, так что V= V0+ VP , Отношение приращенного и основного потоков называют кратностью циркуляции Кр : КР=V/V0 А)полный рецикл Б)фракционный рецикл (возвращается фракция потока) В) рециркуляция тепловой фракции потока, а не компонента, как в схемеб) (форма фракционного рецикла) Схемы а-в –простой рецикл Г)сложный рецикл 80. Анализ химико-технологической системы. Анализ химико-технологической системы (ХТС) состоит в изучении свойств и эффективности функционирования ХТС в целом и на основе её математической модели. Свойства системы зависят как от параметров и характеристик состояния элементов (подсистем), так и от структуры технологических связей между ними. Поэтому анализ ХТС заключается в получении сведений о состоянии ХТС, показателей эффективности её функционирования, а также влияния химической схемы, структуры технологических связей, свойств их состояния элементов и подсистем, условий эксплуатации, на эти данные. В ходе анализа ХТС необходимо оценить степень влияния этих факторов на значения выходных переменных ХТС, характеризующих состояние системы. Фактически в задачу анализа ХТС входит получение показателей химического производства и химико-технологического процесса (производительность, выход продукта и т. д). Первым шагом в анализе ХТС является определение её состояния, т.е. расчет ХТС. Затем, обладая информацией об изменении состава и количества потоков, энергетических расходах, проводят другие расчеты, целью которых является получение технологических показателей, экономических показателей, некоторых специальных показателей. Эксплуатационные показатели определяют из реакции системы на те или иные возмущения в ходе процесса. Полная математическая модель ХТС может быть рассчитана лишь после того как составлена химико-технологическая система, т.е. анализ не может быть проведен в отрыве от синтеза. Анализ ХТС осуществляют при разработке и проектировании нового химического производства, при эксплуатации действующего производства, для сравнения различных вариантов реализации процесса и при модернизации и реконструкции производства. 81.Синтез химико -технологической системы (ХТС) Синтез или построение ХТС заключается в определении основных технологических операций и их последовательности, выборе аппаратов и установлении связей между ними, определении параметров технологических режимов отдельных аппаратов и системы в целом, для обеспечения наилучших условий функционирования ХТС. Задача синтеза ХТС состоит в создании ХТС работающей с высокой эффективностью. Для этого необходимо выбрать оптимальную технологическую топологию( т.е.выбрать число и тип элементов, установить характер связей между ними), а затем определить значения входных переменных ХТС( количество сырья, его состав и т.п.) технологических параметров элементов системы и параметров внутренних технологических потоков. Т.о. задача синтеза ХТС сводится к нахождению значений этих параметров, которые будут обеспечивать оптимальный показатель эффективности функционирования системы..С синтезом ХТС связана задача оптимизации ХТС ,которая сводится к нахождению экстремального значения выбранного критерия эффективности функционирования системы. В качестве критериев эффективности работы ХТС используют экономические критерии, иногда используют и технологические критерии эффективности. Совокупность предварительной подготовки данных, синтеза ХТС и проектирования производства, в их тесной взаимосвязи понимают как разработку химико-технологического процесса(разработка технологии процесса) В настоящее время обычные методы проектирования агрегатов и установок заменяют оптимальным проектированием, т.к. при обычном проектировании выбор принятого варианта недостаточно обоснован с точки зрения наилучшего достижения желаемых результатов. При оптимальном проектировании выбор окончательного варианта производится по специально разработанной стратегии математически обоснованными методами перебора значительного числа вариантов конструктивных схем и режимов агрегатов и установок. Эта задача решается с помощью автоматизированных систем технологического проектирования(АСТП) При автоматизированном проектировании математическая модель отдельного элемента ХТС представляют в виде совокупности математических моделей типовых технологических операторов. Модель типового технологического оператора называют МОДУЛЕМ, Один элемент ХТС описывается несколькими модулями. Для моделирования элемента ХТС берут определенный набор модулей. На основании стандартных программ мат. Моделей типовых технологических операторов по модульному принципу разрабатывают математические модели элементов ХТС. Т.о. СИНТЕЗ ХТС - задача и процесс, требующие поиска лучших решений, уточнения каждого шага в поиске наилучших решений, то есть синтез ХТС- задача и процесс творческие. 82. Сырьевая база химической промышленности. С точки зрения использования сырья характерными особенностями хим. Производства являются: 1. Многовариантность сырьевой базы; 2.Широкие возможности комплексного использования одних и тех жевидов сырья для получения различных химических продуктов; 3.Многообразие методов химической переработки; 4. Большинство химических продуктов может быть получено несколькими путями. Химическая промышленность использует в качестве сырья продукты горнорудной, нефтяной, газовой, лесной и целлюлозно-бумажной промышленности, черной и цветной металлургии. Большое значение имеет использование отходящих газов, в частности в чёрной и цветной металлургии, в качестве сырья для хим. Промышленности. Химическая промышленность потребляет сельскохозяйственное сырьё, однако объём его потребления, по понятным причинам, постоянно снижается – всё большее количество видов пищевого сырья заменяют непищевыми (или синтетическими) материалами. Развитие сырьевой базы химической промышленности происходит в направлении более полного, комплексного использования сырья, вовлечения в переработку сырья с низким содержанием основного вещества, утилизации отходов внутри самой химической промышленности и других отраслей, а также вовлечения в переработку всё большей массы разнообразного природного сырья, каким являются нефть, газы, уголь, сланцы, древеснорастительное сырьё, а также сырьевые ресурсы Мирового океана. Варьирование сырьевых ресурсов позволяет выбирать надёжную сырьевую базу для развития химической промышленности в зависимости от наличия полезных ископаемых и технико-экономических показателей их использования. 83) Основные понятия и классификация сырья. В производстве химических продуктов различают исходные вещества (сырье), промежуточные продукты (полупродукты) и готовые продукты. Полупродукты, в свою очередь, служат сырьем для получения других веществ. В химико-технологических процессах используется лишь 60 элементов периодической системы, их участие в производстве может исчисляться как несколькими килограммами, так и десятками миллионов тонн. Крупнотоннажные химические производства основываются на ограниченном числе видов сырья, но используются в больших количествах (газ, нефть, руда и т. д.). Сырьё химической промышленности классифицируют по различным признакам:
Кроме того, сырьё подразделяют на: -первичное (минеральное, газ, нефть, животное и т.д.) и вторичное (промышленные и потребительские отходы); -природные и искусственные (полупродукты). В свою очередь, минеральное сырьё включает рудное, нерудное, горючее. Рудное сырье – это различные руды, содержащие оксиды и сульфиды металлов. Нерудное сырье – поваренная соль, гипс, известняк, глина, апатиты и пр. Горючие ископаемые – торф, уголь, нефть, газ. Их используют в качестве сырья и энергоресурсов. Растительное (картофель, древесина, лен и прю) и животное (шерсть, шелк, молоко и пр.) сырье перерабатывают в продукты питания (пищевое сырье) или в продукты бытового и промышленного назначения ( техническое сырье). Сырье, применяемое в химико-технологических процессах, должно удовлетворять ряду требований, в частности обеспечивать:
84.Вторичные материальные продукты. Существенным источником химического сырья являются вторичные материальные ресурсы (ВМР). К ним относят отходы производства, отходы потребления и побочные продукты. Отходами производства называют остатки сырья, материалов и полупродуктов, образующиеся в процессе производства продукции, которые частично или полностью утратили свои качества и не соответствуют стандартам и техническим условиям. В зависимости от свойств и состава выделяют три основные группы отходов предприятий химической и нефтеперерабатывающей промышленности:
Особую группу составляют безвредные или обезвреженные отходы, направляемые непосредственно в окружающую среду. Отходами потребления называют различные бывшие в употреблении изделия и вещества, восстановление которых нецелесообразно. Их подразделяют на отходы промышленного потребления (реактивы, катализаторы, различные изделия производственного назначения) и отходы бытового потребления (изделия домашнего обихода). Побочные продукты образуются в процессе переработки сырья наряду с основными продуктами производства, но не являются целью производственного процесса. Те побочные продукты, которые получаются при добыче или обогащении основного сырья называют попутными продуктами (попутный газ). Побочные и попутные продукты данного процесса являются целевыми продуктами для другого производства. Вторичные материальные ресурсы полностью или частично заменяют первичное сырье и материалы в производстве необходимой народному хозяйству продукции. Химическая промышленность, таким образом, выступает не только как потребитель природных ресурсов, но и как отрасль, сберегающая природное сырье. 85. Энергетическая база химической промышленности. Современная химическая промышленность один из крупнейших потребителей топлива и электроэнергии. Она использует тепловую, электрическую и механическую энергию. Тепловые процессы по видам используемой тепловой энергии подразделяют на высоко-, средне-, низкотемпературные и криогенные процессы. Высокотемпературные процессы протекают выше 500ºС. Их используют для изменения физико-химических свойств сырья или полуфабрикатов их обжигом, а также для интенсификации химических реакций. Эту энергию получают при сжигании различных видов топлива непосредственно в технологических устройствах. Среднетемпературные (150-500ºС) и низкотемпературные (100-150ºС) процессы используют когда необходимые физико-химические изменения свойств обрабатываемых материалов достигаются при повышенных температурах и давлениях. Это пиролиз, крекинг, дистилляция, сушка и т.п. Низкопотенциальную энергию используют также в бытовых нуждах. Основными энергоносителями, обеспечивающими энергией эти процессы являются пар и горячая вода. Криогенные процессы протекают при температуре ниже 150ºС. Их используют для осуществления процессов криохимической технологии (например, криоизмельчение). Электрическая энергия применяется для проведения электрохимических и электротермических процессов. Кроме того ее применяют в процессах, связанных с электромагнитными и электростатическими явлениями. Электронно-ионные и фотоэлектрические явления применяются для контроля процессов, телеуправления ими, сигнализации. Автоматизация химико-технологических процессов требует широкого использования электроники. Электрическая энергия используется для освещения и получения механической энергии. Механическая энергия необходима для физических операций: дробления, смешения, центрифугирования и т.д., а также для различных вспомогательных операций (транспортировка, вентиляция и т.д.). На расход энергоресурсов оказывают влияние правильный выбор сырья и методов его подготовки. Тщательно подготовленное сырье обеспечивает снижение энергозатрат на процесс в целом. В химической промышленности проводится последовательная работа по расширению масштабов применения прогрессивных технологических процессов, поиску новейших технических решений, позволяющих экономить топливно-энергетические ресурсы. 86.Классификация топлива- энергетических ресурсов. Основными видами энергетических ресурсов являются горючие ископаемые и продукты их переработки; энергия воды; биомасса; атомная энергия. Частично используется энергия ветра, солнечная энергия и энергия морских приливов и отливов. Энергетические ресурсы разделяют на топливные(газ, уголь, нефть и т.д.), возобновляемые и невозобновляемые , первичные и вторичные. Все возобновляемые энергетические ресурсы являются производными от энергии Солнца ,но для удобства классифицированы по следующим категория: 1) Солнечная энергия (прямая радиация). 2) Гидроэнергетические ресурсы (испарение-конденсация). 3)Энергия ветра и волн. 4) Биомасса (растения и животные). К практическим неисчерпаемым относят геотермальные и термоядерные энергетические ресурсы. К невозобновляемым энергетическим ресурсам относят те, запасы которых по мере их добычи необратимо уменьшаются. К ним относят уголь, нефть, природный газ, горючие сланцы и т.д. Все выше названные виды энергоресурсов – первичные. Вторичными энергоресурсами (ВЭР) называют энергетический потенциал продукции, отходов, побочных и промежуточных продуктов,образующийся в технологических агрегатах и не используемый в них, однако может частично или полностью применен для энергоснабжения других агрегатов. Рациональное использование ВЭР одним из крупнейших резервов экономии топлива в промышленности, способствующим снижению топлива и энергоемкости продукции. Наиболее тепловыми вторичными ресурсами располагают предприятия химической, нефтеперерабатывающей и нефтехимической промышленности, черной и цветной металлургии, промышленности строительных материалов, газовой промышленности, тяжелого машиностроения. Топливо называют энергетическим, если его испльзуют для получения электрической и тепловой энергии. Топливо непосредственно используемое в различных агрегатах и установках, называют технологическим. В зависимости от агрегатного состояния, топливо подразделяется на твердое, жидкое и газообразное. Твердое топливо- уголь, торф, сланцы, дрова и продукты их переработки, кокс, брикеты торфяные и угольные, древесный уголь и д.р. Жидкое топливо- нефть, газовый конденсат и продукты их переработки; бензин, керосин, мазут и д.р. Газообразное топливо- природный, нефтепромышленный(попутный) и шахтный газы, а также нефтезаводской, коксовый, генераторный. Водяной, доменный и ваграночный газы, водород и газы процессов брожения. 87. микробиологический синтез В основе микробиологического синтеза лежат сложные биохимические превращения, обеспечивающие получение требуемой биомассы или продуктов ее жизнедеятельности. Микробиологический синтез происходит в клетках микроорганизмов или вне их под действием ферментов(энзимов). В технологических процессах используют микроорганизмы, способные размножаться с большой скоростью, а также к сверхсинтезу – ибыточному образованию продуктов обмена веществ, превышающему потребности микробной клетки. Такие микроорганизмы выделяют из природных источников или выводят искусственно. Технологический процесс микробиологического синтеза дан на схеме: охлаждение Продуцент Отделение сушка Ферментация биомассы биомассы Аэрация готовый продукт Питательная среда сушильный Биологическая агент Очистка воды Показанный на схеме процесс состоит из подготовки высокопроизводительной культуры микроорганизма (продуцента); приготовления питательной среды (субстрата); выращивания продуцента; культивирования продуцента в заданных условиях, в ходе которого осуществляется микробиологический синтез (ферментация); сгущения и отделения биомассы или выделения и очистки целевого продукта. Сгущенная биомасса поступает в сушильные устройства, после которых и получают готовый продукт. |

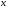 как функцию
как функцию 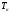 на
на 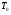 (
(