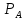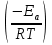ШПОРЫ ОХТ. Цели и задачи курса Общая химическая технология Объект изучения курса
 Скачать 3.94 Mb. Скачать 3.94 Mb.
|
|
45.Гетерогенный химический процесс:Лимитирующие стадии и режимы процессы.Скорость отдельной стадии процесса(реакция массоперенос) Скорость отдельной стадии процесса(реакция, массоперенос)определяется его параметром(константой скорости, коэффициентом массообмена) и движущей силой( концентрацией – для реакции, разностью концентраций -для массопереноса.) Параметр процесса является характеристикой интенсивности его стадий. Если k<<β – реакция малоинтенсивна и в уравнении (6) Cn= 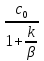 получаем cn≈c0 , - то есть реакция будет протекать при максимально возможной в этих условиях концентрации ( у реакции максимально движущая сила). получаем cn≈c0 , - то есть реакция будет протекать при максимально возможной в этих условиях концентрации ( у реакции максимально движущая сила).Из уравнений (8) КH= 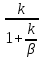 и (9) WH= - KH C0 получим, что наблюдаемая скорость превращения равна скорости реакции WH= - k c0 и не зависит от параметра массопереноса β. и (9) WH= - KH C0 получим, что наблюдаемая скорость превращения равна скорости реакции WH= - k c0 и не зависит от параметра массопереноса β.Таким образом, данный процесс протекает в кинетическом режиме, а реакция является лимитирующей стадией. В случае когда k>>β – интенсивность массообмена мала, из уравнения (6) Cn= 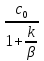 получим cn< получим cn<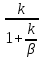 и (9) WH= - KH C0 => WH= - β c0. и (9) WH= - KH C0 => WH= - β c0.Массоперенос осуществляется при максимальной движущейся силе (c0-cn)=c0, а скорость превращения не зависит от параметра реакции (константы скорости k). Это диффузионный режим, а массоперенос -лимитирующая стадия. Режим и лимитирующая стадия – понятия и характеристики, присущие многостадийному процессу. Лимитирующая стадия - этап многостадийного процесса, который происходит при максимальной движущей силе или минимальной интенсивности. Лимитирующая стадия определяет режим или область протекания процесса .т.е это не скорость самой медленной стадии т.к. в стационарном режиме скорости всех стадий равны. 46. Гетерогенный химический процесс:Система"газ-жидкость" Взаимодействие «газ-жидкость» представлено в промышленности несколькими разновидностями по способу контакта фаз:
Схема процесса взаимодействия газа с жидкостью, обобщающая все рассмотренные способы контакта , представлена на рисунке 2. Рисунок 2 Схема гетерогенного процесса «газ-жидкость». 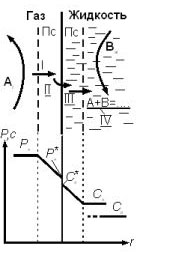 Компоненты из газообразного и жидкого потока переносятся через поверхность раздела фаз и реакция протекает в одной фазе или в обеих. В пределах выделенного элемента , в качестве которого можно выделить газовый пузырь с некоторым объемом жидкости, или элементарный участок пленчатого газожидкостного потока, концентрация компонентов по участку каждой фазы распределяется равномерно. Рассмотри один из вариантов процесса: Исходные компоненты А и В содержатся в газе и жидкости соответственно. Их содержание определенно условиями процесса: парциального давление А в газе РА и концентрации В в жидкости СВ. Реакция протекает в жидкой фазе и продукты остаются в жидкости или могут перейти в газ. Запишем уравнение следующим образом: Ar+Bж=Rж + (Sr) (18) Скорость реакции(18) описывается кинетическим уравнением: r = k cAcB (19) где СA- концентрация А в жидкой фазе. Структура процесса. Одно из отличий данной системы от предыдущей заключается в существовании в обеих фазах пограничных слоев, что обусловлено их текучестью. Выделим основные этапы(стадии) процесса (см. рис.2).
Возможное распределение концентраций А представлено в нижней части на рис.2. Математическая модель указанной последовательности этапов основано на равенстве потоков WI:WII и WIII на стадиях переноса и WIV превращения компонента А: WI=WII=WIII=WIV (20)
где 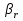 - коэффициент масообмена между объемом газа и поверхностью раздела фаз; - коэффициент масообмена между объемом газа и поверхностью раздела фаз;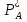 - парциальное давление А у поверхности раздела фаз - парциальное давление А у поверхности раздела фаз 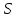 -площадь поверхности раздела фаз -площадь поверхности раздела фазПри переносе через поверхность раздела фаз можно полагать, что при поверхностные парциальное давление в газе 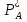 и концентрации и концентрации 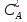 в жидкости находятся в равновесии: в жидкости находятся в равновесии: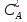 =Ka =Ka 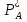 (22) где Ka – константа абсорбции. (22) где Ka – константа абсорбции.
WIII= - βж S( 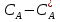 ) (23) где βж- коэффициент массообмена между поверхностью раздела и объемом жидкости. ) (23) где βж- коэффициент массообмена между поверхностью раздела и объемом жидкости.
WIV= - k CACBVж (24) Сопоставляя уравнение (20-24) получаем: 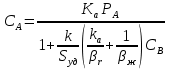 (25) где (25) где 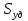 - удельная поверхность раздела фаз - удельная поверхность раздела фаз 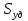 =S/Vж ,используется для характеристики развитости площади контакта жидкости и газа. =S/Vж ,используется для характеристики развитости площади контакта жидкости и газа.Если перенос из одной среды в другую проходит через несколько последовательных этапов, его интенсивность определяет общим коэффициентом массопереноса между газом и жидкостью –β: 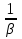 = =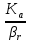 + +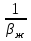 (26) (26)В химической технологии удобно использовать объемный коэффициент массопереноса 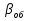 - количество вещества, переносимого между фазами через поверхность, находящегося в единице объема одной или обеих фаз, в единицу времени при единичной разности концентраций вещества в фазах: Βоб=β Sуд (27) - количество вещества, переносимого между фазами через поверхность, находящегося в единице объема одной или обеих фаз, в единицу времени при единичной разности концентраций вещества в фазах: Βоб=β Sуд (27)Преобразуем уравнение (25) используя выражение (26),(27): СА= 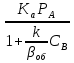 (28) (28)Наблюдаемую скорость превращения WH получим подставив (28) в кинетическое уравнение (24): WH=WA= - k CACB= - 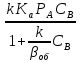 (29) (29)Режимы процесса. В кинематическом режиме определяют стадией является реакция, вызванная максимальной движущей силой. В данном случае это произойдет если жидкость будет насыщена компонентом А , то есть при условии СА=KаPA , что исходя из (28) возможно при 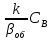 >>1 и как следует из (29): WH= - βоб Ka PA (31) >>1 и как следует из (29): WH= - βоб Ka PA (31)Отсюда наблюдаемая скорость превращения WH равна скорости переноса компонента А в не содержащую его жидкость, и зависит от коэффициента переноса βоб Анализ процесса «газ-жидкость». Обращает на себя внимание иной вид выражения (29) для WH по сравнению с кинетическим уравнением (24) согласно которому скорость реакции описывается уравнением первого порядка по компонентам А и В. Выражение же (29) имеет вид характерной для реакций с торможением их скорости одним из компонентов. В данном случае с увеличением концентрации В реакция приобретает нулевой порядок по В, то есть ее скорость не зависит от концентрации В. Причина «торможения» скорости реакции связана с нехваткой компонентов А в жидкости для протекания реакции. Температурная зависимость скорости превращения. При небольших температурах константа скорости мала: 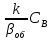 <<1 и в системе устанавливается кинетический режим ( уравнение (30)). Однако с возрастанием температуры на скорости реакции начинает сказываться константа абсорбции Ка и реакция начинает переходить в диффузионный режим. <<1 и в системе устанавливается кинетический режим ( уравнение (30)). Однако с возрастанием температуры на скорости реакции начинает сказываться константа абсорбции Ка и реакция начинает переходить в диффузионный режим.По этой причине скорость превращения с ростом температуры сначала возрастает, а затем уменьшается. При больших температурах наблюдается диффузионный режим и, соответственно 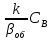 >>1. (см. (29)). >>1. (см. (29)).Здесь температура может даже отрицательно сказываться на скорости превращения из-за уменьшения растворимости газообразного компонента. Коэффициент массопредачи βоб практически не зависит от температуры. Интенсификация процесса.
При подъеме мелкие пузыри сливаются, крупные- дробятся и реально можно достигнуть значения объемного коэффициента массопереноса βоб=0,2-0,3с-1. Увеличить поверхность контакта фаз возможно путем принудительного создания развитой поверхности с помощью насадки. Но и этот прием так же ограничен. В слое мелкой насадки с развитой поверхностью пространство для потоков газа и жидкости ограничено. Этим путем можно достигнуть значение объемного коэффициента массопередачи βоб = 0,5÷0,6 с-1.
С увеличение константы абсорбции Ка вызванным, например, подбором хорошего растворителя, наблюдаемая скорость превращения будет возрастать. 47. Общие представления о катализе Катализ-изменение скорости или возбуждение химической реакции катализатором, т.е. веществами участвующими в реакции, но не входящими в состав конечных продуктов. Различают положительный(ускорение) и отрицательный (ингибирование, замедление реакций). Обычно термин катализ относят к положительному катализу. Вещества, замедляющие скорость реакции называют ингибиторами. Суть каталитического действия заключается в следующем. 1)Химические превращение протекает через образование активированного комплекса, обладающего избыточной энергией, достаточной для перестройки участвующих в нем молекул и образования новых химических связей, то есть получения новых веществ – продуктов реакции. Участвовать в образовании активированного комплекса могут только те молекулы, энергия которых превышает энергию активации его образования. Использование катализатора приводит к изменению реакционного пути за счет химического взаимодействия с компонентами реакции через образование активированного комплекса, обладающего меньшей энергией, чем полученного без участия катализаторы. 2)Промежуточное соединение, в которое входит катализатор, далее превращается в продукты, через другой активированный комплекс, но тоже образованный с меньшей затратой энергии. После второго этапа (стадии) реакции катализатор восстанавливает свой химический состав, и составляющие его компоненты не входят в состав продукта. Вне зависимости от того, как протекает химическая реакция (с участием катализатора или без него),исходное и конечное энергетическое состояние реагирующей системы, в том числе и энергия Гиббса не изменяется. Таким образом катализатор не сдвигает химическое равновесие в реагирующей системе, но ускоряет его достижения. Каталитическое превращение, описанное выше, осуществляется по стадийному механизму, когда одна некаталитическая реакция типа A+BEaC+D заменяется совокупностью нескольких стадий последовательного взаимодействия реагентов с катализатором с образованием на каждой стадии активированного комплекса: ЕА1ЕА2 A+K (AK)* AK+ B (1), где(AK)*-активированный комплекс, образующийся на первой стадии АК- промежуточное соединение А с катализатором К К- катализатор (ABK)*- активированный комплекс, образующийся на второй стадии Еа– энергия активации каталитической реакции Еа1 , Еа2 - соответственно энергии активации первой и второй стадии каталитической реакции, причем Еа1 <Еа и Еа2 < Еа. Возможен слитный (ассоциативный, синхронный) механизм, включающий одновременное взаимодействие всех реагентов с катализатором и образование одного активированного комплекса: А+В+К (АВК)* С+D+K (2) Катализаторы часто обладают избирательным действием( селективностью), то есть ускоряет лишь одну из термодинамически возможных реакций.Т.е. катализ является не только методом ускорения реакции, но и методом управления для направленного осуществления тех или иных превращений. Катализаторами могут быть элементарные вещества (металлы, активированный уголь), химические соединения (оксиды, сульфиды, хлориды), сложные комплексы и многоатомные молекулы, их смеси. Специфика катализатора зависит как от его состава и строения, так и от вида химической реакции. Классификация каталитических реакций основана на фазовом состоянии участников процесса
Гомогенный и микрогетерогенный катализ – однофазные процессы и к ним применимы закономерности, характерные для гомогенных и газожидкостных химических процессов. Гетерогенно-каталитический процесс Место протекания гетерогенной каталитической реакции – поверхность твердого катализатора. Для ее увеличения используют пористые катализаторы, внутренняя площадь поверхности в которых достигает десятки и сотни квадратных метров в одном кубическом сантиметре. Наружная поверхность таких катализаторов в 103 -106 раз меньше внутренней, поэтому вклад наружной поверхности в общую скорость превращения можно не учитывать. Существенным преимуществом гетерогенно-каталитических процессов является простота разделения продуктов реакции и частиц катализатора для его повторного использования. |