Ответы на вопросы по химии. Д. И. Менделеева. Структура периодической системы
 Скачать 0.81 Mb. Скачать 0.81 Mb.
|
|
Свойства галогеноводородов
НF и НСl получают действием концентрированной серной кислоты на твердые галогениды: КF + Н2SO4(конц) = НF↑ + КНSО4, КСl + Н2SО4(конц) = НСl↑ + КНSО4. НВr и НI в аналогичной реакции получить не удается, т.к. являются сильными восстановителями и окисляются серной кислотой. Их получают гидролизом галогенидов фосфора, образующихся при взаимодействии красного фосфора с бромом и иодом соответственно: 2Р + 3Вr2 + 6Н2О = 6НВr↑ + 2Н3РО3 и аналогично с йодом. При растворении галогеноводородов в воде происходит диссоциация на ионы, и образуются растворы соответствующих галогеноводородных кислот. Причем при растворении НI, НВr и НСl диссоциируют почти полностью, поэтому образующиеся кислоты относятся к числу сильных. В отличие от них, фтороводородная (плавиковая) кислота является слабой. Это объясняется ассоциацией молекул НF вследствие возникновения между ними водородным связей. Поскольку отрицательные ионы галогеноводородных кислот могут проявлять только восстановительные свойства, то при взаимодействии этих кислот с металлами окисление последних может происходить только за счет ионов Н+. Поэтому кислоты ННаl реагируют только с металлами, стоящими в ряду напряжений левее водорода. Все галогениды металлов, за исключением солей Аg и Рb, хо рошо растворимы в воде. Малая растворимость галогенидов се ребра позволяет использовать обменную реакцию типа Аg+ + Наl- = АgHal↓ как качественную для обнаружения соответствующих ионов. В результате реакции АgСl выпадает в виде осадка белого цвета, АgВr — желтовато-белого, АgI —ярко-желтого цвета. Интересно, что по сравнению со многими солями достаточно невелика растворимость в воде хлорида натрия (!). Если, например, сливать вместе насыщенные растворы нитра та натрия и хлорида кальция, то образуется осадок хлорида нат рия: 2NаNО3(насыщ.) + СаСl2(насыщ.) = 2NаСl(тв.)↓ + Са(NО3)2(р-р). В отличие от других галогеноводородных кислот, плавиковая кислота взаимодействует с оксидом кремния (IV): SiO2 + 4НF = SiF4↑ + 2Н2О. Так как оксид кремния входит в состав стекла, то плавиковая кислота разъедает стекло, и поэтому в лабораториях ее получают (а потом и хранят) в сосудах из полиэтилена или тефлона. Необходимо отметить очень важную особенность — все они неустойчивы в присутствии солнечного света. На свету они разлагаются, образуя серебро и свободный галоген:
Именно реакции типа (*) привели к созданию белой фотографии. Кислородсодержащие соединения галогенов. Все галогены кроме фтора, образуют соединения, в которых они обладают положительной степенью окисления.Наиболее важными из них являются кислородсодержащие кислоты галогенов типа ННalOn (n = 1÷4) и соответствующие им соли и ангидриды. Такие соедине ния наиболее характерны для хлора, для которого известны четы ре кислоты; сведения о них приведены в таблице. Кислородные кислоты хлора
Сила кислот изменяется весьма существенно в ряду НClО –НClO4. При сравнении окислительной способности вещества всегда нужно учитывать реальные условия протекания процессов. На пример, утверждение, что в ряду кислот НClO –НClO2 — НClO3 ---НClO4 окислительная активность уменьшается от НClО к НClO4, верно только для обычных условий (комнатная температура, дей ствие света). Здесь решающее значение имеет не окислительная способность хлора в положительной степени окисления, а ато марный кислород, выделяющийся при распаде неустойчивых кислот, устойчивость которых на свету как раз возрастает от НClО к НСlO4. Если же сравнивать окислительную способность этих кислот в других условиях — в темноте, при более низких температурах, то окислительная способность возрастает от НClО к НClО4. Из солей кислородсодержащих кислот широко известны бер толетова соль (хлорат калия) KClO3 и хлорная («белильная») из весть. Хлорную известь получают действием хлора на гидроксид кальция: 2Сl2 + Са(ОН)2 = СаСl2 + Са(ОСl)2 + 2Н2О. Полученную смесь солей называют хлорной известью. Если формально просуммировать состав хлорной извести, то его можно выразить формулой СаОСl2, определяющей смешанную соль — хлорид-гипохлорит кальция. Вопрос №32 Аммиак и его производные Аммиа́к — NH3, при нормальных условиях — бесцветный газ с резким характерным запахом (запах нашатырного спирта), почти вдвое легче воздуха, ядовит. Растворимость NH3 в воде чрезвычайно велика. Молекула аммиака имеет вид тетраэдра с атомом азота в вершине. У атома азота есть неподелённая пара электронов. В жидком аммиаке молекулы связаны между собой водородными связями. Этим объясняется сравнительно высокая температура кипения и высокая теплота испарения аммиака. Однако прочность этих связей в жидком аммиаке существенно ниже, чем у воды. Химические свойства Благодаря наличию неподеленной электронной пары во многих реакциях аммиак выступает как нуклеофил или комплексообразователь. Так, он присоединяет протон, образуя ион аммония: NH3 + H+ = NH4+ С кислотами даёт соответствующие соли аммония: NH3 + HNO3 = NH4NO3 Водный раствор аммиака ("нашатырный спирт") имеет слабощелочную реакцию из-за протекания процесса NH3 + H2O = NH4+ + OH- С галогеноалканами вступает в реакцию нуклеофильного присоединения, образуя замещённый ион аммония (способ получения аминов): NH3 + CH3Cl → CH3NH3Cl (гидрохлорид метиламмония). С карбоновыми кислотами, их ангидридами, галогенангидридами, эфирами и другими производными даёт амиды. С альдегидами и кетонами - основания Шиффа, которые возможно восстановить до соответствующих аминов (восстановительное аминирование). Аммиак также является очень слабой кислотой (более слабой, чем вода), способен образовывать с металлами соли - амиды. Аммиак горит в атмосфере кислорода, давая воду и азот. Окисление аммиака воздухом на платиновом катализаторе даёт оксиды азота, что используется в промышленности для получения азотной кислоты. 4NH3 + 3O2 → 2N2 + 6H20 Галогены (хлор, иод) образуют с аммиаком опасные взрывчатые вещества - галогениды азота (хлористый азот, иодистый азот). При 1000°C аммиак реагирует с углем, образуя HCN и частично разлагаясь на азот и водород. Биологическая роль Аммиак является конечным продуктом азотистого обмена в организме человека и животных. Он образуется при метаболизме белков, аминокислот и других азотистых соединений. Он высоко токсичен для организма, поэтому большая часть аммиака в ходе орнитинового цикла конвертируется печенью в более безвредное и менее токсичное соединение — карбамид (мочевину). Мочевина затем выводится почками, причём часть мочевины может быть конвертирована печенью или почками обратно в аммиак. Физиологическое действие Аммиак ядовит. Жидкий аммиак вызывает сильные ожоги. При содержании в воздухе 0,5% по объему аммиак сильно раздражает слизистые оболочки. При остром отравлении поражаются глаза и дыхательные пути. При хроническом отравлении — расстройство пищеварения, катар верхних дыхательных путей, ослабление слуха. В основном используется для производства азотных удобрений (нитрат и сульфат аммония, мочевина), взрывчатых веществ и полимеров, азотной кислоты, соды (по аммиачному методу) и других продуктов химической промышленности. Жидкий аммиак используют в качестве растворителя. В холодильной технике используется в качестве холодильного агента Получение Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота: N2(г) + 3H2(г) ↔ 2NH3(г) + 45,9 кДж Это так называемый процесс Габера (немецкий физик, разработал физико-химический основы метода). Реакция происходит с выделением тепла и понижением объёма. Следовательно, исходя из принципа Ле-Шателье, реакцию следует проводить при возможно низких температурах и при высоких давлениях - тогда равновесие будет смещено вправо. Применение катализатора (пористое железо с примесями Al2O3 и K2O) позволило ускорить достижение равновесного состояния. Учитывая все вышеприведённые факторы, процесс получения аммиака проводят при следующих условиях: температура 500°C, давление 350 атмосфер, катализатор. Выход аммиака при таких условиях составляет около 30%. В промышленных условиях использован принцип циркуляции - аммиак удаляют охлаждением, а непрореагировавшие азот и водород возвращают в колонну синтеза. Это оказывается более экономичным, чем достижение более высокого выхода реакции за счёт повышения давления. Для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония: NH4Cl + NaOH = NH3↑ + NaCl + H2O. Вопрос №33 Азотная кислота и ее соли В лабораторных условиях азотную кислоту можно получить действием концентрированной серной кислоты на нитраты: NaNO3+H2SO4(к)=NaHSO4+HNO3 Реакция протекает при слабом нагревании. Получение азотной кислоты в промышленных масштабах осуществляется каталитическим окислением аммиака кислородом воздуха: 1. Вначале смесь аммиака с воздухом пропускают над платиновым катализатором при 800°С. Аммиак окисляется до оксида азота (II): 4NH3 + 5O2=4NO+6Н2О 2 . При охлаждении происходит дальнейшее окисление NO до NO2: 2NO+O2=2NO2 3. Образующийся оксид азота (IV) растворяется в воде в присутствии избытка О2 с образованием HNO3: 4NO2+2Н2O+O2=4HNO3 Исходные продукты — аммиак и воздух — тщательно очищают от вредных примесей, отравляющих катализатор (сероводород, пыль, масла и т.п.). Образующаяся кислота является разбавленной (40-60%-ной). Концентрированную азотную кислоту (96-98%-ную) получают перегонкой разбавленной кислоты в смеси с концентрированной серной кислотой. При этом испаряется только азотная кислота. Физические свойства Азотная кислота — бесцветная жидкость, с едким запахом. Очень гигроскопична, «дымит» на воздухе, т.к. ее пары с влагой воздуха образуют капли тумана. В HNO3 валентность азота равна 4, степень окисления +5. Электронную структуру азотной кислоты можно вывести так: 1. Атом водорода связывается с атомом кислорода ковалентной связью: 2. За счет неспаренного электрона атом кислорода образует ковалентную связь с атомом азота: 3. Два неспаренных электрона атома азота образуют ковалентную связь со вторым атомом кислорода: 4. Третий атом кислорода, возбуждаясь, образует свободную 2р-орбиталь путем спаривания электронов. Взаимодействие неподеленной пары азота со свободной орбиталью третьего атома кислорода приводит к образованию молекулы азотной кислоты. Химические свойства 1. Разбавленная азотная кислота проявляет все свойства кислот. Она относится к сильным кислотам. В водных растворах диссоциирует: HNO3Н++NO-3 Под действием теплоты и на свету частично разлагается: 4HNO3=4NO2+2Н2O+O2 Поэтому хранят ее в прохладном и темном месте. 2. Для азотной кислоты характерны исключительно окислительные свойства. Важнейшим химическим свойством является взаимодействие почти со всеми металлами. Водород при этом никогда не выделяется. Восстановление азотной кислоты зависит от ее концентрации и природы восстановителя. Степень окисления азота в продуктах восстановления находится в интервале от +4 до -3: HN+5O3 N+4O2HN+3O2 N+2ON+12ON02N-3H4NO3 Продукты восстановления при взаимодействии азотной кислоты разной концентрации с металлами разной активности приведены ниже в схеме. 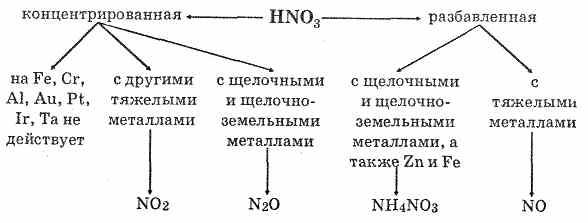 Концентрированная азотная кислота при обычной температуре не взаимодействует с алюминием, хромом, железом. Она переводит их в пассивное состояние. На поверхности образуется пленка оксидов, которая непроницаема для концентрированной кислоты. Примеры: 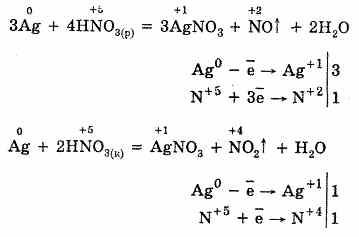 3. Азотная кислота не реагирует с Pt, Rh, Ir, Та, Au. Платина и золото растворяются в «царской водке» — смеси 3 объемов концентрированной соляной кислоты и 1 объема концентрированной азотной кислоты: Au+НNO3+3НСl= AuСl3+NO+2Н2О НСl+AuСl3=H[AuCl4] 3Pt+4HNO3+12НСl=3PtCl4+4NO+8H2O 2HCl+PtCl4=H2[PtCl6] Действие «царской водки» заключается в том, что азотная кислота окисляет соляную до свободного хлора: HNO3+HCl=Сl2+2Н2О+NOCl 2NOCl=2NO+Сl2 Выделяющийся хлор соединяется с металлами. 4. Неметаллы окисляются азотной кислотой до соответствующих кислот, а она в зависимости от концентрации восстанавливается до NO или NO2: S+бНNO3(конц)=H2SO4+6NO2+2Н2ОР+5НNO3(конц)=Н3РO4+5NO2+Н2О I2+10HNO3(конц)=2HIO3+10NO2+4Н2О 3Р+5HNO3(pазб)+2Н2О= 3Н3РО4+5NO 5. Она также взаимодействует с органическими соединениями. Соли азотной кислоты называются нитратами, представляют собой кристаллические вещества, хорошо растворимые в воде. Их получают при действии HNO3 на металлы, их оксиды и гидроксиды. Нитраты калия, натрия, аммония и кальция называются селитрами. Селитры используются главным образом как минеральные азотные удобрения. 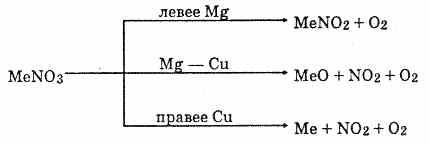 Разложение при нагревании (термолиз) — важное свойство солей азотной кислоты. 2KNO3=2KNO2+O2 2Cu(NO3)2=2CuO+NO2+O2 Соли металлов, расположенных в ряду левее Mg, образуют нитриты и кислород, от Mg до Cu — оксид металла, NO2 и кислород, после Си — свободный металл, NO2 и кислород. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
