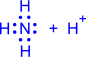Ответы на вопросы по химии. Д. И. Менделеева. Структура периодической системы
 Скачать 0.81 Mb. Скачать 0.81 Mb.
|
   Ответы на вопросы по химии Ответы на вопросы по химииВопрос №1. Периодическая система Д. И. Менделеева. Структура периодической системы. Структура периодической системы Периодическая система химических элементов — это классификация химических элементов, основанная на определенных особенностях строения атомов химических элементов. Она была составлена на основе Периодического закона, открытого в 1869 году Д. И. Менделеевым. В то время Периодическая система включала 63 химических элементов и по виду отличалась от современной. Сейчас в Периодическую систему входят около ста двадцати химических элементов. Периодическую систему составлен в виде таблицы, в которой химические элементы расположены в определенном порядке: по мере роста их атомных масс. Сейчас существует много видов изображения Периодической системы. Наиболее распространенным является изображение в виде таблицы с расположением элементов слева направо. Все химические элементы в Периодической системе объединены в периоды и группы. Периодическая система включает семь периодов и восемь групп. Периодами называют горизонтальные ряды химических элементов, в которых свойства элементов изменяются от типичных металлических к неметаллическим. Вертикальные колонки химических элементов, которые содержат элементы, схожие по химическим свойствам, образуют группы химических элементов. Первый, второй и третий периоды называют малыми, поскольку они содержат небольшое количество элементов (первый — два элемента, второй и третий — по восемь элементов). Элементы второго и третьего периодов называют типовыми, их свойства закономерно изменяются от типичного металла до инертного газа. Все остальные периоды называют большими (четвертый и пятый содержат по 18 элементов, шестой — 32 и седьмой — 24 элемента). Особое сходство свойств проявляют элементы, находящиеся внутри больших периодов, в конце каждого четного ряда. Это так называемые триады: Ферум — Кобальт — Никол, образующих семью железа, и две другие: Рутений — Родий — Палладий и Осмий — Иридий — Платина, которые образуют семью платиновых металлов (платиноидов). В нижней части таблицы Д. И. Менделеева расположены химические элементы, образующие семью лантаноидов и семью актиноидов. Все эти элементы формально входят в состав третьей группы и идут после химических элементов лантана (номер 57) и актиния (номер 89). Периодическая система элементов содержит десять рядов. Малые периоды (первый, второй и третий) состоят из одного ряда, большие периоды (четвертый, пятый и шестой) содержат по два ряда каждый. В седьмом периоде находится один ряд. Каждый большой период состоит из четного и нечетного рядов. В парных рядах содержатся элементы металлы, в нечетных рядах свойства элементов изменяются так, как в типовых элементов, т.е. от металлических до выраженных неметаллических. Каждая группа таблицы Д. И. Менделеева состоит из двух подгрупп: главной и побочной. В состав главных подгрупп входят элементы как малых, так и больших периодов, то есть главные подгруппы начинаются либо с первого, или второго периода. В состав побочных подгрупп входят элементы только больших периодов, т.е. побочные подгруппы начинаются лишь с четвертого периода. Вопрос №2. Окислительно-восстановительные реакции. Основные понятия. Правила составления ОВР. Основные понятия Окислительно-восстановительные реакции сопровождаются переходом электронов от одних участвующих в реакции частиц (атомов, ионов, молекул) к другим. Процесс потери электронов частицей называется ее окислением, а сама частица, теряющая электроны, -восстановителем. Процесс присоединения электронов частицей называется ее восстановлением, а сама частица, принимающая электроны, - окислителем. Таким образом, в ходе окислительно-восстановительной реакции окислитель восстанавливается, а восстановитель окисляется. В химических реакциях окисление одного вещества всегда сопровождается восстановлением другого, и наоборот. Количество электронов, принимаемых окислителем, равно количеству электронов, теряемых восстановителем, поэтому химическая система в целом остается электронейтральной. Это означает, что если мы нашли в уравнении реакции вещество, которое в ходе реакции, например, восстанавливается, то следует искать в том же уравнении вещество, которое в ходе реакции окисляется, и наоборот. Степень окисления – формальная величина, которую вычисляют на основе формулы соединения исходя из условного допущения, что связь между атомами в данном соединении ионная. Несмотря на формальный характер понятия «степень окисления», использование его оказывается весьма продуктивным при рассмотрении окислительно-восстановительных реакций, в частности при нахождении коэффициентов уравнений окислительно-восстановительных реакций. Так как электрон заряжен отрицательно, при окислении степень окисления атома изменяется в положительную сторону, а при восстановлении – в отрицательную. При образовании химической связи между двумя разными атомами во многих случаях происходит не переход электронов, а лишь некоторое смещение электронного облака валентных электронов от одного атома к другому. В высших степенях окисления все атомы вообще склонны образовывать соединения с ковалентной связью, а не ионной. Так, в ионе MnO4¯ связь между атомами кислорода и марганца ковалентная полярная, и заряд на атоме марганца отнюдь не +7 (как формальная степень окисления), а во много раз меньше. Говоря, что степень окисления марганца в таком ионе численно равна +7 и что при восстановлении этого иона до марганца в степени окисления +2 атом марганца принимает пять электронов, мы допускаем очень большую условность. правильнее говорить, что ион MnO4¯ превращается в ион Mn2+ , совершенно не касаясь при этом вопроса о том, какие заряды имеются на атомах марганца и кислорода в ионе MnO4¯. Количество электронов, которое переходит от восстановителя к окислителю при таком превращении, также равно пяти – в этом мы сможем убедиться чуть позже. Таким образом, применяя заведомо условный формальный подход (степень окисления), мы получаем верный количественный результат (количество электронов, получаемых окислителем от восстановителя). Типы окислительно-восстановительных реакций Окислительно-восстановительные реакции можно разделить на три типа: межмолекулярные, внутримолекулярные и реакции диспропорционирования (самоокисления - самовосстановления). Межмолекулярными называются окислительно-восстановительные реакции, в результате которых изменяется степень окисления атомов в разных веществах. Таким образом, в роли окислителя и восстановителя в этом случае выступают разные вещества. Например: 2Ca + O2 = 2CaO Такие окислительно-восстановительные реакции встречаются чаще всего. Окислительно-восстановительные реакции, в результате которых меняется степень окисления разных атомов в одном и том же веществе, называются внутримолекулярными. В этом случае в роли окислителя и восстановителя выступают разные атомы в одном и том же соединении. Например: 2KClO3 = 2KCl + 3O2 Здесь хлор восстанавливается, а кислород окисляется. Окислительно-восстановительные реакции, в ходе которых одновременно понижается и повышается степень окисления одного и того же элемента, называются реакциями диспропорционирования (дисмутации). В таких реакциях в роли окислителя и восстановителя выступают атомы одного и того же элемента. Например: 4KClO3 = KCl + 3KClO4 Реакции диспропорционирования возможны, когда в исходном веществе элемент имеет промежуточную степень окисления. Обратные реакции, в результате которых из двух степеней окисления одного элемента образуется новая степень окисления, промежуточная между исходными, называются реакциями конпропорционирования (конмутации). Вместо терминов «диспропорционирование» и «конпропорционирование» употребляют также термин «самоокисление-самовосстановление». Математический метод на основе материального баланса Элемент во время химических реакций не изменяется. Это утверждение можно представить в виде двух правил закона сохранения количества вещества элемента (материальный баланс): количество вещества каждого элемента до реакции равняется количеству вещества каждого элемента после реакции; общее количество вещества всех элементов до реакции равняется общему количеству вещества всех элементов после реакции. Изложенные правила дают возможность уравнивать уравнения любых реакций (в том числе и окислительно-восстановительных) математическим методом. Для этого необходимо записать уравнение реакции в общем виде, на основе материального баланса составить систему математических уравнений и решить ее. Пример: xH2 + yO2 = zH2O, где x, y, z – коэффициенты, показывающие число молекул (количество вещества) водорода, кислорода и воды, участвующие в реакции. Коэффициенты – целые положительные числа. Записывается уравнение закона сохранения количества вещества для каждого элемента: для H: 2x = 2z => x=z. для O: 2y = z => y=0,5z. Подставляются полученные значения для x, y в уравнение: zH2 + 0,5zO2=zH2O Выносится общий множитель 0,5z и сокращается на него. Получается: 2H2+O2=2H2O Правило второго закона сохранения количества вещества элемента можно использовать для проверки правильности выполненной работы: 2∙2+1∙2=2∙(2+1); 6=6. Метод электронного баланса Метод электронного баланса уравнивания окислительно-восстановительных реакций заключается в выполнении следующего правила: число электронов, отданных всеми частицами восстановителей, всегда равно числу электронов, присоединенных всеми частицами окислителей в данной реакции. Уравнивание ОВР этим методом требует знания формул исходных веществ и продуктов реакции, умения рассчитывать степени окисления элементов в молекулах и ионах и строгого соблюдения очередности действий. Пример: окисление сульфита калия дихроматом калия в кислой среде. 1. Сначала определяют изменяющиеся степени окисления элементов: K2Cr2+6O7 + K2S+4O3 + H2SO4 => Cr2+3(SO4)3 + K2S+6O4 + H2O 2. Затем составляется электронный баланс. Для этого подсчитывают число электронов, которое нужно присоединить всеми атомами окислителя входящими в состав молекулы-окислителя, и прибавляют их число в левой части схемы процесса восстановления. В результате получаем: 2 Cr+6 + 6e- = 2 Cr+3 | 1 S+4 - 2e- = S+6 | 3 Полученные коэффициенты ставим перед окислителем и восстановителем в левой части уравнения и перед продуктами их восстановления и окисления – в правой части уравнения: K2Cr2O7 + 3K2SO3 + H2SO4 => Cr2(SO4)3 + 3K2SO4 + H2O 4. Уравнивают ионы веществ, не изменяющие своей степени окисления, и подбирают недостающие коэффициенты: K2Cr2O7 + 3K2SO3 + 4H2SO4 => Cr2(SO4)3 + 4K2SO4 + 4H2O Метод электронно-ионного баланса (метод полуреакций) Метод применяется для уравнивания реакций, протекающих в растворах. При этом отпадает необходимость в определении степеней окисления. Часто при уравнивании этим методом сначала неизвестны и продукты реакции – они выявляются в ходе самого уравнивания. Однако для правильного применения этого метода необходимо уметь записывать ионно-молекулярные реакции. Вопрос №3. Кислородные соединения азота. С кислородом азот образует ряд оксидов: N2О и NО - бесцветные газы, N2О3 голубое твердое вещество (ниже -100 град.С), NО2 - бурый газ, N2О4 - бесцветный газ, N2О5 - бесцветные кристаллы. Оксид N2О (закись азота, "веселящий газ", поскольку он обладает наркотическим действием) получают термическим разложением нитрата аммония или гидроксиламмония: [НN3ОН]NО2 = N2О + 2Н2О (внутримолекулярное конпропорционирование) Оксид азота (+1) - эндотермическое соединение. Однако при комнатной химически температуре мало активен. При нагревании его реакционная способность сильно возрастает. Он окисляет водород, металлы, фосфор, серу, уголь, органические и другие вещества, например: Сu + N2О = N2 + СuО При нагревании N2О выше 700 град.С одновременно с реакцией разложения протекает его диспропорционирование: 2N2О = 2N2 + О2; 2N2О = 2NО + N2 С водой оксид азота (+1) не взаимодействует, хотя известна кислота Н2N2О2, в которой азот тоже имеет степень окисления +1. Эта кислота называется азотноватистой. Свободную азотноватистую кислоту можно получить следующим образом: NН2ОН + НNО2 = Н2N2О2 + Н2О Она хорошо растворяется в воде, но кислота слабая. Азотноватистая кислота весьма неустойчива, при незначительном нагревании взрывается: Н2N2О2 = N2О + Н2О Соли Н2N2О2 - гипонитриты и гидрогипонитриты - в воде сильно подвержены гидролизу. Большинство гипонитритов мало растворимо в воде, намного лучше растворяются гидрогипонитриты. Четные степени окисления для азота сравнительно мало характерны. К числу таких соединений относится оксид азота (+2). Молекула NО содержит нечетное число электронов и, по существу, представляет собой обладающий малой активностью радикал. В молекуле одна ковалентная по донорно-акцепторному механизму и две П-связи. Несмотря на эндотермичность и положительную величину энергии Гиббса образования NО из простых веществ, оксид азота (+2) не распадается на элементы. Дело в том, что, согласно ММО, порядок связи в NО довольно высок и равен 2,5. Молекула NО прочнее молекулы О2, так как у первой на разрыхляющей МО П2р* всего один электрон, а у второй - два электрона. В лаборатории оксид азота (+2) чаще всего получают действием разбавленной кислоты на медные стружки: 3Сu + 8НNО3 = 3Сu(NО3)2 + 2NО + 4Н2О На воздухе оксид азота (+2) мгновенно окисляется: 2NО + О2 = 2NО2 Окисляется NО и галогенами, образуя нитрозилгалогениды: 2NО + Г2 = 2NОГ При взаимодействии с восстановителями NО восстанавливается до N2О, N2, NН2ОН, NН3 в зависимости от восстановительной способности партнера и условий провидения процессов Водный раствор оксида азота (+2) нейтрален. Никаких соединений с водой он не образует, хотя известны соли (гипонитраты) не выделенной в свободном состоянии азотноватой кислоты Н2N2О3, в которой азот также имеет степень окисления +2. Оксид азота N2О3 существует в твердом состоянии (ниже -100 град.С). В жидком и парообразном состояниях оксид азота (+3) в значительной степени диссоциирован за счет диспропорционирования: N2О3 NО + NО2 Получают N2О3 охлаждением эквимолярных количеств NО и NО2. А равномерный ток смеси нужного состава получается при взаимодействии 50%-ной НNО3 с оксидом мышьяка (+3): 2НNО3 + Аs2О3 = 2НАsО3 + NО + NО2 Оксиду азота (+3) отвечает известная лишь в растворе неустойчивая азотистая кислота НNО2. Получить ее можно растворением в воде равных объемов NО и NО2 в воде: NО + NО2 + Н2О = 2НNО2 При хранении и нагревании НNО2 диспропорционирует: 3НNО2 = НNО3 + 2NО + Н2О Наиболее характерные для нее окислительные свойства: НNО2 + 2НI = I2 + 2NО + 2Н2О Однако сильные окислители переводят азотистую кислоту в азотную: 5НNО2 + 2КмnО4 + 3Н2SО4 = К2SО4 + 2МnSО4 + 5НNО3 + 3Н2О Оксид азота (+4) получают растворением меди в концентрированной азотной кислоте: Сu + 4НNО3 = Сu(NО3)2 + 2NО2 + 2Н2О Он является хорошим окислителем, в нем горят фосфор, сера, уголь и некоторые органические вещества. Выше 150 град.С диоксид азота начинается разлагаться: 2NО2 = 2NО + О2 Поскольку молекула диоксида азота с неспаренным электроном по существу представляет собой радикал, она легко димеризуется: 2NО2 N2О4. Димер бесцветен и диамагнитен в отличие от окрашенного в красно-бурый цвет и парамагнитен. Диоксид азота при взаимодействии с водой диспропорционирует: 2NО2 + Н2О = НNО2 + НNО3 При растворении NО2 в горячей воде получается азотная кислота, ибо первоначально образующаяся азотиста кислота диспропорционирует с выделением оксида азота (+2) и образованием азотной кислоты. Оксид азота (+5) имеет молекулярную структуру только в газовой фазе. В твердом состоянии N2О5 имеет структуру, образованную ионами NО2+ и NО3-. N2О5 - легко возгоняющиеся кристаллы, причем испаряются молекулы. Таким образом, при возгонке оксида азота (+5) ионы NО2+ и NО3- объединяются в молекулы N2О5 . Получают оксид Вопрос №4 Типы химической связи: ковалентная, ионная. Полярность связи. КОВАЛЕНТНАЯ СВЯЗЬ Осуществляется за счет электронной пары, принадлежащей обоим атомам. Различают обменный и донорно-акцепторный механизм образования ковалентной связи. 1) Обменный механизм. Каждый атом дает по одному неспаренному электрону в общую электронную пару:
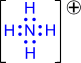
2) Донорно-акцепторный механизм. Один атом (донор) предоставляет электронную пару, а другой атом (акцептор) предоставляет для этой пары свободную орбиталь;
Два атома могут обобществлять неcколько пар электронов. В этом случае говорят о кратных связях:
Если электронная плотность расположена симметрично между атомами, ковалентная связь называется неполярной. Если электронная плотность смещена в сторону одного из атомов, то ковалентная связь называется полярной. Полярность связи тем больше, чем больше разность электроотрицательностей атомов. |