Ответы на вопросы по химии. Д. И. Менделеева. Структура периодической системы
 Скачать 0.81 Mb. Скачать 0.81 Mb.
|
|
| ||||||||||
| | ||||||||||
|
и реакции типа
| | | |
Окислителями и восстановителями являются соединения, в которых элементы находятся в неустойчивых степенях окисления и в ходе реакции переходят в более устойчивые. Так, для элементов IVА подгруппы стабильность степени окисления +2 увеличивается с ростом порядкового номера. Если Ge +2 – сильный восстановитель, то Pb +4 – энергичный окислитель.
Окислительная активность Pb +4 проявляется в реакции при разрядке свинцового аккумулятора
| | | |
Элементы-органогены
Углерод, Водород, Азот, Кислород
макроэлементы(содержание которых в живых организмах составляет больше 0,01 %):
Калий, Кальций, Магний, Натрий, Сера, Фосфор, Хлор
микроэлементы (содержание менее 0,001 %):
Бром, Железо, Йод, Кобальт, Марганец, Медь, Молибден, Селен, Фтор, Хром, Цинк
В Химическом составе живого:
атом углерода – главный элемент живого,
уникальные особенности атома углерода:
- способность атомов связываться друг с другом с образованием разнообразных структур, являющихся несущей основой органических молекул
- способность связываться с другими атомами близких радиусов (кислородом, азотом, серой) с образованием менее прочных связей (возникновение функциональных групп), которые обусловливают химическую активность органических соединений
Химический состав живого:
вода, роль для живой природы:
- высокая полярность воды и как следствие – химическая активность и высокая растворяющая способность
- высокая теплоемкость воды, высокие теплоты испарения и плавления – основа для поддержания температурного гомеостаза живых организмов и регулирования тепла планеты
- аномальная плотность в твердом состоянии – причина существования жизни в замерзающих водоемах
- высокое поверхностное натяжение – жизнь на поверхности гидросферы, передвижение растворов по сосудам растений
Химический состав живого:
особенности органических биополимеров как высокомолекулярных соединений –
-высокая молекулярная масса,
-способность образовывать пространственные и надмолекулярные структуры, -разнообразие строения и свойств
возникновение жизни в целом связано со спонтанным нарушением имевшейся до того в природе зеркальной симметрии.
Хиральность—свойство молекулы быть несовместимым со своим зеркальным отражением
Вопрос №13
Степень окисления элементов, методы определения.
Степень окисления - это приписываемая одному либо нескольким атомам численная величина, характеризующая количество перераспределяемых электронов и показывающая, каким образом эти электроны распределяются между атомами при реакции.
Степень окисления атомов вне химического соединения равна нулю. Это правило справедливо как для веществ, образованных из отдельных свободных атомов, так и для таких, которые состоят из двух- либо многоатомных молекул одного элемента.
Например, Al(s) и Cl2 имеют степень окисления 0, поскольку оба находятся в химически несвязанном элементарном состоянии.
Аллотропная форма S8, или октасера, несмотря на свое нетипичное строение, также характеризуется нулевой степенью окисления.
Степень окисления ионов равняется их заряду. Это справедливо как для свободных ионов, так и для тех, которые входят в состав химических соединений.
Например, степень окисления иона Cl- равняется -1.
Степень окисления иона Cl в составе химического соединения NaCl также равна -1. Поскольку ион Na, по определению, имеет заряд +1, мы заключаем, что заряд иона Cl -1, и т.о. степень его окисления -1.
Атомы многих металлических элементов могут ионизироваться на разные величины. Например, заряд ионов такого металла как железо (Fe) равняется +2 либо +3. Заряд ионов металла (и их степень окисления) можно определить по зарядам ионов других элементов, с которыми данный металл входит в состав химического соединения; в тексте этот заряд обозначается римскими цифрами: так, железо(III) имеет степень окисления +3.
Почти во всех случаях атомы кислорода имеют степень окисления -2. Есть несколько исключений из этого правила:
Если кислород находится в элементарном состоянии (O2), его степень окисления равна 0, как и в случае других элементарных веществ.
Если кислород входит в состав перекиси, его степень окисления равна -1. Перекиси - это группа соединений, содержащих простую кислород-кислородную связь (т.е. анион перекиси O2-2). В соединении с фтором кислород обладает степенью окисления +2.
Степень окисления водорода равна +1 (если он не находится в элементарном состоянии H2). Однако в соединениях, называемых гидридами, степень окисления водорода составляет -1.
Степень окисления фтора неизменно составляет -1. Это объясняется тем, что данный элемент имеет наибольшую электроотрицательность.
Степени окисления всех атомов, входящих в химическое соединение, в сумме должны давать заряд этого соединения.
Вопрос №14
Периодические свойства элементов: энергия ионизации, сродство к электрону, электроотрицательность, атомные радиусы.
а) Размеры атомов и ионов. Вследствие волновой природы электрона * атом не имеет строго определенных границ. Радиусы атомов и ионов являются условными величинами. Их обычно вычисляют из межатомных расстояний, которые зависят не только от природы атомов, но также и от вида химической связи между ними.
Зависимость атомных радиусов (r) от заряда ядра (Z) имеет периодический характер. В пределах одного периода с увеличением Zпроявляется тенденция к уменьшению размеров атомов. Например, во втором периоде атомные радиусы имеют следующие значения:
| | Li | Be | B | C | N | O | F |
| r, нм | 0,155 | 0,113 | 0,091 | 0,077 | 0,071 | 0,066 | 0,064 |
Это объясняется увеличением притяжения электронов внешнего слоя к ядру по мере возрастания заряда ядра. В подгруппах сверху вниз атомные радиусы возрастают, т.к. увеличивается число электронных слоев:
| | r, нм | | r, нм |
| Li | 0,155 | N | 0,071 |
| Na | 0,189 | P | 0,130 |
| K | 0,236 | As | 0,148 |
| Rb | 0,248 | Sb | 0,161 |
| Cs | 0,268 | Bi | 0,182 |
Потеря атомом электронов приводит к уменьшению его эффективных размеров, а присоединение избыточных электронов – к увеличению. Поэтому радиус положительного иона (катиона) всегда меньше, а радиус отрицательного иона (аниона) всегда больше, чем радиус соответствующего электронейтрального атома. Например:
| | r, нм | | r, нм |
| K0 | 0,236 | Cl0 | 0,099 |
| K+ | 0,133 | Cl– | 0,181 |
Радиус иона тем сильнее отличается от радиуса атома, чем больше заряд иона:
| | Cr0 | Cr2+ | Cr3+ |
| r, нм | 0,127 | 0,083 | 0,064 |
В пределах одной подгруппы радиусы ионов одинакового заряда возрастают с увеличением заряда ядра:
| | r, нм | | r, нм |
| Li+ | 0,068 | F– | 0,133 |
| Na+ | 0,098 | Cl– | 0,181 |
| K+ | 0,133 | Br– | 0,196 |
| Rb+ | 0,149 | I– | 0,220 |
Такая закономерность объясняется увеличением числа электронных слоев и растущим удалением внешних электронов от ядра.
б) Энергия ионизации и сродство к электрону. В химических реакциях ядра атомов не подвергаются изменению, электронная же оболочка перестраивается, причем атомы способны превращаться в положительно и отрицательно заряженные ионы. Эта способность может быть количественно оценена энергией ионизации атома и его сродством к электрону.
Энергией ионизации (потенциалом ионизации) I называется количество энергии, необходимое для отрыва электрона от невозбужденного атома с образованием катиона:
X – e → X+
Энергия ионизации измеряется в кДж/моль или в электронвольтах (эВ). Отрыв второго электрона происходит труднее, чем первого, т.к. второй электрон отрывается не от нейтрального атома, а от положительного иона:
X+ – e → X2+
Поэтому второй потенциал ионизации I2 больше, чем первый (I2>I1). Очевидно, что удаление каждого следующего электрона будет требовать больших энергетических затрат, чем удаление предыдущего. Для характеристики свойств элементов обычно принимают во внимание энергию отрыва первого электрона.
В группах потенциал ионизации уменьшается с увеличением атомного номера элемента:
| | Li | Na | K | Rb | Cs |
| I, эВ | 6,39 | 5,14 | 4,34 | 4,18 | 3,89 |
Это связано с большей удаленностью валентных электронов от ядра и, следовательно, с их более легким отрывом по мере увеличения количества электронных слоев. Величина потенциала ионизации может служить мерой “металличности” элемента: чем меньше потенциал ионизации, тем легче удалить электрон из атома, тем сильнее выражены металлические свойства.
В периодах слева направо заряд ядра возрастает, а радиус атома уменьшается. Поэтому потенциал ионизации постепенно увеличивается, а металлические свойства ослабевают:
| | Li | Be | B | C | N | O | F | Ne |
| I, эВ | 5,39 | 9,32 | 8,30 | 11,26 | 14,53 | 13,61 | 17,42 | 21,56 |
Нарушение тенденции возрастания I наблюдается для атомов с целиком заполненным внешним энергетическим подуровнем, либо для атомов, у которых внешний энергетический подуровень заполнен ровно наполовину:
Это свидетельствует о повышенной энергетической устойчивости электронных конфигураций с полностью или ровно наполовину занятыми подуровнями.
Степень притяжения электрона к ядру и, следовательно, потенциал ионизации зависят от ряда факторов, и прежде всего от заряда ядра, от расстояния между электроном и ядром, от экранирующего влияния других электронов. Так, у всех атомов, кроме элементов первого периода, влияние ядра на электроны внешнего слоя экранировано электронами внутренних слоев.
Поле ядра атома, удерживающее электроны, притягивает также и свободный электрон, если он окажется вблизи атома. Правда, этот электрон испытывает отталкивание со стороны электронов атома. Для многих атомов энергия притяжения дополнительного электрона к ядру превышает энергию его отталкивания от электронных оболочек. Эти атомы могут присоединять электрон, образуя устойчивый однозарядный анион. Энергию отрыва электрона от отрицательного однозарядного иона в процессе X– – e → X0 называют сродством атома к электрону (A), измеряемым в кДж/моль или эВ . При присоединении двух и более электронов к атому отталкивание преобладает над притяжением – сродство атома к двум и более электронам всегда отрицательно. Поэтому одноатомные многозарядные отрицательные ионы (O2–, S2–, N3– и т.п.) в свободном состоянии существовать не могут.
Сродство к электрону известно не для всех атомов. Максимальным сродством к электрону обладают атомы галогенов.
в) Электроотрицательность. Эта величина характеризует способность атома в молекуле притягивать к себе связующие электроны.Электроотрицательность не следует путать со сродством к электрону: первое понятие относится к атому в составе молекулы, а второе – к изолированному атому. Абсолютная электроотрицательность (кДж/моль или эВ ) равна сумме энергии ионизации и сродства к электрону: АЭО=I+A. На практике часто применяется величина относительной электроотрицательности, равная отношению АЭО данного элемента к АЭО лития (535 кДж/моль):
Электроотрицательность уменьшается сверху вниз по группе и увеличивается слева направо по периоду. Ниже приведены относительныеэлектроотрицательности некоторых элементов.
| | Li | Be | B | C | N | O | F |
| ОЭО | 1,0 | 1,5 | 2,0 | 2,5 | 3,1 | 3,5 | 4,0 |
| | Na | K | Rb | Cs |
| ОЭО | 0,9 | 0,8 | 0,8 | 0,7 |
| | Cl | Br | I |
| ОЭО | 3,0 | 2,8 | 2,6 |
Наибольшее значение электроотрицательности имеет фтор, наименьшее – цезий. Водород занимает промежуточное положение, т.е. при взаимодействии с одними элементами (например, с F) он отдает электрон, а при взаимодействии с другими (например, с Rb) – приобретает электрон.
г) Окислительно-восстановительные свойства нейтральных атомов. Эти свойства определяются значениями энергии ионизации и сродства к электрону. Восстановительные свойства проявляет атом, отдающий электрон, а окислительные – атом, принимающий электрон. В периоде слева направо восстановительные свойства ослабевают, т.к. потенциал ионизации возрастает. В подгруппах сверху вниз восстановительные свойства нейтральных атомов усиливаются, поскольку потенциал ионизации в этом направлении уменьшается. Окислительные свойства, напротив, усиливаются слева направо в периоде и ослабевают сверху вниз в подгруппе, что связано с тенденциями в изменении сродства к электрону.
д) Кислотно-основные свойства соединений. Свойства оксидов и гидроксидов элементов зависят главным образом от заряда и радиуса центрального атома. С ростом положительного заряда (точнее, степени окисления) центрального атома кислотный характер этих соединений становится более выраженным:
| Na+ | Mg2+ | Al3+ | Si4+ | P5+ | S6+ | Cl7+ |
| Na2O | MgO | Al2O3 | SiO2 | P2O5 | SO3 | Cl2O7 |
| NaOH | Mg(OH)2 | Al(OH)3 | H2SiO3 | H3PO4 | H2SO4 | HClO4 |
| основные | амфотерный | слабо кислотный | среднекислотный | сильно кислотные | ||
Сверху вниз в подгруппе при одинаковости заряда (степени окисления) центрального атома с увеличением его радиуса кислотные свойства оксидов и гидроксидов ослабевают, а основные – усиливаются:
| B3+ | H3BO3 | слабая кислота |
| Al3+ Ga3+ In3+ | Al(OH)3 Ga(OH)3 In(OH)3 | амфотер- ные гидрок- сиды |
| Tl3+ | Tl(OH)3 | более выражены основные свойства |
Аналогичный пример можно привести для кислородсодержащих кислот элементов VI группы: сила кислот убывает в ряду H2SO4, H2SeO4, H2TeO4.
Вопрос №15
Фосфор, соединения фосфора с неметаллами и металлами.
Представитель главной подгруппы V группы Периодической системы — элемент-неметалл фосфор Р. Атомы фосфора по сравнению с атомами азота имеют больший радиус, меньшее значение электроотрицательности, а значит, более выраженные восстановительные свойства. Соединения со степенью окисления -3 атома фосфора встречаются реже, чем у азота (только в фосфидах — соединениях фосфора с металлами, например Са3Р2, Nа3Р). Чаще фосфор проявляет в соединениях степень окисления +5. А вот его соединение с водородом — фосфин РН3 — тот редкий случай, когда ковалентная связь между атомами разных элементов неполярна в силу того, что электроотрицательности фосфора и водорода имеют почти одинаковые значения.
Фосфор — простое вещество. Химический элемент фосфор образует несколько аллотропных модификаций. Из них вы уже знаете два простых вещества: белый фосфор и красный фосфор.
Белый фосфор имеет молекулярную кристаллическую решетку, состоящую из молекул Р4. Нерастворим в воде, хорошо растворяется в сероуглероде. На воздухе легко окисляется, а в порошкообразном состоянии даже воспламеняется.
Белый фосфор очень ядовит. Особым свойством его является способность светиться в темноте вследствие его окисления. Хранят его под водой.
Красный фосфор представляет собой темно-малиновый порошок. Не растворяется ни в воде, ни в сероуглероде. На воздухе окисляется медленно и не самовоспламеняется. Неядовит и не светится в темноте.
При нагревании красного фосфора в пробирке, закрытой ватным тампоном, он превращается в белый фосфор (концентрированные пары), и если выдернуть тампон, белый фосфор вспыхнет на воздухе (рис. 35). Этот опыт показывает огнеопасность белого фосфора.
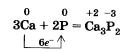
Химические свойства красного и белого фосфора близки, но белый фосфор более химически активен. Так, оба они, как и положено неметаллам, взаимодействуют с металлами, образуя фосфиды:
Белый фосфор самовоспламеняется на воздухе, а красный горит при поджигании. В обоих случаях образуется оксид фосфора^), выделяющийся в виде густого белого дыма:
4Р + 502 = 2Р205
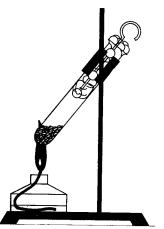
Рис. 35. Опыт, иллюстрирующий переход красного фосфора в белый
С водородом фосфор непосредственно не реагирует, фосфин РН3 можно получить косвенно, например из фосфидов:
Са3Р2 + 6НСl = ЗСаСl2 + 2РН3
Фосфин — очень ядовитый газ с неприятным запахом. Легко воспламеняется на воздухе. Это свойство фосфина и объясняет появление болотных блуждающих огней.
Соединения фосфора. При горении фосфина или фосфора образуется, как вы уже знаете, оксид фосфора Р205 — белый гигроскопичный порошок. Это типичный кислотный оксид, обладающий всеми свойствами кислотных оксидов.
Оксиду фосфора соответствует фосфорная кислота Н3Р04. Она представляет собой твердое прозрачное кристаллическое вещество, хорошо растворимое в воде в любых соотношениях. Как трехосновная кислота, Н3Р04 образует три ряда солей:
средние соли, или фосфаты, например Са3(Р04)2, которые нерастворимы в воде, кроме фосфатов щелочных металлов;
кислые соли — дигидрофосфаты, например Са(Н2Р04)2, большинство из которых хорошо растворимы в воде;
кислые соли — гидрофосфаты, например СаНР04, которые мало растворимы в воде (кроме фосфатов натрия, калия и аммония), т. е. занимают промежуточное положение между фосфатами и гидрофосфатами по растворимости.
В природе фосфор в свободном виде не встречается — только в виде соединений. Важнейшими природными соединениями фосфора являются минералы фосфориты и апатиты. Основную их массу составляет фосфат кальция Са3(Р04)2, из которого и получают в промышленности фосфор.
Биологическое значение фосфора. Фосфор является постоянной составной частью тканей организмов человека, животных и растений. В организме человека большая часть фосфора связана с кальцием. Для построения скелета ребенку требуется столько же фосфора, сколько и кальция. Кроме костей, фосфор содержится в нервной и мозговой тканях, крови, молоке. В растениях, как и у животных, фосфор входит в состав белков.
Из фосфора, поступающего в организм человека с пищей, главным образом с яйцами, мясом, молоком и хлебом, строится АТФ — аденозинтрифосфорная кислота, которая служит собирателем и носителем энергии, а также нуклеиновые кислоты — ДНК и РНК, осуществляющие передачу наследственных свойств организма. Наиболее интенсивно АТФ расходуется в активно работающих органах тела: в печени, мышцах, мозгу. Недаром знаменитый минералог, один из основоположников науки геохимии, академик А. Е. Ферсман назвал фосфор «элементом жизни и мысли».
Как было указано, фосфор существует в природе в виде соединений, содержащихся в почве (или растворенных в природных водах). Из почвы фосфор извлекается растениями, а животные получают фосфор с растительной пищей. После отмирания растительных и животных организмов фосфор снова переходит в почву. Так осуществляется круговорот фосфора в природе (рис. 36).
Применение фосфора и его соединений. Красный фосфор используют для производства спичек, фосфорной кислоты, которая, в свою очередь, идет на производство фосфорных удобрений и кормовых добавок для животноводства. Кроме того, фосфор применяют для получения ядохимикатов (вспомните баллончики с дихлофосом, хлорофосом и др.).
Открытие фосфора. Фосфор был открыт немецким алхимиком Г. Брандом в 1669 г. и получил свое название за его способность светиться в темноте (греч. фосфор — светоносный).
Вопрос №16
Двойственная природа электрона. Орбиталь.
Двойственность свойств электрона проявляется в том, что он, с одной стороны, обладает свойствами частицы (имеет определенную массу покоя), а с другой - его движение напоминает волну и может быть описано определенной амплитудой, длиной волны, частотой колебаний и др. Поэтому нельзя говорить о какой-либо определенной траектории движения электрона - можно лишь судить о той или иной степени вероятности его нахождения в данной точке пространства.
Следовательно, под электронной орбитой следует понимать не определенную линию перемещения электрона, а некоторую часть пространства вокруг ядра, в пределах которого вероятность пребывания электрона наибольшая. Иными словами, электронная орбита не характеризует последовательность перемещения электрона от точки к точке, а определяется вероятностью нахождения электрона на определенном расстоянии от ядра.
Волновая функция.
Шредингер, основываясь на постулате Де Бройля (Любая движущиеся частица обладает волновыми свойствами и может быть охарактеризована длиной волны и частотой), принципе неопределенности Гейзенберга (Невозможно одновременно с высокой степенью точности устанавливать координаты местоположения и величину скорости движения микрочастицы, для которой присущи корпускулярно-волновые свойства) и законе сохранения энергии электрона (е) в атоме составил уравнение и решил его для простейшего атома H. Решениями уравнения Шредингер являются энергии е в атоме и "волновые" функции, зависящие от координат.
Волновая функция (ψi) не имеет определенного физического смысла, но квадрат волновой функции (ψi2) - это плотность вероятности нахождения е в точке с координатами (x,y,z) или плотность отрицательного заряда электронного облака в данной точке ψi2∙ dV - вероятность нахождения e в объеме dV.
Требования: волновая функция непрерывная, однозначная, ограниченная. В результате точного решения уравнения Шредингера оказалось, что каждой волновой
функции соответствует набор 3х целочисленных параметров - n, l, m – квантовых чисел. Шредингер рассчитал вероятность (W) нахождения на расстоянии r от ядра в основном состоянии атома водорода или, иначе, распределение электронной плотности в атоме водорода в основном состоянии.
