|
|
Ответы на вопросы по химии. Д. И. Менделеева. Структура периодической системы
Большинство солей растворимо в воде. К нерастворимым относят LiCO 3, KClO 4, ЭCO 3, ЭSO 4, Э 3(PO 4) 2 (Э = Ca, Sr, Ba), некоторые ЭF 2. Оксиды, пероксиды, гипероксиды (супероксиды)
Оксиды щелочных металлов (кроме Li2O) получают косвенно.
Оксид лития- непосредственным взаимодействием лития с избыт�ком кислорода:
4Li + O22Li2O
Оксид натрия. Без нагревания. При окислении натрия фактически идут две реакции:
1. 2Na + O2Na2O2- быстро
2. 4Na + O22Na2O - медленно
При более высоких температурах (400 °С и 12,2 МПа) получается гипероксид натрия:
Na2O2+ O22NaO2
При более низкой температуре образуется смесь:
Na2O; Na2O2; и NaO2.
Оксид натрия можно получить сплавлением Na2O2с ме�таллическим натрием в присутствии кислорода:
Na2O2+ 2Na 2Na2O
В отличие от лития и натрия, другие металлы этой подгруппы образуют при сгорании в избытке кислорода гипероксиды:
K + O2=KO2 (или K2O4).
Оксид калия получают аналогично оксиду натрия:
K2O2+ 2K 2K2O (сплавление в присутствии О2),
или по реакции: KO2+ 3K 2K2O.
Кислородные соединения Rb и Cs по свойствам и по составу подобны соединениям калия.
Оксиды Li2O и Na2O – бесцветны, K2O и Rb2O – желтые, Cs2O - оранжевый.
Пероксиды и гипероксиды (супероксиды) щелочных металлов являются сильными окислителями:
4KO2+ 2C2K2CO3+ O2
Пероксид натрия применяют для отбеливания соломы, шерсти, шелка. Одно из важнейших свойств пероксидов - способность поглощать CO2и выде�лять кислород - используется в системах жизнеобеспечения в замкнутых помещениях (подводных лодках, космических кораблях):
2Na2O2+ 2CO22Na2CO3+ O2
Пероксиды s-элементов I группы взаимодействуют с кислотами с обра�зованием пероксида водорода:
Me2O2+ 2H+2Me++ H2O2.
Растворяясь в воде, они подвергаются почти полному гидролизу:
Na2O2+ 2H2O2NaOH + H2O2.
Во влажном воздухе разлагаются:
2Li2O22Li2O + O2.
Гидроксиды щелочных металлов
Гидроксиды щелочных металлов: LiOH, NaOH, KOH, RbOH, CsOH, FrOH - бесцветные кристаллические вещества, гигроскопичны и хорошо (за исключением LiOH) растворяются в воде с выделением тепла.
Их называют щелочами. Водные растворы щелочей - сильные электро�литы: MeOH Me++ OH-.
NaOH – гидроксид натрия (едкий натр) - бесцветные, непрозрачные гранулы, пластинки или чешуйки, очень гигроскопичны, хорошо растворяются в воде с сильным разогреванием раствора. Благодаря быстрому поглощению влаги NaOH, как и КОН, используется в твердом виде в качестве осушителей газов. Водный растворNаOH– сильное основание (щелочь). Гидроксид натрия является важным продуктом химической и фармацевтической промышленности, используется для получения лекарств, солей (Na2CO3;NaHCO3и др.), в производстве мыла, моющих средств и для других целей. Получают NaOH электролизом водного раствора хлорида натрия, или известковым методом:
KOH - гидроксид калия (едкое кали)- это белая, гигро�скопичная кисталлическая масса, хорошо растворяется в воде с сильным разогре�ванием. Многие свойства КОН такие же как у NaOH. Его применяют для получения солей, жид�ких мыл, моющих средств.
Соли щелочных металлов
Щелочные металлы образуют соли практически со всеми кислотами. В большинстве своем это бесцветные кристаллические вещества с ион�ной химической связью. В воде и в расплавах это сильные электролиты, большинство из них хорошо растворяется в воде. Галогениды щелочных металлов находят широкое применение в про�мышленности как исходные вещества для получения многих других соединений. NaCl используют как консервирующее средство; в производстве мыла, органических красителей, в керамической промышленности. Смесь NaCl со льдом в соотношении 3,5:1 понижает температуру до -21°С.
Сульфатыs-элементов I группы - бесцветные кристаллические вещества, хорошо растворимы в воде. В их ионных кристаллических решетках находятся тетраэдрические ионы – SO42-.
Сульфат натрия кристаллизуется с десятью молекулами воды: Na2SO410H2O (глауберова соль), обладает слабительным действием. Сульфат натрия применяется в производстве вискозного волокна, стекла, фармацевтических препаратов и др.
Карбонаты- бесцветные кристаллические вещества, в их ионных кристаллических решетках находятся треугольные ионы -CO32-. Карбонаты щелочных металлов, кроме Li2CO3, который при нагревании разлагается до точки плавления:
Li2CO3Li2O + CO2,
плавятся без разложения при 800-900 °С и хорошо растворяются в воде.
В водном растворе карбонаты взаимодействуют с CO2, образуя гидрокарбонаты, среди которых NaHCO3менее растворим в воде, чем гидрокарбонаты остальных щелочных металлов.
При обычной температуре гидрокарбонаты устойчивы (LiHCO3в кристаллическом состоянии не известен), но при нагревании легко переходят в средние соли угольной кислоты:
2MeHCO3Me2CO3+ CO2+ H2O
Нитраты- бесцветные хорошо растворимые в воде кристалли�ческие вещества, в их ионных кристаллических решетках находятся треугольные ионы – NO3-. Из всех нитратов только LiNO3образует кристаллогидрат: LiNO33H2O.
NaNO3- белые гигроскопичные кристаллы, хорошо растворяются в воде.
Соединения s-элементов II группы
Гидриды. Гидриды Be и Mg термически менее устойчивы, чем LiH, но MgH2 более устойчив, чем гидрид алюминия. Гидриды щелочноземельных металлов имеют солеобразный характер, легко окисляются кислородом: MeH2+ O2Me(OH)2.
Они - сильные восстановители, реагируют с водой:
MeH2 + H2O Me(OH)2 + H2
Соединения с кислородом. При горении все s-металлы II груп�пы (кроме бериллия) образуют оксиды:
2Me + O22MeO
Все оксиды порошкообразные вещества белого цвета, имеют солеобразный характер (ионный тип). Все оксиды имеют основной характер (кроме BeO - амфотерный), поэтому взаимодействуют с кислотами и кислотными оксидами:
MeO + 2H+ Me2+ + H2O
CaO + SiO2 CaSiO3
BeO реагирует с кислотами и щелочами:
BeO + 2HCl + 3H2O [Be(H2O)4]Cl2
BeO + 2KOH + H2O K2[Be(OH)4]
BeO + 2KOH 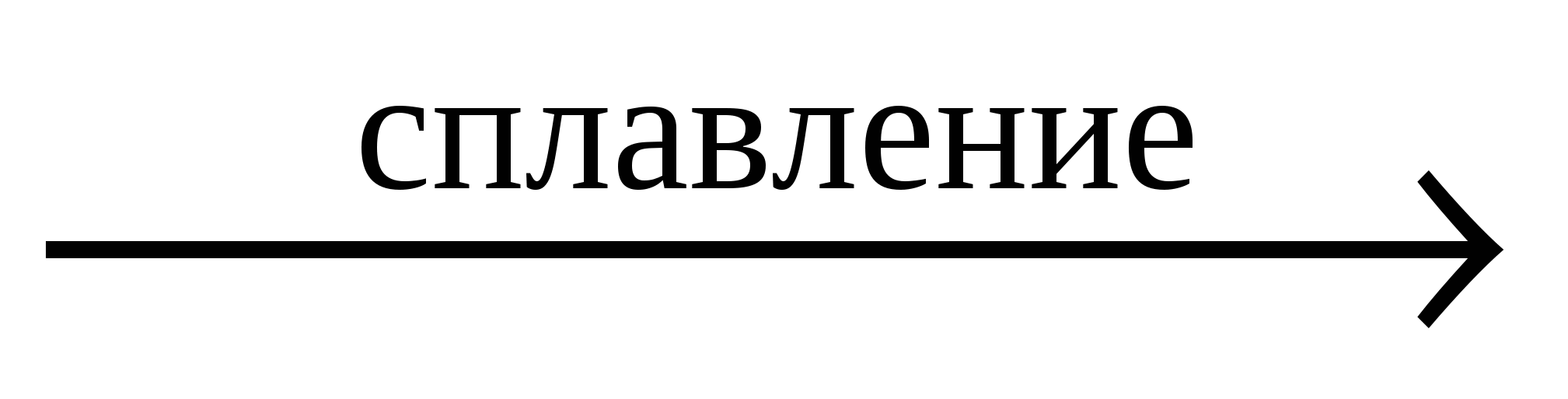 K2BeO2+ H2O K2BeO2+ H2O
Реакции оксидов с водой возможны лишь для щелочноземельных метал�лов:
MeO + H2OMe(OH)2.
BeO не реагирует с водой ни при каких условиях. Свежеприготов�ленный MgO растворяется в воде очень медленно, образуя щелочной раствор Mg(OH)2, а кристалличес�кий MgO с ней не реагирует.
Пероксиды.Общая формула - MeO2. Это соли пероксида водорода, имеющие ионную кристаллическую решетку.
Получают MgO2согласно реакции:
Mg(OH)2+ H2O2MgO2+ 2H2O
Пероксид бария – BaO2 получают при нагревании BaO в при�сутствии O2:
2BaO + O2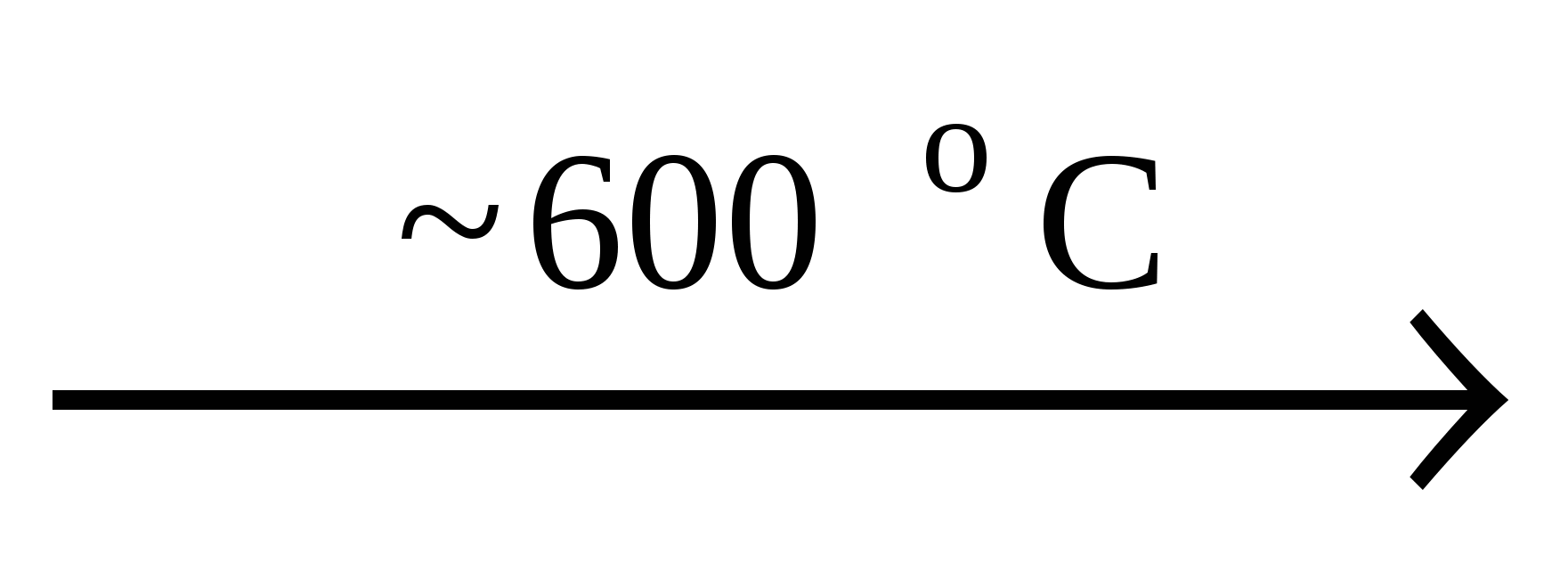 2BaO2 2BaO2
BaO2- белый рыхлый порошок, плохо растворяется в воде, реагирует с кислотами:
BaO2+ H2SO4BaSO4+ H2O2
BaO2применяют для получения H2O2 в лабораторных условиях, в качестве катализатора крекинг-процесса, также для от�белки шелка, костей, соломы, перьев и т.д.
SrO2- белый порошок, обладает такими же свойствами, что и BaO2. Его при�меняют в пиротехнике и для средств сигнализации.
Гидроксиды щелочноземельных ме�таллов и магния проявляют основной характер, возрастающий от Mg(OH)2к Ba(OH)2. Be(OH)2проявляет амфотерные свойства, раство�ряется в кислотах и щелочах с образованием аква- и гидрокcокомплекcов:
Be(OH)2 + 2HCl + 2H2O [Be(H2O)4]Cl2
Be(OH)2 + 2NaOH Na2[Be(OH)4]
Mg(OH)2- слабое основание, проявляет только основные свойства. Остальные гидроксиды - сильные основания, но с невысокой раство�римостью.
Гидроксиды Be(OH)2и Mg(OH)2получают по обменным реакциям:
MeCl2+ 2NaOHMe(OH)2+ 2NaCl
Остальные гидроксиды: Ca(OH)2, Sr(OH)2, Ba(OH)2- взаимодействием оксидов с водой:
MeO + H2OMe(OH)2
Из всех гидроксидов наибольшее практическое применение нашел Ca(OH)2- гашеная известь, которая в форме раствора называется из�вестковой водой. Она служит реактивом для обнаружения CO2:
Ca(OH)2+ CO2CaCO3+ H2O
При дальнейшем пропускании CO2 образуется раствор соли - гидро�карбоната кальция:
CaCO3 + H2O + CO2 Ca(HCO3)2
Ca(OH)2 применяют в производстве сахара при выделении его из мелассы, а также для получения белильной извести.
Соли
Из s-металлов II группы, только бериллий не растворяется в кислотах из-за непроницаемой оксидной пленки. Соли остальных металлов могут быть получены растворением их в кислотах:
Mg + H2SO4 (разб.) MgSO4 + H2
Mg + 2HCl MgCl2 + H2
3Mg + 2H3PO4 Mg3(PO4)2 + 3H2
Ca + H2O + CO2 CaCO3 + H2
HNO3(разб.) при взаимодействии с щелочноземельными металлами образует соль, воду и NH3(или NH4NO3):
4Ca + 10HNO3 4Ca(NO3)2 + NH4NO3 + 3H2O
Соли s-металлов II группы (кроме BeCl2) характеризуются ионным типом связи. Хлорид бериллия является несолеобразным соединением. Безводная соль BeCl2- полимер, в которой молекулы связаны донорно-акцепторными связями:
Многие соли оксокислот с s-элементами II группы - ма�лорастворимы в воде. Сульфаты, фосфаты, карбонаты, хроматы, окcалаты – малорастворимы (кромеBeSO4иMgSO4). Нераство�римыми являются: BaSO4, CaCO3, BaCO3, SrCO3и Ca3(PO4)2.
Кислые соли, как правило, лучше растворяются в воде, чем средние.
Ca(HCO3)2, Ba(HCO3)2и Sr(HCO3)2- хорошо растворимы.
CaHPO4– малорастворим.
Ca(H2PO4)2- хорошо растворим.
Галогениды- бесцветные, ионные кристаллические соединения. Безводные галогениды плавятся и кипят без разложения. Фториды Mg и щелочноземельных металлов малорастворимы в воде и не образуют кристаллогидратов.
BeF2- ионное соединение, а BeCl2, BeBr2и BeI2- ковалентные, возгоняются в виде димеров при нагревании их расплавов. В водном растворе BeF2находится в виде [Be(H2O)2F2], а при избытке F-образует [BeF4]2-. Остальные соли бериллия подвергаются гидролизу с образованием сложных продуктов.
Сульфаты- бесцветные, кристаллические вещества, в ионных кристаллических решетках, которых находятся тетраэдрические ионы SO42-. Сульфаты тяжелых металлов кристалли�зуются безводными. Сульфаты Be и др. элементов этой группы пла�вятся с частичным разложением:
CaSO4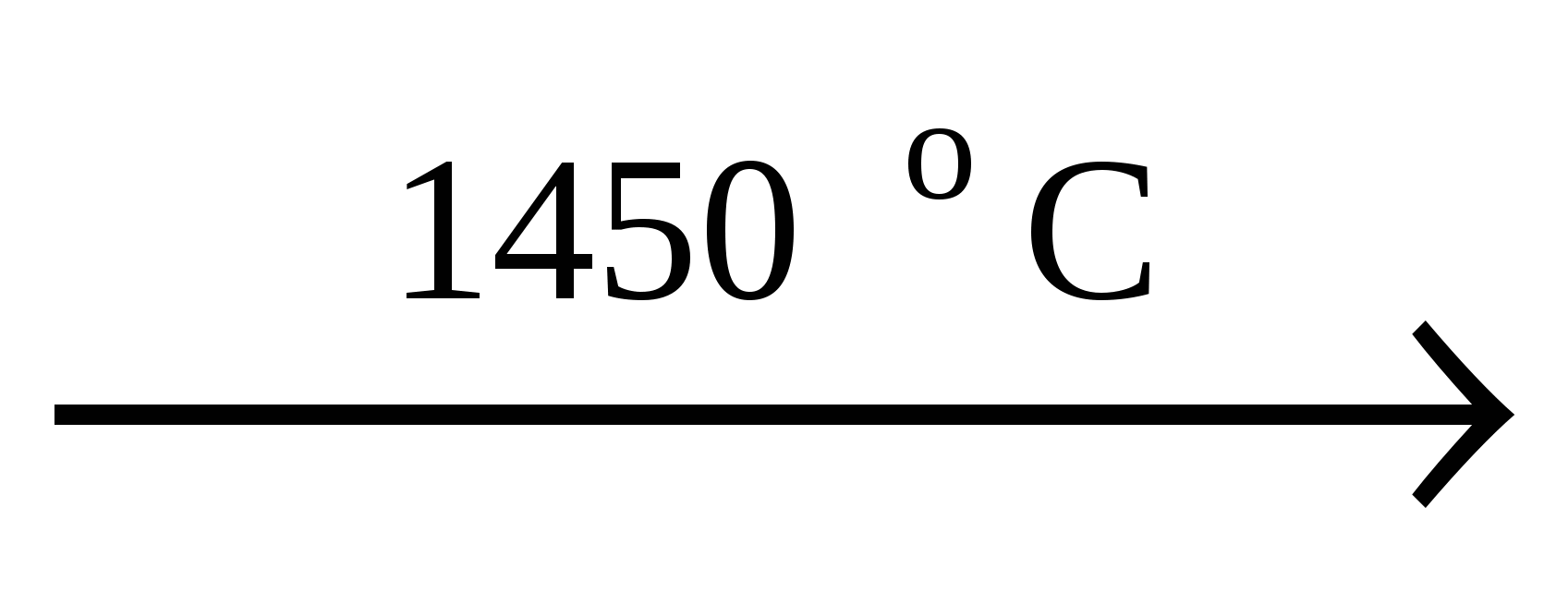 CaO + SO3 CaO + SO3
Качественная реакция на ион Ba2+основана на взаимодействии его с сульфат ионом:
Ba2++ SO42-BaSO4- белый осадок, нерастворимый в кислотах и щелочах
Kaрбонаты - бесцветные кристаллические вещества, в ионных кристаллических решетках которых находятся плоские треугольные ионы CO32-. Эти соли известны только в безводном состоянии, исключение - BeCO3- гигроскопичное вещество, с различным числом молекул крис�таллизационной воды. Карбонаты при нагревании разлагаются до плавления, малорастворимы в воде. Водные растворы этих солей (в т.ч. и суспензии) взаимодействуют с CO2:
CaCO3 + CO2 + H2O Ca(HCO3)2
Гидрокарбонаты - бесцветные, безводные кристаллические ве�щества, в которых анионы HCO3-связаны между собой водородными связями в бесконечные цепиH…CO3-H… CO3-H…
Все гидрокарбонаты щелочноземельных металлов хорошо растворимы в воде. С кислотами взаимодействуют с образованием солей:
Ca(HCO3)2+ 2HNO3Ca(NO3)2+ 2CO2+ 2H2O
Нитраты- бесцветные, хорошо растворимые в воде кристалли�ческие вещества, в ионных кристаллических решетках которых находятся плоские треугольные NO3--ионы (sp2-гибридизация).
Среди нитратов s-элементов II группы только Ba(NO3)2кристалли�зуется в безводном состоянии.
Комплексные соединения. В отличие от бериллия, щелочноземель�ным металлам не свойственно комплексообразование. Но получены некоторые соли, в которых координационные числа чаще 4 и 6, а у кальция 8. Склонность к комплексообразованию уменьшается с увеличением размера атома, т.е. от бериллия к барию. Примеры КС:
[Be(NH3)4]Cl2; [Mg(NH3)6]Cl2; [Ca(H2O)6]Cl2; [Ca(NH3)8]Cl2.
Биологическая роль s-металлов I группы
В организме человека ионы щелочных металлов присутствуют в виде растворимых солей: NaCl; KCl; Na2HPO4; Na2CO3; NaH2PO4; NaHCO3и др. Содержание их различно, также как и биоло�гическое действие. Содержание этих элементов по отношению к средней массе человека (
70 кг) составляет: Na
60г (0,08%); K
160 г (0,23%); Li, Rb и Cs по 10-4-10-5%.
Na и K присутствуют в гораздо большем количестве и являются макроэлементами, остальные относятся к микроэлементам. Все они присутствуют в организме в виде ионов.
Из ионов всех щелочных металлов ионы Na+и K+имеют наибольшее зна�чение, их относят к металлам жизни. Можно отметить взаимосвязь между большим содержанием этих металлов в земной коре среди других элементов этой группы и их повышенным содержанием в орга�низме.
Эти два иона играют важную роль в различных физиологических процессах и не могут быть замещены в организме человека никакими другими ионами. Они участвуют в регуляции водного обмена, в пе�редаче нервных импульсов через мембраны нервных клеток, мышечном сокращении, нормальном функционировании сердца, а также в обменных реакциях. Концентрация ионов внутри клетки и вне ее достигается благо�даря избирательной проницаемости клеточной мембраны по отношению к тем или иным ионам
p-Элементы
p-Элементы имеют общую электронную конфигурацию ns 2np 1–6 и образуют подгруппы IIIА, IVА, VА, VIА, VIIА и VIIIА периодической системы.
В подгруппе IIIА рассматривают отдельно B, Al и подгруппу галлия (Ga, In, Tl), в IVА – C, Si иподгруппу германия (Ge, Sn, Pb), в VА – N, P и подгруппу мышьяка (As, Sb, Bi), в VIА – O иподгруппу халькогенов (S, Se, Te, Po), в VIIА – галогены (F, Cl, Br, I, At), в VIIIА – Ne, Ar и подгруппу криптона (Kr, Xe, Rn).
В отличие от s-элементов, p-элементы поливалентны (табл. 8.5). Высшие положительные степени окисления равны номеру группы, отрицательные – числу неспаренных электронов для элементов IVА–VIIА подгрупп. Для элементов подгруппы Kr возможны только формально положительные четные степени окисления.
При переходе сверху вниз в подгруппах возрастает разница энергий s- и p-подуровней, поэтому легким элементам свойственны высшие степени окисления, тяжелым – низшие. Так, в подгруппе IVА стабильность соединений Э 2+ возрастает в ряду Ge 2+ < Sn 2+ < Pb 2+. В той же последовательности уменьшается устойчивость соединений Э 4+. Подтверждением этому служит изменение термической устойчивости водородных соединений ЭH 4.
ЭH 4
|
CH 4
|
SiH 4
|
GeH 4
|
SnH 4
|
PbH 4
|
t разл , °C
|
800
|
450
|
285
|
150
|
0
| | |
|
|
 Скачать 0.81 Mb.
Скачать 0.81 Mb.