Ответы на вопросы по химии. Д. И. Менделеева. Структура периодической системы
 Скачать 0.81 Mb. Скачать 0.81 Mb.
|
|
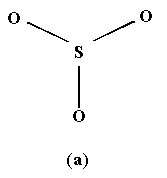
Диоксид серы синтезируют непосредственным сжиганием серы на воздухе или длительным отжигом сульфидов: 4FeS2 + 11O2 = 2Fe2O3 + 8SО2 . Диоксиды селена и теллура образуются при обработке простых веществ диоксидом азота, концентрированной HNO3: Se + NO2 Однако в результате такой же обработки серы образуются производные S(VI): SO2 + NO2 PoO2 можно получить слабым нагреванием (250оС) металла на воздухе. Физические свойства диоксидов халькогенов ЭО2 представлены в табл.7. С увеличением размера атома Э халькогена возрастает длина связи Э-О и усиливается межмолекулярное взаимодействие: при стандартных условиях SО2 - газ, а SеО2 , TeО2 и РоО2 - твердые вещества. Диоксид серы SО2 - бесцветный газ с резким запахом, угнетающе действующий на растения. Наличие неподеленной электронной пары (электронной плотности) вблизи атома серы объясняет полярность и высокую реакционную способность молекулы SО2. Увеличение размера атомов в ряду S- Se- Te- Po отражается в строении твердых диоксидов. Кристалл диоксида серы содержит дискретные молекулы SО2. Твердый SеО2 построен из бесконечных цепочек, в которых атомы Sе окружены тремя атомами О в виде пирамиды { SeO3} с концевым атомом кислорода. TeО2 и особенно РоО2 по существу ионные соединения. С ростом радиуса увеличиваются и координационные числа атомов халькогенов в диоксидах от 2 (SО2) до 3 (SеО2), 4 (TeО2) и 8 (РоО2). Химические свойства диоксидов ЭО2. SО2 хорошо растворяется в воде с образованием гидратов SО2 . nH2O. Раствор имеет кислую реакцию, но в индивидуальном виде H2SO3 не выделена из-за ее термодинамической неустойчивости. Твердый диоксид селена также хорошо растворим в воде, и при этом образуется селенистая кислота SeO2 + H2O = H2SeO3. TeО2 и РоО2 в воде не растворяются в силу высокой энергии кристаллической решетки. В щелочной среде TeО2 образует теллуриты металлов TeО2 + 2OH РоО2 с щелочами взаимодействует лишь при сплавлении, а в реакциях с кислотами проявляет основные свойства: РоО2 + 2H2SO4 Восстановительные свойства SО2 обусловлены присутствием в его молекуле неподеленной электронной пары. SО2 взаимодействует с окислителями различной силы (свободные галогены, хлорная, бромная и иодная вода; растворы KMnO4), образуя различные производные S(VI): I2 + SO2 + 2H2O = 2HI +H2SO4 , H2SeO3 + 2SO2 + H2O Реакция с F2 начинается около 200оС с образованием SF6: SO2 + 5F2 Взвесь пыли металлического цинка в воде восстанавливает SO2 до производных серы (III) - дитионитов и дитионистой кислоты: Zn + 2SO2 = ZnS2O4 или 2NaHSO3 + SO2 + Zn = Наличие неподеленной электронной пары в молекуле SO2 обусловливает не только восстановительные, но и комплексообразующие свойства, в частности, образование гидратов. Молекула SO2 служит нейтральным лигандом в многочисленных комплексах с переходными металлами, например: [Fe2(CO)8( Их образование протекает по донорно-акцепторному механизму, при этом молекула SO2 может присоединяться (координироваться) к атому металла через атом серы или атом кислорода и действовать как концевой (однодентатный) или мостиковый (бидентатный) лиганды. Диоксид SеO2 менее термодинамически стабилен, чем SO2 и ТеO2. Он легко восстанавливается аммиаком, гидразином, водным раствором SO2 до красного Sе. Получение и свойства триоксидов ЭО3 . Среди триоксидов ЭО3 наиболее важен триоксид серы SО3, который производится каталитическим окислением SO2 при 500оС для получения H2SO4. Он выделяется также при термическом распаде сульфатов металлов: Кристаллический триоксид SО3 плавится при 16оС. Мономерная газообразная молекула SО3 имеет форму симметричного плоского треугольника с длиной связи S- O 1.43
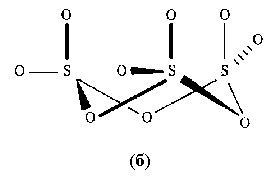
Рис.6. Строение газообразной молекулы SO3 (a) и конденсированного тримера S3O9 (б). Они связаны общими вершинами в циклические тримеры S3О9, напоминающие циклические метаполифосфаты и силикаты, или бесконечные спиральные цепи. Триоксид SО3 - одно из самых реакционноспособных соединений. Проявляет окислительные свойства. Серой и углеродом SО3 восстанавливается до SO2: 2SO3 + C Особенности взаимодействия SО3 с галогеноводородами связаны с ростом восстановительных свойств в ряду HCl- HBr- HI. Окислительные свойства SО3 усиливаются с температурой. SеО3 получают дегидратацией селеновой кислоты при 150оС с помощью фосфорного ангидрида с последующей отгонкой SеО3 в вакууме. TeО3 синтезируют дегидратацией ортотеллуровой кислоты H6TeO6 при 350оС. SеО3 и TeО3 при нагревании легко отщепляют кислород и образуют диоксиды. SеО3 хорошо растворяется в воде с образованием Н2SеО4. Твердый SeO3 состоит из тетраэдров SеО3 обладает сильными окислительными свойствами, окисляя охлажденную соляную кислоту: SеО3 + 2HCl Окислительные свойства триоксида теллура выражены гораздо слабее, он вытесняет хлор из соляной кислоты только при нагревании. Вопрос №24 Соединения водорода: гидриды, вода, пероксид водорода. Гидриды — соединения водорода с металлами и с имеющими меньшую электроотрицательность, чем водород, неметаллами. Иногда к гидридам причисляют соединения всех элементов с водородом. Классификация В зависимости от характера связи водорода различают три типа гидридов:
К ионным гидридам относятся соединения водорода с щелочными и щёлочноземельными металлами. Ионные гидриды — это вещества белого цвета, устойчивые при н. у., но разлагающиеся при нагревании на металл и водород без плавления, исключение составляет LiH, который плавится без разложения и при дальнейшем нагревании разлагается. Металлические гидриды - это соединения переходных металлов, в большинстве случаев являются бертоллидами. По сути являются твёрдым раствором водорода в металле, сохраняется и кристаллическая структура металла. К ковалентным гидридам относятся гидриды образованные неметаллами, в пример можно привести CH4 и SiH4. Химические свойства Взаимодействие ионных гидридов с водой: NaH + H2O → NaOH + H2↑ CaH2 + 2H2O → Ca(OH)2 + 2H2↑ Взаимодействие с оксидами металлов: 2CaO + CaH2 → 2Ca + Ca(OH)2 3ZnO + 2AlH3 → 3Zn + 2Al + 3H2O Термическое разложение: 2LiH → 2Li + H2↑ 2NaH → 2Na + H2↑ Взаимодействие с азотом: 3СаН2 + N2 → Ca3N2 + ЗН2 Получение Ионные гидриды получают взаимодействием простых веществ: 2Na + H2 → 2NaH Вода Нет на Земле вещества более важного для нас, чем обыкновенная вода, и в то же время не существует другого такого же вещества, в свойствах которого было бы столько противоречий и аномалий, сколько в её свойствах. Почти ¾ поверхности нашей планеты занято океанами и морями. Твёрдой водой – снегом и льдом – покрыто 20% суши. Строение молекулы. Как известно, свойства химических соединений зависят от того, из каких элементов состоят их молекулы, и изменяются закономерно. Воду можно рассматривать как оксид водорода или как гидрид кислорода. Атомы водорода и кислорода в молекуле воды расположены в углах равнобедренного треугольника с длиной связи О – Н 0,957 нм; валентный угол Н – О – Н 104o27’. Но поскольку оба водородных атома расположены по одну сторону от кислородного, электрические заряды в ней рассредоточиваются. Молекула воды полярна, что является причиной особого взаимодействия между разными её молекулами. Атомы водорода в молекуле воды, имея частичный положительный заряд, взаимодействуют с электронами атомов кислорода соседних молекул. Такая химическая связь называется в о д о р о д н о й. Она обьединяет молекулы воды в своеобразные полимеры пространственного строения. Вода – единственное вещество на Земле, которое существует в природе во всех трёх агрегатных состояниях – жидком, твёрдом и газообразном. Плавление льда при атмосферном давлении сопровождается уменьшением объёма на 9%. Плотность жидкой воды при температуре, близкой к нулю, больше, чем у льда. И лёд плавает, оттого и не промерзают обычно насквозь водоёмы, а лишь покрываются ледяным покровом. Вода имеет незакономерно высокие температуры плавления и кипения в сравнении с другими водородными соединениями элементов главной подгруппы VI группы таблицы Менделеева. Нужно подвести дополнительную энергию, чтобы расшатать, а затем разрушить водородные связи. И энергия эта очень значительна. Вот почему так велика теплоёмкость воды. Благодаря этой особенности вода формирует климат планеты. Геофизики утверждают, что Земля давно бы остыла и превратилась в безжизненный кусок камня, если бы не вода. Нагреваясь, она поглощает тепло, остывая, отдаёт его. Земная вода и поглощает, и возвращает очень много тепла, и тем самым “выравнивает” климат. Особенно заметно на формирование климата материков влияют морские течения, образующие в каждом океане замкнутые кольца циркуляции. А от космического холода предохраняют Землю те молекулы воды, которые рассеяны в атмосфере – в облаках и в виде паров. Водяной пар создаёт мощный “парниковый эффект”, который задерживает до 60% теплового излучения нашей планеты, не даёт ей охлаждаться. Но не только поэтому мы считаем воду жизненно важным веществом. Дело в том, что тело человека почти на 63 – 68 % состоит из воды. Почти все биохимические реакции в каждой живой клетке – это реакции в водных растворах. С водой удаляются из нашего тела ядовитые шлаки; вода, выделяемая потовыми железами и испаряющаяся с поверхности кожи, регулирует температуру нашего тела. Представители животного и растительного мира содержат такое же обилие воды в своих организмах. Меньше всего воды, лишь 5 – 7% веса, содержат некоторые мхи и лишайники. Большинство обитателей земного шара и растения состоят более чем на половину из воды. Например, млекопитающие содержат 60 – 68 %; рыбы – 70 %; водоросли – 90 – 98 % воды. В растворах же (преимущественно водных) протекает большинство технологических процессов на предприятиях химической промышленности, в производстве лекарственных препаратов и пищевых продуктов. Не случайно гидрометаллургия – извлечение металлов из руд и концентратов с помощью растворов различных реагентов – стала важной отраслью промышленности. Вода – это важный источник энергоресурсов. Как известно, все гидроэлектрические станции мира, от маленьких до самых крупных, превращают механическую энергию водного потока в электрическую исключительно с помощью водяных турбин с соединёнными с ними электрогенераторами. На атомных электростанциях атомный реактор нагревает воду, водяной пар вращает турбину с генератором и вырабатывает электрический ток. Вода, несмотря на все её аномольные свойства, является эталоном для измерения температуры, массы ( веса), количества тепла, высоты местности. В 1932 году американцы Г.Юри и Э.Осборн обнаружили, что даже в самой чистой воде, которую только можно получить в лабораторных условиях, содержится незначительное количество какого-то вещества, выражающегося, по-видимому, той же химической формулой Н2О, но обладающего молекулярным весом 20 вместо веса 18, присущего обычной воде. Юри назвал это вещество тяжёлой водой. Большой вес тяжёлой воды объясняется тем, что её молекулы состоят из атомов водорода с удвоенным атомным весом по сравнению с атомами обычного водорода. Двойной вес этих атомов в свою очередь обусловливается тем, что их ядра содержат, кроме единственного протона, составляющего ядро обычного водорода, ещё один нейтрон. Тяжёлый изотоп водорода получил название дейтерия (D или 2Н), а обычный водород стали называть протием. Тяжёлая вода, окись дейтерия, выражается формулой D2О. Вскоре был открыт третий, сверхтяжёлый изотоп водорода с одним протоном и двумя нейтронами в ядре, который был назван тритием (Т или 3Н). В соединении с кислородом тритий образует сверхтяжёлую воду Т2О с молекулярным весом 22. В природных водах содержится в среднем около 0,016% тяжёлой воды. Тяжёлая вода внешне похожа на обычную воду, но по многим физическим свойствам отличается от неё. Точка кипения тяжёлой воды 101,40 С, точка замерзания + 3,80 С. Тяжёлая вода на 11% тяжелее обычной. Удельный вес тяжёлой воды при температуре 250 С равен 1,1. Она хуже растворяет различные соли. В тяжёлой воде скорость протекания некоторых химических реакций иная, чем в обычной воде. И в физиологическом отношении тяжёлая вода воздействует на живое вещество иначе: в отличие от обычной воды, обладающей живительной силой, тяжёлая вода совершенно инертна. Семена растений, если их поливать тяжёлой водой, не прорастают; головастики, микробы, черви, рыбы в тяжёлой воде не могут существовать; если животных поить одной тяжёлой водой, они погибнут от жажды. Тяжёлая вода – это мёртвая вода. Имеется ещё один вид воды, отличающийся по физическим свойствам от обычной воды, - это омагниченная вода. Такую воду получают с помощью магнитов, вмонтированных в трубопровод, по которому течет вода. Омагниченная вода изменяет свои физико – химические свойства: скорость химических реакций в ней увеличивается, ускоряется кристаллизация растворённых веществ, увеличивается слипание твёрдых частиц примесей и выпадение их в осадок с образованием крупных хлопьев (коагуляция). Омагничивание успешно применяется на водопроводных станциях при большой мутности забираемой воды. Она позволяет также быстро осаждать загрязненные промышленные стоки. Из химических свойств воды особенно важны способность её молекул диссоциировать (распадаться) на ионы и способность воды растворять вещества разной химической природы. Роль воды как главного и универсального растворителя определяется прежде всего полярностью её молекул и, как следствие, её чрезвычайно высокой диэлектрической проницаемостью. Разноимённые электрические заряды, и в частности ионы, притягиваются друг к другу в воде в 80 раз слабее, чем притягивались бы в воздухе. Силы взаимного притяжения между молекулами или атомами погружённого в воду тела также слабее, чем в воздухе. Тепловому движению в этом случае легче разбить молекулы. Оттого и происходит растворение, в том числе многих труднорастворимых веществ. Протон Н+ сразу соединяется с молекулой воды, образуя ион гидроксония Н3О+, который в свою очередь объединяется с одной, двумя или тремя молекулами воды в Н3О+, Н5О2+ , Н7О3+ . Электролитическая диссоциация воды – причина гидролиза солей слабых кислот и (или) оснований. Степень электролитической диссоциации заметно возрастает при повышении температуры. Под действием ультрафиолетового излучения происходит фотодиссоциация воды на ионы Н+ и ОН- . Ионизирующее излучение вызывает радиолиз воды с образованием Н2; Н2О2 и свободных радикалов: Н* ; ОН* ; О* . Вода – реакционноспособное соединение. Вода окисляется атомарным кислородом: Н2О + О=Н2О2 При взаимодействии с F2 образуется НF, а также О2 ;О3 ; Н2О2 ; F2О и другие соединения. С остальными галогенами при низких температурах вода реагирует с образованием смеси кислот Н Гал и Н Гал О. При обычных условиях с водой взаимодействует до половины растворённого в ней СI2 и значительно меньшие количества Br2 и J2. При повышенных температурах СI2 и Br2 разлагают воду с образованием Н Гал и О2 . При повышенной температуре в присутствии катализатора вода реагирует с СО; СН4 и другими углеводородами, например: Н2О + СО=СО2 + Н2 Н2О + СН4=СО + 3Н2 Эти реакции используют для промышленного получения водорода. Фосфор при нагревании с водой под давлением в присутствии катализатора окисляется в метафосфорную кислоту: 6Н2О + 3Р=2НРО3 + 5Н2 Вода взаимодействует со многими металлами с образованием Н2 и соответствующего гидроксида. Со щелочными и щелочно-земельными металлами ( кроме Мg ) эта реакция протекает уже при комнатной температуре. Менее активные металлы разлагают воду при повышенной температуре, например, Мg и Zn – выше 1000 С; Fe – выше 6000 С : 2Fe + 3H2O=Fe2O 3 + 3H2 При взаимодействии с водой многих оксидов образуются кислоты или основания. Вода может служить катализатором, например, щелочные металлы и водород реагируют с CI2 только в присутствии следов воды. |