|
|
Ответы на вопросы по химии. Д. И. Менделеева. Структура периодической системы
После открытия основных элементарных частиц, входящих в состав атома, встал вопрос об их местонахождении, т.е. о строении атома. В 1911 г. Томсон предложил свою модель строения атома, которая получила условное название «пудинг с изюмом». Согласно этой модели атом представляет собой некую субстанцию, в которой равномерно распределены протоны, нейтроны и электроны. Число протонов равно числу электронов, поэтому атом в целом электронейтрален.
В 1913 г. Резерфорд ставит опыт, результаты которого модель Томсона объяснить не может.Это заставляет Резерфорда предложить свою модель строения атома, получившую название планетарной. Согласно этой модели атом состоит из ядра, в котором сконцентрирована основная масса атома, поскольку ядро содержит протоны и нейтроны; вокруг ядра на огромной скорости вращаются электроны. Поскольку модель Резерфорда содержала ряд противоречий, Н.Бором были введены постулаты, устраняющие эти противоречия.
1-й постулат. Электроны вращаются вокруг ядра не по произвольным, а по строго определенным, стационарным орбитам.
2-й постулат. При движении по стационарной орбите электрон не излучает и не поглощает энергию. Изменение энергии происходит при переходе электрона с одной стационарной орбиты на другую.
Но теория Резерфорда–Бора дает удовлетворительные результаты только для атома водорода. Современные представления о строении атома подчиняются квантовой модели строения атома, которая учитывает волновые свойства элементарных частиц. Приведем ее основные положения.
• Электрон имеет двойственную (корпускулярно-волновую) природу, т.е. ведет себя и как частица, и как волна. Как частица, электрон обладает массой и зарядом; как волна, он обладает способностью к дифракции.
• Для электрона невозможно одновременно точно измерить координату и скорость.
• Электрон в атоме не движется по определенным траекториям, а может находиться в любой части околоядерного пространства, однако вероятность его нахождения в разных частях этого пространства неодинакова. Область пространства, где вероятнее всего находится электрон, называется орбиталью*.
• Ядра атомов состоят из протонов и нейтронов, имеющих общее название – нуклоны.
Параметры для характеристики атомов
Массовое число А – сумма чисел протонов и нейтронов атома.
Заряд ядра Z – число протонов, определяется по порядковому номеру элемента в таблице Д.И.Менделеева. В 1913 г. английским физиком Г.Мозли было установлено, что положительный заряд ядра атома (в условных единицах) равен порядковому номеру элемента в периодической системе Д.И.Менделеева.
Число нейтронов N определяется как разность между массовым числом и зарядом ядра (учитывая, что массой электрона можно пренебречь).
Изотопы – атомы одного элемента, имеющие одинаковый заряд ядра (следовательно, и количество электронов), но различное число нейтронов (следовательно, различные массовые числа). Например, элемент водород имеет три изотопа: протий, дейтерий и тритий. Первые два существуют в природе, тритий получен искусственным путем. Подавляющее большинство химических элементов имеет разное число природных изотопов с разным процентным содержанием каждого из них. Относительная атомная масса элемента, которая приводится в периодической системе, – это средняя величина массовых чисел природных изотопов данного элемента с учетом процентного содержания каждого из этих изотопов. Химические свойства всех изотопов одного химического элемента одинаковы. Следовательно, химические свойства элемента зависят не от атомной массы, а от заряда ядра.
Строение электронной оболочки атома
Атом состоит из ядра и электронной оболочки. Электронная оболочка атома – это совокупность всех электронов в данном атоме. От строения электронной оболочки атома напрямую зависят химические свойства данного химического элемента. Согласно квантовой теории каждый электрон в атоме занимает определенную орбиталь и образует электронное облако, которое является совокупностью различных положений быстро движущегося электрона.
Для характеристики орбиталей и электронов используют квантовые числа.
Вопрос №21
Химия углерода.
|
|
Углерод (лат. Carboneum, cаrbo — уголь), С (читается «це»), химический элемент с атомным номером 6, атомная масса 12,011. Углерод расположен в группе IVA, во втором периоде периодической системы. Конфигурация внешнего электронного слоя атома в основном состоянии 2s2 2p2. Важнейшие степени окисления +2 +4, –4, валентности IV и II.
Историческая справка
Углерод известен с глубокой древности. Древесный уголь использовали для восстановления металлов из руд, алмаз — как драгоценный камень. В 1789 французский химик А. Л. Лавуазье сделал вывод об элементарной природе углерода. Искусственные алмазы впервые были получены в 1953 шведскими исследователями.
Нахождение в природе
Накапливается в биосфере: в живом веществе, в древесине, торфе, природных горючих газах, горючих сланцах, каменном и буром угле, нефти, антраците. Значительная часть угля литосферы сосредоточена в известняках и доломитах. Углерод в степени окисления +4 входит в состав карбонатных пород и минералов (мел, известняк, мрамор, доломиты). Углекислый газ CO2 постоянный компонент атмосферного воздуха. Углекислый газ в растворенном виде всегда присутствует в воде рек, озер и морей. В атмосфере звезд, планет и в метеоритах обнаружены вещества, содержащие углерод.
Получение
С древности уголь получали при неполном сгорании древесины. В 19 веке древесный уголь в металлургии заменили каменным углем (коксом). В настоящее время для промышленного получения чистого углерода используют крекинг природного газа метана СН4: СН4 = С + 2Н2 Уголь для медицинских целей готовят сжиганием кожуры кокосовых орехов. Для лабораторных нужд чистый уголь, не содержащий несгораемых примесей, получают неполным сжиганием сахара.
Физические и химические свойства
Углерод — неметалл. Многообразие соединений углерода объясняется способностью его атомов связываться между собой, образуя объемные структуры, слои, цепи, циклы. Известны четыре аллотропические модификации углерода: алмаз, графит, карбин и фуллерит. Древесный уголь состоит из мельчайших кристалликов с неупорядоченной структурой графита. Сажа представляет собой сильно измельченный графит. Алмаз — минерал с кубической гранецентрированной решеткой. Атомы С в алмазе находятся в sp 3-гибридизованном состоянии. Каждый атом образует 4 ковалентные s-связи с четырьмя соседними атомами С, расположенными по вершинам тетраэдра, в центре которого находится атом С. Электронная проводимость отсутствует. Из всех простых веществ алмаз имеет максимальное число атомов, приходящихся на единицу объема. Твердость по минералогической шкале Мооса принята за 10. Алмаз можно поцарапать только другим алмазом; но он хрупок и при ударе раскалывается на куски неправильной формы. Графит — слоистое темно-серое вещество с гексагональной кристаллической решеткой. Состоит из параллельных слоев, образованных правильными шестиугольниками из атомов С. Связи между слоями осуществляются слабыми ван-дер-ваальсовыми силами, поэтому графит легко расслаивается. Графит обладает хорошей электрической проводимостью. Во всех аллотропических модификациях при обычных условиях углерод химически малоактивен. В химические реакции вступает только при нагревании. При этом химическая активность углерода убывает в ряду сажа—древесный уголь—графит—алмаз. Сажа на воздухе воспламеняется при нагревании до 300°C, алмаз — при 850-1000°C. При горении образуется углекислый газ СО2 и CO. Нагревая СО2 с углем, также получают оксид углерода (II) CО: СО2+ С = 2СО. Синтезирован оксид углерода С2О3. СО2 — кислотный оксид, ему отвечает слабая неустойчивая, существующая только в сильно разбавленных холодных водных растворах угольная кислота Н2СО3. Соли угольной кислоты — карбонаты (К2СО3, СаСО3) и гидрокарбонаты (NaHCO3, Са(НСО3)2). С водородом графит и древесный уголь реагируют при температуре выше 1200°C, образуя смесь углеводородов. Реагируя со фтором при 900°C, образует смесь фторуглеродных соединений. Пропуская электрический разряд между угольными электродами в атмосфере азота, получают газ циан (CN)2; если в газовой смеси присутствует водород, образуется синильная кислота HCN. При очень высоких температурах графит реагирует с серой, кремнием, бором, образуя карбиды — CS2, SiC, В4С. Карбиды получают взаимодействием графита с металлами при высоких температурах: карбид натрия Na2C2, карбид кальция CaC2, карбид магния Mg2C3, карбид алюминия Al4C3. Эти карбиды легко разлагаются водой на гидроксид металла и соответствующий углеводород: Al4C3 + 12Н2О = 4Al(ОН)3 + 3СН4
С переходными металлами углерод образует металлоподобные химически стойкие карбиды, например, карбид железа (цементит) Fe3C, карбид хрома Cr2C3, карбид вольфрама WС. Карбиды — кристаллические вещества, природа химической связи может быть различной. При нагревании уголь восстанавливает многие металлы из их оксидов: FeO + C = Fe + CO, 2CuO+ C = 2Cu+ CO2 При нагревании восстанавливает серу(VI) до серы(IV) из концентрированной серной кислотой: 2H2SO4+ C = CO2+ 2SO2+ 2H2O При 3500°C и нормальном давлении углерод сублимирует.
Применение
Свыше 90% всех первичных источников потребляемой в мире энергии приходится на органическое топливо. 10% добываемого топлива используется в качестве сырья для основного органического и нефтехимического синтеза, для получения пластмасс.
Физиологическое действие
Углерод — важнейший биогенный элемент, является структурной единицей органических соединений, участвующих в построении организмов и обеспечении их жизнедеятельности (биополимеры, витамины, гормоны, медиаторы и другие). В процессе жизнедеятельности организмов происходит окислительный распад органических соединений с выделением во внешнюю среду CO2. Углекислый газ, растворенный в биологических жидкостях и природных водах, участвует в поддержании оптимальной для жизнедеятельности кислотности среды. В составе CaCO3 углерод образует наружный скелет многих беспозвоночных, содержится в кораллах, яичной скорлупе. При различных производственных процессах частицы угля, сажи, графита, алмаза попадают в атмосферу и находятся в ней в виде аэрозолей.
Органика!!!
|
|
|
Вопрос №22
Общая характеристика окислительно-восстановительных реакций. Биологическая роль окислительно-восстановительных процессов.
Окислительно-восстановительные свойства элементов.
Химические реакции, в результате которых изменяются степени окисления элементов, входящих в состав реагирующих веществ, называются окислительно-восстановительными. В этих реакциях происходит обмен (перенос) электронов от одних реагирующих веществ к другим.
Степень окисления – условный заряд элемента в соединении, который вычисляется в предположении, что химические связи между элементами являются ионными. Заряды атомов кислорода принимают равными -2, в пероксидных соединениях – равным -1; заряд элементов первой группы +1, заряд атома водорода +1, а в гидридах металлов -1.
Восстановитель - это частица, отдающая электрон, окислитель - принимающая электрон. Окисление - процесс отдачи электронов, восстановление - процесс приема электрона.
Окисление и восстановление – взаимосвязанные процессы, так как вещества могут отдавать электроны только в том случае, если в реакции участвует другое вещество, способное электроны принимать, что определяет закон сохранения заряда в химических реакциях.
Окислительные свойства могут проявлять как простые, так и сложные вещества. К типичным
(сильным) окислителям относятся фтор, галогены, кислород, а так же КClO3, НClO3, HNO3, H2SO4 (конц), MnO2, KMnO4, K2Cr2O7, PbO2 и др.
Восстановителями являются металлы, Н2, С (графит), HCl(конц), KI, KBr, H2S, CO, FeSO4.
Всегда восстановитель – это атом (частица) с максимально возможным числом электронов. Окислитель - это атом (частица) с минимально возможным числом электронов.
Пример:
Мn0
|
Мn+2, Мn+3, Мn+4, Мn+5, Мn+6 ,
|
Мn+7
|
всегда восстановитель
|
состояние атома в окислительно-восстановительной двойственности
|
всегда окислитель
|
Есть вещества, способные проявлять и окислительные и восстановительные свойства. К ним относятся вещества, в состав которых входят атомы элементов в промежуточных степенях окисления. Под действием окислителей они могут повышать свою степень окисления, проявляя восстановительные свойства, а при реакциях с восстановителями – понижать степень окисления, проявляя окислительные свойства. К таким веществам относятся KNO2, H2O2, SO2, Na2SO3 и др.
Факторы, определяющие окислительно-восстановительные свойства элементов:
Природа атомов определяется положением элемента в периодической системе.
Для восстановителей характерен большой радиус, маленькая энергия ионизации. Энергия ионизации - энергия, которая затрачивается для отрыва электрона от атома. Для окислителей характерен малый радиус и большая энергия сродства к электрону.
Влияние кислотности среды. Например, KMnO4 универсальный окислитель, его окисляющая способность проявляется при любых условиях среды:
а) кислая среда, рН<7
Mn+7+5ē→ Mn+2 (бесцветный)
б) нейтральная среда, рН=7
Mn+7+3ē→ Mn+4 (бурый)
в) щелочная среда, рН>7
Mn+7+1ē→ Mn+6 (зеленый)
Расстановку коэффициентов в ОВР проводят по правилу электронного баланса: «Число электронов, отданных восстановителем, равно числу электронов, принятых окислителем».
восстановителя, тем больше константа равновесия.
Биологическое значение окислительно-восстановительных процессов.
Важными процессами в животных организмах являются реакции ферментативного окисления веществ – субстратов: углеводов, жиров, аминокислот. В результате этих процессов организмы получают большое количество энергии. Приблизительно 90% всей потребности взрослого мужчины в энергии покрывается за счет энергии, вырабатываемой в тканях при окислении углеводов и жиров. Остальную часть энерг10% дает окислительное расщепление аминокислот.
В организме человека много редокс - систем, участвующих в биологическом окислении: НАД/НАДН+, ФАД/ФАД Н+, цитохромы и др. Системы с более низким окислительно - восстановительным потенциалом отдают электроны, с высоким – принимают. Электроны переносятся по дыхательной цепи ферментов постепенно с нарастанием ОВП.
В качестве переносчиков электронов в дыхательную цепь митохондрий входят различные белки, содержащие разнообразные функциональные группы, которые предназначены для переноса электронов. По мере продвижения по цепи от одного интермедиата к другому электроны теряют свободную энергию. На каждую пару электронов, переданных по дыхательной цепи кислороду, синтезируется три молекулы АТФ. Свободная энергия, высвобождающаяся при переносе двух электронов на кислород, составляет 220 кДж/моль.
Окислительно-восстановительные реакции лежат в основе методов оксидиметрии, которые применяют в клиническом анализе для определения мочевой кислоты в моче, сахара в крови, в санитарно-гигиенической практике - для определения окисляемости воды, содержание хлора в питьевой воде.
Вопрос №23
Оксиды халькогенов
Наиболее важными являются ди- (ЭО2) и триоксиды (ЭО3) халькогенов. Для серы же известен и ряд других нестабильных оксидов. Оксид S2Oполучают пропусканием тионилхлорида над сульфидом серебра
SOCl2 + Ag2S 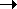 S2O + 2AgCl. S2O + 2AgCl.
Оксид S8O получают из H2S7 и SOCl2:
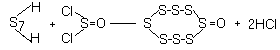 или окислением S8 трифторуксусной кислотой. или окислением S8 трифторуксусной кислотой.
Диоксиды халькогенов: получение, строение и физические свойства.
|
|
|
 Скачать 0.81 Mb.
Скачать 0.81 Mb.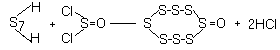 или окислением S8 трифторуксусной кислотой.
или окислением S8 трифторуксусной кислотой.