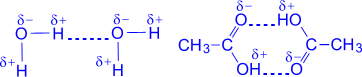Ответы на вопросы по химии. Д. И. Менделеева. Структура периодической системы
 Скачать 0.81 Mb. Скачать 0.81 Mb.
|
|
Электроотрицательность - это способность атома притягивать электронную плотность от других атомов. Самый электроотрицательный элемент - фтор, самый электроположительный - франций. ИОННАЯ СВЯЗЬ Ионы - это заряженные частицы, в которые превращаются атомы в результате отдачи или присоединения электронов.
(фторид натрия состоит из ионов натрия Na+ и фторид-ионов F-) Если разность электроотрицательностей атомов велика, то электронная пара, осуществляющая связь, переходит к одному из атомов, и оба атома превращаются в ионы. Химическая связь между ионами, осуществляемая за счет электростатического притяжения, называется ионной связью. ВОДОРОДНАЯ СВЯЗЬ Водородная связь - зто связь между положительно заряженным атомом водорода одной молекулы и отрицательно заряженным атомом другой молекулы. Водородная связь имеет частично электростатический, частично донорно-акцепторный характер.
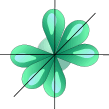
Наличие водородных связей объясняет высокие температуры кипения воды, спиртов, карбоновых кислот ГИБРИДИЗАЦИЯ ОРБИТАЛЕЙ Гибридизация орбиталей - это изменение формы некоторых орбиталей при образовании ковалентной связи для достижения более эффективного перекрывания орбиталей. A sp3- Гибридизация. Одна s- орбиталь и три p- орбитали превращаются в четыре одинаковые "гибридные" орбитали, угол между осями которых равен 109°28'.
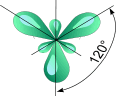
Молекулы, в которых осуществляется sp3- гибридизация, имеют тетраэдрическую геометрию (CH4, NH3). sp2- Гибридизация. Одна s- орбиталь и две p- орбитали превращаются в три одинаковые "гибридные" орбитали, угол между осями которых равен 120°.
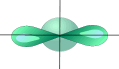
Если связь образуется при перекрывании орбиталей по линии, соединяющей ядра атомов, она называется s- связью. Если орбитали перекрываются вне линии, соединяющей ядра, то образуется p- связь. Три sp2- орбитали могут образовывать три s- связи (BF3, AlCl3). Еще одна связь (p- связь) может образоваться, если на p- орбитали, не участвующей в гибридизации, находится электрон (этилен C2H4). Молекулы, в которых осуществляется sp2- гибридизация, имеют плоскую геометрию. sp- Гибридизация. Одна s- орбиталь и одна p- орбиталь превращаются в две одинаковые "гибридные" орбитали, угол между осями которых равен 180°.
Две sp- орбитали могут образовывать две s- связи (BeH2, ZnCl2). Еще две p- связи могут образоваться, если на двух p- орбиталях, не участвующих в гибридизации, находятся электроны (ацетилен C2H2). Молекулы, в которых осуществляется sp- гибридизация, имеют линейную геометрию. Полярность ковалентной связи Полярность химической связи зависит от разности электроотрицательностей связываемых атомов. Чем больше разность ЭО двух атомов в связи, тем она более полярная. Для ионной связи существует понятие степень ионности, которое тоже зависит от того, насколько велика разность электроотрицательностей атомов. Вопрос №5 Кванты и модель Бора В настоящий момент существуют две модели атома: модель Бора (классическая) иквантово-механическая. Первая модель довольно проста для понимания, но она не подходит для описания атомов со сложной структурой. Вторая модель описывает любую структуру атома, но весьма сложна в понимании, т.к. в ее основе лежат сложные математические расчеты. Модель Бора Представьте, что электроны в атоме движутся по определенным электронным орбитам - по аналогии с движениями планет Солнечной системы. Каждая планета движется по своей орбите, так и электроны вращаются вокруг ядра атома. Каждая такая орбита для электрона получила название "уровень энергии". Энергия электронов в атоме может изменяться только скачкообразно. Т.е. электрон может перескакивать с одной орбиты на другую и обратно (но не может занимать положение между орбитами). Говорят, что энергетические состояния электронов в атоме квантованы. Энергия электрона зависит от радиуса его орбиты. Минимальная энергия у электрона, который находится на ближайшей к ядру орбите. При поглощении кванта энергии электрон переходит на орбиту с более высокой энергией (возбужденное состояние). И наоборот, при переходе с высокого энергетического уровня на более низкий - электрон отдает (излучает) квант энергии. 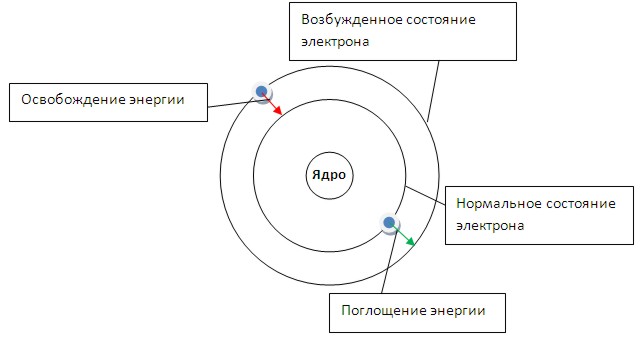 Кроме того, Бор указал, что разные энергетические уровни содержат разное количество электронов: первый уровень - до 2 электронов; второй уровень - до 8 электронов… К сожалению, описать атомы со сложной структурой, опираясь на модель Бора, не представляется возможным. Поэтому, в 20-х годах прошлого века получила широкое распространение квантово-механическая модель (КММ) атома. Квантово-механическая модель строения атома В основу КММ положена квантовая теория атома, согласно которой электрон обладает как свойствами частицы, так и свойствами волны. Другими словами, о местоположении электрона в определенной точке можно судить не точно, а с определенной долей вероятности. Поэтому в КММ орбиты Бора заменилиорбиталями (эдакие "электронные облака" - области пространства в которых существует вероятность пребывания электрона). Состояние электрона в атоме описывают с помощью 4 чисел, которые называют квантовыми:
Главное квантовое число n Описывает:
Чем больше значение n, тем выше энергия электрона и больше размер электронного облака. Если в атоме несколько электронов с одинаковым n, то они образуют электронные облака одинакового размера - электронные оболочки. Орбитальное квантовое число l (азимутальное) Описывает форму орбитали, которая зависит от n. Орбитальное число l может принимать целочисленные значения в диапазоне от 0 до n-1. Например, при n=2: l=0 l=1
Орбитали, имеющие одинаковое n, но разные l называют энергетическими подуровнями и обозначают буквами латинского алфавита:
Состояние электрона в атоме для различных главных и орбитальных квантовых чисел принято записывать следующим образом: 2s; 3p; 3d… Магнитное квантовое число m Описывает ориентацию орбиталей в пространстве. Может принимать целочисленные значения в диапазоне от -l до +l (включая 0). Например: Для l=0 возможно только одно значение: m=0. Это значит, что s-орбиталь имеет только одну пространственную ориентацию. Для l=1: m=-1;0;+1 - p-орбиталь имеет три пространственные ориентации. Для l=2: m=-2;-1;0;+1;+2 - d-орбиталь имеет пять пространственных ориентаций. Спиновое квантовое число ms Описывает направление вращения электрона в магнитном поле - по часовой стрелке или против. На каждой орбитали может находиться только два электрона: один со спином +½ другой -½. Квантовые числа для первых трех энергетических уровней:
На первом уровне (n=1) есть только s-орбиталь, на которой может находиться только 2 электрона со спинами +1/2 и -1/2. Это справедливо для s-орбитали любого уровня: 1s; 2s; 3s… На втором энергетическом уровне (n=2) есть уже две орбитали s; p. На третьем (n=3) - три орбитали: s, p, d. и т.д. С каждым новым энергетическим уровнем добавляется новая орбиталь. Для 2p-орбитали существует три пространственных ориентации (формы облака), на каждой из которых может находиться по два электрона. Т.е. на втором энергетическом может находиться не более 6 p-электронов. Для 3d - максимум 10 d-электронов и пять форм облаков. Главные энергетические уровни отличаются энергией. Чем выше уровень - тем выше энергия. С другой стороны, различные орбитали одного и того же уровня также обладают разной энергией: Энергия электронов на орбитали 2p выше, чем на 2s Энергия электронов на орбитали 3p выше, чем на 3s Энергия электронов на орбитали 3d выше, чем на 3s Энергия электронов на орбитали 3d выше, чем на 3p Что же касается электронов "внутри орбиталей", то их энергии одинаковы (так у всех десяти электронов 3d-орбитали энергии одинаковы). Вопрос №6 Соединения галогенов с кислородом Кислородсодержащие соединения галогенов Все кислородные соединения галогенов получены косвенным путем. Наиболее устойчивы соли, наименее — оксиды и кислоты. Для галогенов характерно образование большого числа оксидов, отвечающих различным степеням окисления. Больше всего ионы BrO-2 и IO-2 очень неустойчивы. устойчивых оксидов образует хлор Сl, меньше всего — иод I. 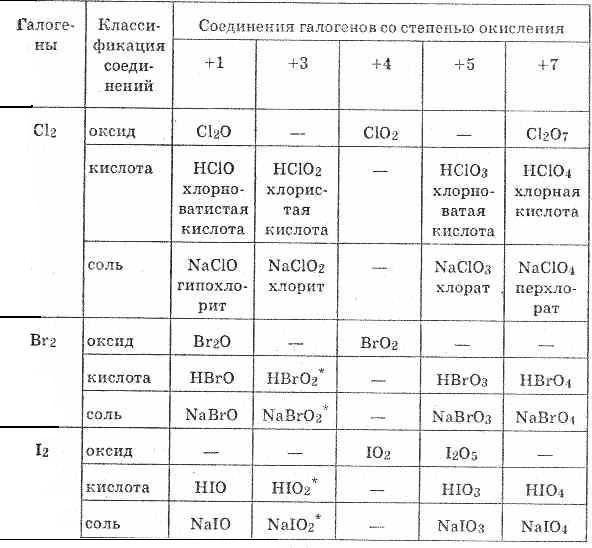 Из соединений кислорода с фтором существует фторид кислорода F-12О+2: Связь между атомами фтора и кислорода ковалентная, очень близка к неполярной. Это бесцветный газ с резким запахом озона, плохо растворим в воде, tкипения=-145°С. Был открыт в 1929 году. получается взаимодействием фтора с 2% -ным раствором гидроксида натрия: 2F2+2NaOH=2NaF+Н2О+F2O I Рассмотрим важнейшие из кислородных соединений остальных галогенов. Все оксиды неустойчивы, разлагаются с большим выделением тепла. Оксид хлора (I) Сl2О — газ буро-желтого цвета с неприятным запахом. Характеризуется низкой температурой кипения, относительная плотность по воздуху равна 3. Связь в молекуле оксида малополярная ковалентная. Обладает следующими химическими свойствами: 1. При нагревании легко распадается (со взрывом) на хлор и кислород: 2С12O=t2Сl2+О2 2. Будучи кислотным оксидом, гидратируется с образованием хлорноватистой кислоты: Сl2O+Н2O=2НСlO 3. Взаимодействует с щелочами и основными оксидами: Сl2O+2NaOH=2NaClO+Н2O Сl2O+K2O=2KСlO Оксиду хлора (I) соответствует хлорноватистая кислота. Хлорноватистая кислота НСlO и ее бромный и йодный аналоги — очень слабые кислоты, причем их сила уменьшается при переходе от НСlO к НIO. Это объясняется тем, что хлор обладает большей электроотрицательностью и сильнее своих аналогов притягивает электронную пару, связывающую его с кислородом. Это в свою очередь приводит к смещению электронной пары, связывающей водород с кислородом, к кислороду и увеличению способности водорода к отщеплению. Хлорноватистая кислота представляет собой раствор желто-зеленого цвета с характерным запахом. Она и ее аналоги обладают всеми свойствами слабых летучих кислот, являются кислотами-окислителями. Причем окислительная активность в ряду НСlO, НBrO, НIO снижается. 1. На свету хлорноватистая кислота разлагается: НСl+1O-2 =hv НСl-1+О0 2. При действии водоотнимающих средств распадается: 2НСl+1O=Сl+12O+Н2О 3. При нагревании хлорноватистой кислоты образуется соляная и хлорноватая кислоты: 3НСl+1О=2НСl-1+НСl+5O3 окислитель Сl++2е- Сl-восстановитель Сl+-4е- Сl+5 Наибольшее значение имеют соли кислородных кислот хлора. Все их можно получить, исходя из реакции взаимодействия хлора с водой. Сl2+Н2ОНСl+НСlO Равновесие этой реакции легко сместить в сторону продуктов реакции, добавив в раствор щелочи, которая реагирует с двумя образующимися кислотами: НСl+НСlO+2КОН=КСl+КСlO+2Н2O I Просуммировав эти два уравнения, получим: Сl2+2КОН=КСl+КСlO+Н2O Сl2+2OH-=Сl-+СlO-+Н2О Соли хлорноватистой кислоты называют гипохлоритами. Водный раствор, содержащий гипохлорит и хлорид калия, называют жавелевой водой. Она, как и хлорная (раствор хлора в воде) вода, употребляется для беления хлопчатобумажной ткани и бумаги. Механизм окисляющего и дезинфицирующего действия хлорноватистой кислоты и ее солей объясняют наличием хлора со степенью окисления +1, проявляющего в этих процессах активные окислительные свойства. Сl++1e-Сl° Сl++2e-Сl- Гипохлориты — очень сильные окислители. При пропускании хлора в раствор щелочи, нагретый до 100°С, процесс протекает с образованием хлоратов (солей хлорноватой кислоты НСlO3) и хлоридов: ЗСl2+6КОН=5КСl+КСlO3+3Н2O ЗСl2+6OH-=5Сl-+СlO-3+3Н2О При нагревании до 400°С в отсутствие катализаторов из хлоратов образуются перхлораты (соли хлорной кислоты НСlO4): 4КСlO3=3КСlO4+КСl В присутствии катализатора (MnO2) процесс протекает по уравнению: 2КСlO3=2КСl+3O2 Таким образом, соли кислородных кислот хлора получают взаимодействием хлора с щелочью. При этом при комнатной температуре образуются гипохлориты, при 100°С — хлораты. Это окисли-тельно-восстановительные реакции. Хлористая кислота НСlО2 — средней силы. Она малоустойчива в водных растворах, а ее аналоги брома и иода еще менее прочны. Сила кислородных кислот хлора возрастает с ростом степени окисления центрального атома: НСl+1O — слабая; НСl+3O2 — несколько более сильная; НСl+5O3 — очень сильная и НСlO+74 — самая сильная из всех известных кислот. Если хлор взаимодействует с гидроксидом кальция, который берется в виде порошка — пушонки, то образуется хлорная, или белильная, известь — рыхлый белый порошок с запахом хлора. Она состоит главным образом из гипохлорита кальция Са(СlO)2, основных солей кальция и хлорида кальция. Примерное уравнение: 2Сl2+2Са(ОН)2=Са(СlO)2+СаСl2+2Н2О Часто для повышения качества хлорной извести к ней добавляют Са(СlO)2. Хлорная известь — сильный окислитель. Она очень реакционноспособна. Применяется для беления хлопчатобумажных тканей, бумаги, для хлорирования воды, дезинфекции, а также для дегазации местности, зараженной стойкими отравляющими веществами. Белящие и дезинфицирующие свойства хлорной извести аналогичны свойствам жавелевой и хлорной воды: угольная кислота вытесняет из гипохлорита кальция хлорноватистую кислоту; на свету она разлагается с выделением атомарного кислорода, который и оказывает окисляющее действие. Вопрос №7 Подгруппа кислорода. Сера, селен, теллур. В подгруппу кислорода входит пять элементов: кислород, сера, селен, теллур и полоний (радиоактивный металл). Это р-элементы VI группы периодической системы Д.И.Менделеева. Они имеют групповое название – халькогены, что означает «образующие руды». |