Ответы на вопросы по химии. Д. И. Менделеева. Структура периодической системы
 Скачать 0.81 Mb. Скачать 0.81 Mb.
|
Свойства элементов подгруппы кислорода
У атомов халькогенов одинаковое строение внешнего энергетического уровня — ns2nр4. Этим объясняется сходство их химических свойств. Все халькогены в соединениях с водородом и металлами проявляют степень окисления -2, а в соединениях с кислородом и другими активными неметаллами — обычно +4 и +6. Для кислорода, как и для фтора, не типична степень окис ления, равная номеру группы. Он проявляет степень окисления обыч но -2 и в соединении со фтором +2. Такие значения степеней окисления следуют из электронного строения халькогенов 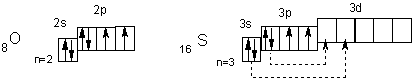 У атома кислорода на 2р-подуровне два неспаренных электрона. Его электроны не могут разъединяться, поскольку отсутствует d-подуровень на внешнем (втором) уровне, т. е. отсутствуют свободные орбитали. Поэтому валентность кислорода всегда равна двум, а степень окисления -2 и +2 (например, в Н2О и ОF2). Таковы же валентность и степени окисления у атома серы в невозбужденном состоянии. При переходе в возбужденное состояние (что имеет место при подводе энергии, например при нагревании) у атома серы сначала разъединяются Зр-, а затем 3s-электроны (показано стрелками). Число неспаренных электронов, а, следовательно, и валентность в первом случае равны четырем (например, в SO2), а во втором — шести (например, в SO3). Очевидно, четные валентности 2, 4, 6 свойственны аналогам серы — селену, теллуру и полонию, а их степени окисления могут быть равны -2, +2, +4 и +6. Водородные соединения элементов подгруппы кислорода отвечают формуле Н2R (R - символ элемента): Н2О, Н2S, Н2Sе, Н2Те. Они называются хальководородами. При растворении их в воде образуются кислоты. Сила этих кислот возрастает с ростом по рядкового номера элемента, что объясняется уменьшением энергии связи в ряду соединений Н2R. Вода,диссоциирующая на ионы Н+ и ОН-, является амфотерным электролитом. Сера, селен и теллур образуют одинаковые формы соединений с кислородом типа RО2 и RО3-. Им соответствуют кислоты типа Н2RО3 и Н2RО4-. С ростом порядкового номера элемента сила этих кислот убывает. Все они проявляют окислительные свойства, а кислоты типа Н2RО3 также и восстановительные. Закономерно изменяются свойства простых веществ: с увеличением заряда ядра ослабевают неметаллические и возрастают металлические свойства. Так, кислород и теллур — неметаллы, но последний обладает металлическим блеском и проводит электричество. Вопрос №№8,9 Основные понятия и законы химии: вещество, поле, атом, молекула, моль. У истока основных понятий химии стоит атомно-молекулярное учение, которое дает определение молекулы и атома: Молекула — это наименьшая частица определенного вещества, которая обладает его химическими свойствами. Состав и химическое строение молекулы определяют ее химические свойства. Все вещества состоят из молекул, а молекулы из атомов. Атом – это наименьшая частица химического элемента, входящая в состав молекул простых и сложных веществ, это электронейтральная частица, которая состоит из положительно заряженного ядра атома и отрицательно заряженных электронов, вращающихся вокруг ядра. Молекулы и атомы находятся в постоянном движении. В настоящее время известно 110 элементов, 89 из которых найдены в природе, остальные получены искусственно (см. Интересные факты о химических элементах). Что же такое Химический элемент? Это такой вид атомов, который имеет определенный заряд ядра и строение электронных оболочек. Теперь рассмотрим строение атомного ядра и следующее основное понятие химии. Атомное ядро состоит из протонов (Z) и нейтронов (N), имеет положительный заряд, равный по величине количеству протонов (или электронов в нейтральном атоме) и совпадает с порядковым номером элемента в периодической таблице. Суммарная масса протонов и нейтронов атомного ядра называется массовым числом A = Z + N. Существуют химические элементы (изотопы), имеющие одинаковый заряд ядер, но при этом различные массовые числами, что достигается за счет разного числа нейтронов в ядре. Некая совокупность атомов и молекул, их ассоциатов и агрегатов, которые могут находиться в любом из трех агрегатных состояний, образуют вещество. Простые вещества состоят из атомов одного вида, а сложные вещества (химические соединения) состоят из атомов разного вида и образуются при химическом взаимодействии атомов разных химических элементов. Встречается явление, при котором один химический элемент может образовывать нескольких простых веществ, различных по свойствам и строению. Это явление называется Аллотропией. В 1814 г Й. Берцелиус предложил использовать химическую формулу — запись состава веществ с помощью химических знаков и индексов. Химическое вещество характеризуется атомной массой, а молекулы — молекулярной массой. Относительная атомная масса(Ar) – это отношение средней массы атома элемента (с учетом процентного содержания изотопов в природе) к 1/12 массы атома 12C. Относительная молекулярная масса (Mr) — величина, показывающая, во сколько раз масса молекулы данного вещества больше 1/12 массы атома углерода 12C. Относительная молекулярная масса вещества равна сумме относительных атомных масс всех элементов, составляющих химическое соединение, с учетом индексов. Моль вещества (n) — это количество вещества, содержащее столько молекул, атомов, ионов, электронов или других структурных единиц, сколько содержится их в 12 г изотопа углерода 12C. Число структурных единиц, содержащихся в 1 моле вещества равно 6,02 • 1023.Эточисло называется числом Авогадро (NA) Молярная масса (M) показывает массу 1 моля вещества и равна отношению массы вещества к соответствующему количеству вещества. M = m / n Для более удобного сравнения способности различных элементов к соединению введено понятие химического эквивалента. Это одно из важнейших понятий химии , дадим ему определение: Химическим эквивалентом вещества называется такое его количество, которое соединяется с 1 молем атомов водорода или замещает то же количество атомов водорода в химических реакциях. Масса 1 эквивалента вещества называетсяэквивалентной массой (mэкв). Эквивалентную массу соединения можно определить по его химической формуле, например, m экв(оксида) = М (оксида)/(число атомов кислорода*2); m экв(основания) = М (основания)/число гидроксильных групп; m экв(кислоты) = М кислоты/число протонов; m экв(соли) = М соли /(число атомов металла*валентность металла). Аналогично можно дать определение понятию эквивалентный объем. Эквивалентный объем – это тот объем, который при данных условиях занимает 1 эквивалент вещества. Так как эквивалент водорода равен 1 моль, а в 22,4 л Н2 содержатся 2 эквивалента водорода; тогда эквивалентный объем водорода равен 22,4/2=11,2 л/моль, для О2 эквивалентный объем равен 5,6 л/моль. Определить эквивалент вещества можно также по его соединению с другим веществом, эквивалент которого известен. Определить молярную массу эквивалента (эквивалентную массу) можно исходя иззакона эквивалентов, который гласит, что химические элементы соединяются между собой или замещают друг друга в количествах, пропорциональных их молярным массам эквивалентов: m1/m2=Мэкв1/ Мэкв2, где где m1 и m2 — массы реагирующих или образующихся веществ, m экв1 и m экв2 — эквивалентные массы этих веществ. ОСНОВНЫЕ ЗАКОНЫ ХИМИИ Нижеперечисленные законы принято считать основными законами химии. В 1756 г. М.В. Ломоносов, после длительных испытаний, пришел к важному открытию: вес всех веществ, вступающих в химическую реакцию, равен весу всех продуктов реакции. Закон сохранения вещества отражается в законе сохранения массы, который заключается в следующем: масса веществ, вступивших в химическую реакцию, равна массе всех продуктов реакции. Вещества не исчезают и не возникают из ничего, а происходит химическое превращение. Закон является основой при составлении химических реакций и количественных расчетов в химии. В 1808 Ж. Пруст сформулировал Закон постоянства состава, который гласит, что независимо от способа получения все индивидуальные вещества имеют постоянный количественный и качественный состав. В 1803 г Д. Дальтон открыл Закон кратных отношений, заключающийся в том, что если два химических элемента образуют несколько соединений, то весовые доли одного и того же элемента в этих соединениях, приходящиеся на одну и ту же весовую долю второго элемента, относятся между собой как небольшие целые числа. В 1808 г Гей-Люссак сформулировал Закон объемных отношений: «Объемы газов, вступающих в химические реакции, и объемы газов, являющихся продуктами реакции, соотносятся между собой как небольшие целые числа». Важную роль в развитии химической науки сыграли газовые законы (справедливы только для газов). В 1811 г. Авогадро ди Кваренья (Закон Авогадро) доказал, что- в равных объемах любых газов при постоянных условиях (температуре и давлении) содержится одинаковое число молекул. В одинаковых условиях одно и то же число молекул занимают равные объемы, а 1 моль любого при T=273°К и p=101,3 кПа газа занимает объем 22,4 л, который называется молярным объемом газа (Vm). Независимо друг от друг трое ученых вывели следующие законы: закон Гей-Люссакапри P = const: V1 / T1 = V2 / T2; закон Бойля-Мариотта при Т= const:P1V1 = P2V2; закон Шарля при V = const:P1 / T1 = P2 / T2 При объединении этих трех законов получаем: P1V1 / T1 = P2V2 / T2 Если условия отличаются от нормальных, то применяют уравнение Клапейрона – Менделеева: pV = nRT = (m/M)RT, где p — давление газа, V — его объем, n — количество молей газа, R — универсальная газовая постоянная (8,314 Дж/(моль*К). Количество газа при нормальных условиях рассчитывают по формуле: n = V/Vm = V/22,4. Плотность газов при заданных давлении и температуре прямо пропорциональна их молярной массе: ρ = m/V = pM/(RT) = (p/RT)M. Относительная плотность газов показывает, во сколько раз один газ тяжелее другого. Плотность газа В по газу А определяется следующим образом: DA(B) = ρ(В)/ρ(А) = М(В)/М(А). Это основные законы химии. В заключение приведем Закон парциальных давлений (закон Дальтона). Парциальное давление в смеси равно тому давлению газа, которым он обладал бы, если бы занимал такой же объем, какой занимает вся смесь при той же температуре. При условии, что в газовой смеси нет химического взаимодействия, общее давление газовой смеси равно сумме парциальных давлений газов, входящих в эту смесь: pобщ=p1+p2+p3+…+pn Состав газовых смесей может выражаться количеством вещества (n), массовыми (ωn), объемными (φn) и молярными (χ) долями: ωn=mn/m φn=Vn/V χ=ni/∑ni Вопрос №10 Химия d- и f- элементов. Переходные элементы- элементы с валентными d- и f- электронами. При заполненном внешнем ns-подуровне с увеличением атомного номера каждый следующий электрон размещается не на внешнем np, а на предвнешнем (n-1)d-подуровне до тех пор , пока он не будет заполнен. Исключениями являются: Cu, Cr, Ag, Au и некоторые другие элементы. В атомах этих элементов на внешнем ns подуровне по одному электрону при недостроенном (n-1) d подуровне, однако именно такое строение электронных оболочек этих атомов наиболее энергетически выгодно. При таком случае подуровень d заполнен на половину или полностью, а такие d подуровни обладают большей устойчивостью, чем частично заполненные - это явление провала электрона. Следовательно d элементы занимают промежуточное положение между s и p элементами. К переходным так же относятся и f элементы, у которых достраивается (n-2) f уровень электронной оболочки. Строение электронных оболочек атомов d элементов приблизительно одинаково: на внешнем ns уровне один или два электрона, изменения происходят на предвнешнем уровне, поэтому свойства d элементов меняются менее резко, чем s и p элементах. Для атомов всех d элементов характерны низкие энергии ионизации, все имеют свободные валентные орбитали. Следовательно, все d элементы - металлы с присущими им свойствами: металлическим блеском, прочностью, ковкостью, электропроводностью и т.д. Особенности: 1) наличие частично заполненных d орбиталей позволяет атомам проявлять в соединениях разные степени окисления . 2) появление тенденции к образованию комплексных соединений 3) характерно образование окрашенных соединений. При увеличении числа электронов на d подуровне наблюдается d сжатие, когда радиус становится меньше из-за притяжения электронов к ядру. Некоторые элементы начинают проявлять некоторые свойства неметаллов. Чтобы определить свойства соединений с d элементами, нужно знать какую степень окисления проявляет данный элемент. В целом возрастание степени окисления сопровождается усилением кислотных свойств и ослаблением основных. Чем больше степень окисления, тем выше способность к образованию комплексов. f элементы, как и d элементы относятся к переходным элементам. Они расположены в 6,7 периодах переодической системы. 4f- элементы объединяют в семейство лантаноидов, а 5 f элементы - семейство актиноидов. Лантаноиды. Семейство из 14 элементов (4f-элементы), следующих за La, общий символ Ln. Электронные конфигурации Ln отражают внутреннюю периодичность, проявляющуюся в некоторых свойствах Ln 3+, у которых 4f-орбитали заполняются сначала по одному (подсемейство церия: Ce – Gd), а потом по второму электрону (подсемейство тербия: Tb – Lu). Уменьшение атомных и ионных радиусов приводит к лантаноидному сжатию, вследствие которого элементы, следующие за Lu, по своим свойствам оказываются очень похожими на своих предшественников по группам (Zr и Hf, Nb и Ta, Mo и W, Tc и Re). Cеребристо-белые металлы, тускнеющие во влажном воздухе, при нагревании разлагают воду, взаимодействуют со всеми кислотами (кроме H 3PO 4 и HF), образуя преимущественно ионы Ln 3+, другие степени окисления свойственны Ce, Pr, Tb, Dy (4+), Sm, Eu, Tm, Yb (2+). С H, B, C, N, O, халькогенами, галогенами образуют вполне устойчивые соединения. По химическим свойствам достаточно схожи, разделяют ионообменной хроматографией и экстракцией. Разделенные Ln 3+ используют для получения химических соединений с нужными люминесцентными, спектроскопическими и магнитными свойствами, изготовления неодимовых стекол (лазеры), люминесцентных преобразователей (приборы ночного видения), изготовления постоянных магнитов (SmCo 5). Основная доля используется в виде смесей металлов или оксидов и других соединений с природным содержанием Ln для изготовления катализаторов, легирующих добавок в металлургии, полировочных паст, аккумуляторов газообразного водорода (LnNi 5) и др. Актиноиды. Семейство из 14 элементов, следующих за Ac, (5f-семейство), общий символ An. Первые три – Th, Pa, U – встречаются в природе, их наиболее долгоживущие изотопы – 232Th (T 1/2 = 1,4·10 10 лет), 231Pa (T 1/2 = 3,43·10 4 лет), 238U (T 1/2 = 4,5·10 9 лет). Остальные An были получены ядерным синтезом в лабораториях США и России, все радиоактивны. Делятся на два подсемейства Th – Cm (цискюриды) и Bk – Lr (транскюриды). Первое подсемейство во многом отличается от соответствующих лантаноидов, проявляя помимо An 3+ и более высокие степени окисления An 4+ (Th, Pa, Am, Cm), An 4+, 5+, 6+ (U, Np, Pu) и даже Pu 7+. Второе подсемейство по химическим свойствам ближе к соответствующим лантаноидам, хотя для менделевия известны соединения Md 1+, а для лоуренсия – Lr 4+. Вопрос №11 Координационные соединения Координационными (комплексными) соединениями (КС) называют вещества, содержащие комплексные частицы. В состав комплексных частиц входят центральный атом или ион (комплексообразователь) и связанные с ним молекулы или ионы (лиганды). Химические реакции с участием координационных соединений могут затрагивать сам комплексообразователь, его связи с лигандами, а также химические связи внутри лигандов. Комплексные частицы могут быть как электронейтральными, так и иметь положительный или отрицательный электрический заряд, т.е. являться катионами или анионами. В роли комплексообразователя обычно выступает ион или атом металла, хотя в ряде случаев им может быть и неметалл, например, кремний и фосфор в анионах [SiF6]2– и [PCl6]–, соответственно. Число связей, образуемых комплексообразователем с лигандами, называют его координационным числом (КЧ); в приведенных примерах оно равно 6. Лигандами, как правило, являются молекулы или ионы, способные быть донорами электронных пар. Наиболее простые примеры – молекулы воды (H2O) и аммиака (NH3), галогенид-ионы (F–, Cl–, Br–, I–), а также многоатомные анионы (CN–, NO3–, S2O32–). Известны также КС, в которых донором электронных пар является комплексообразователь, а лиганды – их акцепторами. Таковы, например, соединения переходных металлов с молекулами оксида углерода – карбонилы металлов (Fe(CO)5, Cr(CO)6 и т.п.). Для КС типичны реакции замещения лигандов, реакции, в которых комплексообразователь принимает или отдает электроны, а также реакции, в которых химическому превращению подвергаются сами лиганды. ↑Развитие представлений о коордиционных соединениях. Понятие о координационных соединениях (лат. co – вместе, ordinatio – упорядочение) как об особом классе химических соединений было введено в 1893 г. швейцарским химиком А. Вернером (1866–1919). Его координационная теория объяснила состав и строение ряда известных к тому времени веществ, не укладывавшиеся в существовавшие в конце XIX века представления о валентности атомов различных элементов. Вернером были предложены представления о координационной связи как особом типе химической связи, комплексообразователе, его координационном числе и координационном окружении. Становление координационной химии в России и СССР связано с именами Л.А. Чугаева (1873–1922) и И.И. Черняева (1893–1966). Во второй половине XX века химикам стал известен ряд фактов, потребовавших расширения и обобщения координационной теории. Во-первых, была определена структура ферроцена – соединения, в котором катион железа расположен между двумя параллельно расположенными плоскими анионами C5H5–. Во-вторых, были синтезированы соединения, содержащие связи металл–металл (кластеры). Наконец, исследование структуры ряда веществ, считавшихся до того "классическими", т.е. не координационными, показало, что в действительности они тоже не соответствуют правилам валентности. Например, метиллитий CH3Li в кристаллическом состоянии состоит из молекул (СH3Li)4, в которых четыре атома лития образуют тетраэдр, а метильные группы CH3 располагаются над центрами его граней. Таким образом, каждый атом лития связан с тремя соседними атомами Li и тремя атомами C метильных групп, тогда как классическая теория приписывает ему валентность равную 1. Все это вместе с развитием вычислительных методов квантовой химии привело к осознанию того, что не существует непроницаемых границ между химией координационных соединений и другими разделами химии, а такие понятия, как координационное окружение, координационное число и лиганд, являются общими понятиями химии в целом. На современном этапе развитие координационной химии сопряжено с прогрессом в области нанотехнологий. Актуальными задачами являются, во-первых, синтез и стабилизация наночастиц заданного размера, состава и строения, а во-вторых – разработка методов создания надмолекулярных (супрамолекулярных) структур путем самосборки отдельных молекул. Первая задача стимулирует исследования в области химии гигантских кластеров, состоящих из сотен и тысяч атомов металла. В рамках решения второй задачи ведутся разработки координационных полимеров, а также КС, обладающих жидкокристаллическими свойствами. Строение координационных соединений. В различных КС комплексообразователь имеет в своем окружении от 2 до 12 лигандов, но чаще всего встречаются КЧ 6 и 4. В первом случае комплексообразователь находится в центре октаэдра, второму значению соответствуют два типа координационного окружения – квадрат и тетраэдр. Лиганды, образующие с комплексообразователем только одну связь, называются монодентатными. Если лиганд образует с комплексообразователем несколько связей, то его называют полидентатным. Лиганд, связанный одновременно с двумя или большим числом комплексообразователей, называют мостиковым, а соответствующие КС – полиядерными. Как правило, полидентатные лиганды образуют намного более устойчивые КС, чем аналогичные по химической природе монодентатные лиганды. Это явление получило название хелатного эффекта. Сконструированы полидентатные лиганды с повышенной способностью к образованию КС, называемые комплексонами. Наиболее широко применяемым на практике комплексоном является этилендиаминтетрауксусная кислота, анион которой образует очень прочные КС с катионами всех металлов, за исключением щелочных. Однако и на щелочные металлы «нашлась управа»: они образуют очень прочные соединения с так называемыми макроциклическими лигандами. В качестве примера на рисунке изображен комплекс иона Na+ с макроциклическим лигандом, называемым [2.2.1]-криптандом. Этот лиганд имеет несколько донорных атомов, и все они образуют координационные связи с ионом Na+. Макроциклы не только дают очень устойчивые комплексы, они еще и очень селективны: данный макроцикл, как правило, прочно связывается только с ионами определенного размера, встраивающимися в «дырку» в середине макроцикла (Нобелевская премия за 1978 год). Примеры природных макроциклических комплексных соединений – хлорофилл и гемоглобин. Для КС характерно явление изомерии, когда вещества одинакового состава различаются по строению и, следовательно, по свойствам. Важнейшим видом изомерии КС является геометрическая изомерия. Геометрические изомеры различаются способами расположения лигандов друг относительно друга. Например, в цис-изомере комплексной частицы [Pt(NH3)2Cl2], имеющей квадратное строение, лиганды одного типа находятся рядом, а в транс-изомере – напротив друг друга. Цис-транс-изомерия присуща также октаэдрическим комплексам, но невозможна в тетраэдрических. С современной точки зрения координационная связь, так же как и другие виды химической связи, имеет электронную природу и ее образование описывается как результат перекрывания валентных орбиталей комплексообразователя и лигандов. В зависимости от способа перекрывания орбиталей связи комплексообразователь-лиганд относят к σ- или к π-типу. В некоторых КС оба типа связывания осуществляются одновременно, например, в карбонилах металлов лиганды CO являются σ-донорами и π-акцепторами электронных пар. Существующие теории химической связи в КС позволяют предсказывать их строение, устойчивость, цвет и магнитные свойства. ↑ Химические реакции с участием координационных соединений. Образование КС оказывает большое влияние на способность комплексообразователя принимать и отдавать электроны, т.е. на его окислительно-восстановительные свойства. При этом могут стабилизироваться степени окисления комплексообразователя, которые неустойчивы в составе "обычных", не координационных, соединений. В присутствии молекул или ионов, способных выступать в качестве лигандов, инертные металлы (золото, платина) могут быть окислены сравнительно слабыми окислителями. Например, металлическое золото не реагирует с кислородом воздуха, но легко окисляется им в растворе цианида калия. Эта реакция используется для извлечения золота из золотоносных пород. Исторически сложилось, что в химии КС большое внимание уделяется реакциям замещения одних лигандов в координационном окружении другими. Эти реакции очень сильно различаются по скорости. Если они протекают быстро, соответствующие КС называют лабильными, а если медленно – то инертными. Образование химических связей с комплексообразователем приводит к изменению электронной структуры лигандов, поэтому координированные лиганды часто оказываются способными вступать в реакции, нехарактерные для свободных лигандов. Это свойство находит применение в многочисленных промышленных каталитических процессах, на промежуточных этапах которых происходит образование КС. Например, катализируемая солями палладия реакция окисления этилена кислородом до уксусного альдегида протекает через стадию образования КС иона Pd2+ с молекулой этилена. Кроме того, на протекание химических реакций с участием лигандов оказывает влияние тот факт, что лиганды в составе КС имеют определенную взаимную пространственную ориентацию. Это явление легло в основу так называемого темплатного синтеза или синтеза на матрицах, в котором из относительно простых по строению лигандов получают сложные органические молекулы заданного строения. Практически важным примером темплатного синтеза является получение фталоцианиновых комплексов металлов из солей этих металлов и простого органического вещества – фталонитрила. По-видимому, по механизму темплатного синтеза в живых организмах образуются такие сложные биомолекулы, как витамин B12. ↑ Координационные соединения в живой и неживой природе и их применение. Координационные соединения достаточно широко распространены в природе. Например, минерал криолит Na3AlF6 содержит в своем составе комплексные ионы [AlF6]3–. Такие КС как гем, хлорофилл, витамин B12 участвуют во многих биологических процессах. К КС относятся и многие ферменты, в которых комплексообразователем является ион металла, а лигандом – белковая молекула. Искусственно получаемые КС используются в качестве пигментов, катализаторов и лекарственных препаратов. Например, с начала XVIII века известен голубой пигмент "берлинская лазурь", состав которого приближенно описывается формулой Fe4[Fe(CN)6]3. Ценными пигментами являются также комплексы различных переходных металлов со сложными органическими лигандами – фталоцианинами. Практически весь полиэтилен производится с использованием катализатора Циглера-Натта – КС, в котором комплексообразователями являются ионы алюминия и титана, а лигандами – хлорид-ионы. Из медицинских применений можно отметить использование некоторых КС платины в качестве препаратов для химиотерапии онкологических заболеваний (например, цис-платин), а также КС железа при лечении железодефицитной анемии (препараты ферамид и Феррум Лек). Для выведения из организма некоторых ядов используют образование очень прочных комплексов токсичных ионов с полидентатными лигандами (хелатотерапия). Реакции образования КС используются в аналитической химии (комплексонометрия), а также при извлечении металлов из руд или для растворения осадков малорастворимых солей. В последнем случае находят применение упомянутые в разделе 2 комплексоны. Недавние исследования в области химии КС открывают новые перспективы их применения. Одним из примеров является создание «молекулярных магнитов» на основе кластеров и полиядерных комплексов. Такие «магниты» могут обеспечивать запись информации с огромной плотностью, не доступной для традиционных магнитных материалов. Другой пример – синтез металлорганических координационных полимеров (МКП) – соединений, состоящих из ионов металлов или кластеров, соединенных друг с другом органическими мостиковыми лигандами. Образующиеся МКП с сетчатой или трехмерной структурой имеют поры, в которые могут проникать молекулы различных веществ. Структурой получаемых МКП можно управлять, используя для их синтеза мостиковые лиганды соответствующего строения. В настоящее время ведутся исследования по применению МКП в качестве селективных катализаторов, для разделения оптических изомеров, а также для очистки и разделения газов. Существуют перспективы использования МКП для хранения газообразного водорода – вероятного теплоносителя в энергетике будущего. Материалы, структура которых образуется в результате сочетания органических и неорганических фрагментов, получили название органо-неорганических гибридов. От них ожидают проявления свойств, считающихся характерными для неорганических соединений: металлической электропроводности, высокотемпературной сверхпроводимости, ферромагнетизма и т.д. Вопрос №12 Химия s- и p-элементов. Соединения s-элементов. Органогены. s-Элементы Элементы IА и IIА подгрупп , у которых заполняется внешний ns-уровень, относятся к s-элементам: ns 1 – Li, Na, K, Rb, Cs, Fr называют щелочными , а ns 2 – Be, Mg, Ca, Sr, Ba, Ra –щелочноземельными . Из приведенных в таб. 8.1 данных следует:
s -Металлы хранят в инертной атмосфере или под слоем жидких углеводородов, а получают обычно электролизом расплавов. Соли s-элементов окрашивают пламя в цвета: лития – в алый, натрия – в желтый, калия – в сине-фиолетовый, рубидия – в темно-красный, цезия – в бледно-голубой, кальция – в оранжево-красный, стронция – в темно-красный, бария – в светло-зеленый. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
