Ответы на вопросы по химии. Д. И. Менделеева. Структура периодической системы
 Скачать 0.81 Mb. Скачать 0.81 Mb.
|
|
Подгру́ппа желе́за — химические элементы 8-й группы периодической таблицы химических элементов. В группу входятжелезо Fe, рутений Ru и осмий Os. На основании электронной конфигурации атома к этой же группе относится и искусственно синтезированный элемент хассий Hs. Все элементы группы 8 содержат 8 электронов на своих валентных оболочках. Два элемента группы — рутений и осмий — относятся к семейству платиновых металлов. Как и в других группах, члены 8 группы элементов проявляют закономерности электронной конфигурации, особенно внешних оболочек, хотя, как ни странно, рутений не следует этому тренду. Тем не менее, у элементов этой группы тоже проявляется сходство физических свойств и химического поведения. Железо как инструментальный материал известно с древнейших времён. История производства и использования железа берёт свое начало в доисторической эпохе, скорее всего, с использования метеоритного железа. Рутений открыт профессором Казанского университета Карлом Клаусом в 1844 году. Клаус выделил его из уральской платиновой руды в чистом виде и указал на сходство между триадами рутений — родий — палладий и осмий — иридий — платина. Он назвал новый элемент рутением в честь Руси (Ruthenia — латинское название Руси[5]). Осмий открыт в 1804 году английским химиком Смитсоном Теннантом в осадке, остающемся после растворения платины в царской водке. В чистом виде в природе железо редко встречается, чаще всего оно встречается в составе железо-никелевых метеоритов. Распространённость железа в земной коре — 4,65 % (4-е место после кислорода, кремния и алюминия[6]). Считается также, что железо составляет бо́льшую часть земного ядра. Содержание рутения и осмия в земной коре оценивается на уровне 2·10−11 %. Рутений является самым распространенным платиновым металлом в человеке, но почти самым редким из всех. Не выполняет биологической роли. Концентрируется в основном в мышечной ткани. Высший оксид рутения крайне ядовит и, будучи сильным окислителем, может вызвать возгорание пожароопасных веществ. Осмий, возможно, тоже существует в человеке в неощутимо малых количествах. Вопрос №42 Элементы 8-й главной подгруппы Благоро́дные газы (также инертные или редкие газы[1]) — группа химических элементов со схожими свойствами: при нормальных условиях они представляют собой одноатомные газы без цвета и запаха с очень низкой химической реактивностью. К благородным газам относятся гелий (He), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Xe) и радиоактивный радон (Rn). В последнее время к этой группе также причисляют унуноктий. Благородные газы химически неактивны и способны участвовать в химических реакциях лишь при экстремальных условиях. Характеристики благородных газов могут быть объяснены современными теориями об атомных структурах: их электронные оболочки из валентных электронов является «полными», тем самым позволяя участвовать лишь в очень малом количестве химических реакций, и возможно лишь несколько сотен соединений. Неон, аргон, криптон и ксенон выделяют из воздуха специальными установками, используя при этом методы сжижения газов и фракционированной конденсации. 2 Гелий He 1s2 10 Неон Ne 2s22p6 18 Аргон Ar 3s23p6 36 Криптон Kr 3d104s24p6 54 Ксенон Xe 4d105s25p6 86 Радон Rn 4f145d106s26p6 Химические свойства Неон, как и все благородные газы, имеет полную электронную оболочку. Все атомы благородных газов имеют на внешней орбите 8 электронов. Исключением является гелий (только 2 электрона) Благородные газы не имеют цвета, запаха, вкуса, а также не возгораются при нормальных условиях.
Соединения Структура XeF4, одного из первых когда-либо обнаруженного соединения благородных газов. Инертные газы отличаются химической неактивностью (отсюда и название). Тем не менее, в 1962 году Нил Барлетт показал, что все они при определённых условиях могут образовывать соединения (особенно охотно со фтором). Наиболее «инертны» неон и гелий: чтобы заставить их вступить в реакцию, нужно применить много усилий, искусственно ионизируя каждый атом. Ксенон же, наоборот, слишком активен (для инертных газов) и реагирует даже при нормальных условиях, демонстрируя чуть ли не все возможные степени окисления (+1, +2, +4, +6, +8). Радон тоже имеет высокую химическую активность, но он радиоактивен и быстро распадается, поэтому подробное изучение его химических свойств осложнено, в отличие от ксенона. Физические свойства Инертные газы имеют самые большие энергии ионизации. Инертные газы бесцветны и не имеют запаха. В небольшом количестве они присутствуют в воздухе и некоторых горных породах, а также в атмосферах некоторых планет-гигантов. Биологическое действие Инертные газы не ядовиты. Однако атмосфера с увеличенной концентрацией инертных газов и соответствующим снижением концентрации кислорода может оказывать удушающее действие на человека, вплоть до потери сознания и смерти[5][6]. Известны случаи гибели людей при утечках аргона. Вдыхание значительного количества радиоактивного радона может вызвать рак. Инертные газы обладают биологическим действием, которое проявляется в их наркотическом воздействии на организм и по силе этого воздействия располагаются по убыванию в следующем порядке (в сравнении приведены также азот и водород): Xe — Кr — Ar — N2 — H2 — Ne — He. Применение Инертные газы имеют очень низкие точки кипения и плавления, что позволяет их использовать в качестве холодильного агента в криогенной технике. Так, жидкий гелий используется для получения сверхпроводимости — в частности, для охлаждения сверхпроводящих обмоток электромагнитов, применяемых, например, для магнитно-резонансной томографии и других приложений ядерного магнитного резонанса. Жидкий неон, хотя и не достигает таких низких температур как жидкий гелий, также находит применение в криогенике, потому что его охлаждающие свойства (удельная теплота испарения) более чем в 40 раз лучше, чем у жидкого гелия, и более чем в три раза лучше, чем у жидкого водорода. Гелий, благодаря его пониженной растворимости в жидкостях, особенно в липидах, используется вместо азота как компонент дыхательных смесей для дыхания под давлением (например, при подводном плавании). Растворимость газов в крови и биологических тканях растёт под давлением. В случае использования для дыхания обычного воздуха или других азотсодержащих дыхательных смесей это может стать причиной эффекта, известного как азотное отравление. Благодаря меньшей растворимости в липидах, атомы гелия задерживаются клеточной мембраной, и поэтому гелий используется в дыхательных смесях, таких как тримикс и гелиокс, уменьшая наркотический эффект газов, возникающий на глубине. Кроме того, пониженная растворимость гелия в жидкостях тела позволяет избежать кессонной болезни при быстром всплытии с глубины. Уменьшение остатка растворённого газа в теле означает, что во время всплытия образуется меньшее количество газовых пузырьков; это уменьшает риск газовой эмболии. Другой инертный газ, аргон, рассматривается как лучший выбор для использования в качестве прослойки к сухому костюму для подводного плавания. Аргон, наиболее дешёвый среди инертных газов (его содержание в атмосфере составляет около 1 %), широко используется в газовой сварке и резке и других приложениях для изоляции от воздуха металлов, реагирующих при нагреве с кислородом (и азотом), а также для обработки жидкой стали. Аргон также применяется в люминесцентных лампах для предотвращения окисления разогретого вольфрамового электрода. Также, ввиду низкой теплопроводности, аргон (а также криптон) используют для заполнения стеклопакетов. Также гелий использовался для дирижаблей. Вопрос №43 Характеристика ковалентной связи 1. Пространственная направленность. Если электронные облака перекрываются в направлении прямой, которая соединяет ядра атомов, такая связь называется s-связью (s–s-перекрывание Н2, р–рCl2, s–рHC1). При перекрывании p-орбиталей, направленных перпендикулярно оси связи, образуются две области перекрывания по обе стороны оси связи. Такая ковалентная связь называется p-связью. Например, в молекуле азота атомы связаны одной s-связью и двумя p-связями. 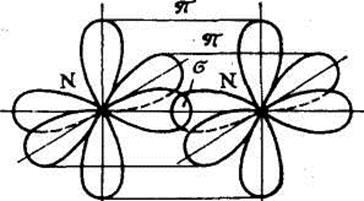 2. Полярность связи определяется асимметрией в распределении общего электронного облака вдоль оси связи. Если общие электронные пары располагаются симметрично относительно обоих ядер, то такая ковалентная связь называется неполярной. Если общие электронные пары смещаются к одному из атомов (располагаются несимметрично относительно ядер различных атомов), то такая ковалентная связь называется полярной. В случае, когда электронная пара смещается в сторону более электроотрицательного атома центры (+) и (–) зарядов не совпадают, и возникает система (электрический диполь) из двух равных по величине, но противоположных по знаку зарядов, расстояние между которыми (l) называют длиной диполя. 3. Кратность ковалентной связи определяется числом общих электронных пар, которые связывают атомы. Связь между двумя атомами при помощи одной пары электронов называется простой (связи Н – С1, С – Н, Н – О и т. д.). Связь при помощи двух электронных пар называется двойной (этилен Н2С = СН2), при помощи трех электронных пар – тройной (азот N 4. Длина связи – это равновесное расстояние между ядрами атомов. Чем меньше длина связи, тем прочнее химическая связь. 5. Энергия связи равна работе, которую необходимо затратить на разрыв связи. Выражают энергию связи в килоджоулях на моль (кДж/моль). Энергия связи увеличивается с уменьшением длины связи и с увеличением кратности связи. Процесс образования связи протекает с выделением энергии (экзотермический процесс), а процесс разрыва связи – с поглощением энергии (эндотермический процесс). Гибридизация – выравнивание орбиталей по форме и энергии. Sp-гибридизация Рассмотрим на примере гидрида бериллия ВеН2. Электронное строение атома Ве в нормальном состоянии 1s22s2. Атом бериллия может вступать во взаимодействие с атомами водородом только в возбужденном состоянии (s ® р-переход). Ве – 1s22s12p1 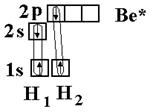 Две образующиеся связи должны быть различны по энергии, так как возникновение одной связано с перекрыванием двух s-орбиталей, второй – s- и p-орбиталей. Тогда и атомы водорода в молекуле должны быть химически неравноценны: один более подвижен и реакционноспособен, чем другой. Экспериментально это не так – оба атома водорода энергетически равноценны. Для объяснения этого явления Дж.К. Слейтер и Л. Полинг предположили, что «при интерпретации и расчете углов между связями и длины связи целесообразно близкие по энергии связи заменить равным количеством энергетически равноценных связей». Возникающие подобным образом связи являются гибридными. Таким образом, одна s- и одна р-орбиталь атома бериллия заменяются двумя энергетически равноценными sp-орбиталями, располагающимися под углом 180о друг к друг, т.е. молекула имеет линейное строение. 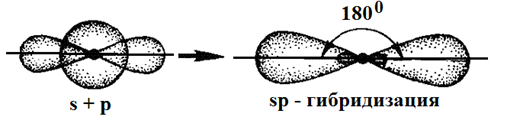 sp2-гибридизация sp2-гибридизацияРассмотрим на примере молекулы гидрида бора ВН3. Электронное строение атома бора в нормальном состоянии следующее В – 1s22s22p1. Он может образовать только одну ковалентную связь. Три же ковалентные связи для атома бора характерны только в возбужденном состоянии В* – 1s22s12p2 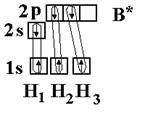 Одна связь, образованная при перекрывании двух s-орбиталей атомов В и Н, энергетически не отличается от двух других, образуемых перекрыванием s- и р-орбиталей. Три sp2-гибридные орбитали расположенные под углом 120о друг к другу, молекула имеет плоское строение. Подобная картина характерна для любых четырехатомных молекул, образованных за счет трех sp2-гибридных связей, например, для хлорида бора (BCl3). Одна связь, образованная при перекрывании двух s-орбиталей атомов В и Н, энергетически не отличается от двух других, образуемых перекрыванием s- и р-орбиталей. Три sp2-гибридные орбитали расположенные под углом 120о друг к другу, молекула имеет плоское строение. Подобная картина характерна для любых четырехатомных молекул, образованных за счет трех sp2-гибридных связей, например, для хлорида бора (BCl3).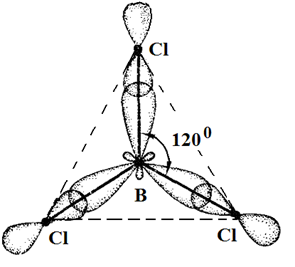 sp3-гибридизация Рассмотрим на примере метана СН4. В нормальном состоянии атом углерода с электронным строением 1s22s22p2 может дать только две ковалентные связи. В возбужденном состоянии он способен быть четырехвалентным с электронным строением 1s22s12р3. 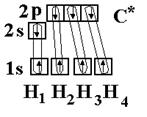 Гибридными становятся одна s- и три р-орбитали атома углерода, при этом образуются четыре sp3-гибридные, энергетически равноценные орбитали. Молекула метана приобретает тетраэдрическое строение. В центре тетраэдра, все вершины которого геометрически равноценны, находится атом углерода, а в его вершинах атомы водорода. Гибридными становятся одна s- и три р-орбитали атома углерода, при этом образуются четыре sp3-гибридные, энергетически равноценные орбитали. Молекула метана приобретает тетраэдрическое строение. В центре тетраэдра, все вершины которого геометрически равноценны, находится атом углерода, а в его вершинах атомы водорода. 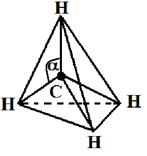 Силы взаимодействия между молекулами называют ван-дер-ваальсовыми или межмолекулярными. Это взаимодействие обусловлено электростатическим притяжением между отдельными молекулами и характеризуется следующими особенностями: - действует на сравнительно больших расстояниях, существенно превосходящих размеры самих молекул; - характеризуется малой энергией, поэтому существенно ослабевает с повышением температуры; - является ненасыщающимся, т. е. взаимодействие данной молекулы со второй не исключает подобного эффекта по отношению к третьей, четвертой и т. д. С ростом относительных молярных масс силы межмолекулярного взаимодействия возрастают и, как следствие, повышаются температуры плавления и кипения веществ. Вопрос №44 Теория Вернера и номенклатура комплексных соединений Теория координационных соединений, предложенная А. Вернером в 1893 году, до сих пор является основной теорией координационных соединений (для комплексов определенного вида). Рассмотрим ее основные положения. 1. Большинство элементов проявляет два типа валентности – главную и побочную. 2. Атом элемента стремится насытить не только главные, но и побочные валентности. 3. Побочные валентности атома строго фиксированы в пространстве и определяют геометрию комплекса и его различные свойства. В современной химии синонимом главной валентности является степень окисления элемента (обозначим ее сплошной линией), а побочная валентность определяется как координационное число, то есть количество атомов непосредственно связанных с металлом при насыщении его побочной валентности (обозначим ее пунктирной линией). Чтобы записать формулу комплексного соединения, необходимо помнить, что, как и любое ионное соединение, вначале записывается формула катиона, а после – формула аниона. При этом, формулу комплекса записывают в квадратных скобках, где вначале записывают комплексообразователь, затем лиганды. А вот несколько правил, следуя которым составить название комплексного соединения не составит никакого труда:
|
