Ответы на вопросы по химии. Д. И. Менделеева. Структура периодической системы
 Скачать 0.81 Mb. Скачать 0.81 Mb.
|
|
| Лиганд | Название лиганда | Лиганд | Название лиганда |
| en | этилендиамин | O2- | Оксо |
| H2O | Аква | H— | Гидридо |
| NH3 | Аммин | H+ | Гидро |
| CO | Карбонил | OH— | Гидроксо |
| NO | Нитрозил | SO42- | Сульфато |
| NO— | Нитрозо | CO32- | Карбонато |
| NO2— | Нитро | CN— | Циано |
| N3— | Азидо | NCS— | Тиоционато |
| Cl— | Хлоро | C2O42- | Оксалато |
| Br— | Бромо | | |
Если количество лигандов больше единицы, то их число указывают греческими приставками:
2-ди-, 3-три-, 4-тетра-, 5-пента-, 6-гекса-, 7-гепта-, 8-окта-, 9-нона-, 10-дека-.
Если же в названии самого лиганда уже присутствует греческая приставка, то название лиганда записывают в скобках и к нему прибавляют приставку типа:
2-бис-, 3-трис-, 4-тетракис-, 5-пентакис-, 6-гексакис-.
Например, соединение [Co(en)3]Cl3 называют – трис(этилендиамин)кобальт(III).
Названия комплексных анионов оканчиваются суффиксом – ат
После названия металла в скобках указывают римскими цифрами его степень окисления.
Например, назовем следующее соединение:
[Cr(H2O)4Cl2]Cl
Начнем с лигандов: 4 молекулы воды обозначаются как тетрааква, а 2 хлорид-иона – как дихлоро.
Далее указываем комплексообразователь – это хром и его степень окисления равна III.
Наконец, анионом в данном соединении является хлорид-ион.
Итак, полное название таково – хлорид тетрааквадихлорохрома(III)
Вопрос №45
Элементы 6-й главной подгруппы + элементы 6-й побочной подгруппы
Шестая группа периодической системы элементов состоит из двух подгрупп: главной — кислород, сера, селен, теллур и полоний — и побочной — хром, молибден и вольфрам. В главной подгруппе выделяют подгруппу селена (селен, теллур и полоний), побочную подгруппу называют подгруппой хрома. Все элементы главной подгруппы, кроме кислорода, могут присоединять по два электрона, образуя электроотрицательные ионы.
Элементы главной подгруппы имеют на внешнем электронном уровне по шесть электронов (s2р4). Атомы кислорода имеют два неспаренных электрона и не имеют d-уровня. Поэтому кислород проявляет в основном степень окисления -2 и только в соединениях со фтором +2. Сера, селен, теллур и полоний тоже имеют на внешнем уровне шесть электронов (s2p4), но у всех у них есть незаполненный d-уровень, поэтому они могут иметь до шести неспаренных электронов и в соединениях проявлять степень окисления — 2, +4 и +6.
Закономерность изменения активности этих элементов такая же, как и в подгруппе галогенов: легче всего окисляются теллуриды, затем селениды и сульфиды. Из кислородных соединений серы наиболее устойчивы соединения серы (VI), а для теллура — соединения теллура (IV). Соединения селена занимают промежуточное положение.
Селен и теллур, а также их соединения с некоторыми металлами (индием, таллием и др.) обладают полупроводниковыми свойствами и широко используются в радиоэлектронике. Соединения селена и теллура очень токсичны. Они применяются в стекольной промышленности для получения цветных (красных и коричневых) стекол.
Побочная подгруппа
В элементах подгруппы хрома идет заполнение d-уровня, поэтому на s-уровне их атомов — по одному (у хрома и молибдена) или два (у вольфрама) электрона. Все, они проявляют максимальную степень окисления +6, но для молибдена, и особенно для хрома, характерны соединения, в которых они имеют более низкую степень окисления (+4 для молибдена и +3 или +2 для хрома). Соединения хрома (III) очень устойчивы и похожи на соединения алюминия. Все металлы подгруппы хрома находят широкое применение.
Молибден используется в производстве сталей высокой прочности и вязкости, применяющихся для изготовления оружейных стволов, брони, валов и др. Из-за способности испаряться при высокой температуре он мало пригоден для изготовления нитей накала, но обладает хорошей способностью сплавляться со стеклом, поэтому используется для изготовления держателей вольфрамовых нитей в лампах накаливания.
Вольфрам применяется для получения специальных сталей. Добавка вольфрама к стали увеличивает ее твердость, эластичность и прочность. Вместе с хромом вольфрам придает стали свойство сохранять твердость при очень высоких температурах, поэтому такие стали применяются для изготовления резцов к быстрорежущим токарным станкам. Чистый вольфрам обладает наивысшей среди металлов температурой плавления (3370 °С), поэтому применяется для изготовления нитей в лампах накаливания. Карбид вольфрама отличается очень большой твердостью и термостойкостью и является основной составной частью тугоплавких сплавов.
Вопрос №46
Элементы 7-й главной подгруппы
9F 1s22s22p5
17Cl [Ne] 3s23p5
35Br [Ar] 3d104s24p5
53I [Kr] 4d105s25p5
85At [Xe] 4f145d106s26p5
5 элементов главной подгруппы VII группы имеют общее групповое название «галогены» (Hal), что означает «солерождающие».
В подгруппу галогенов входят фтор, хлор, бром, иод и астат (астат - радиоактивный элемент, изучен мало). Это р-элементы группы периодической системы Д.И. Менделеева. На внешнем энергетическом уровне их атомы имеют по 7 электронов ns2np5.
| Свойства | F | Cl | Br | I | At |
| 1. Порядковый номер | 9 | 17 | 35 | 53 | 85 |
| 2. Валентные электроны | 2s22p5 | 3s23p5 | 4s24p5 | 5s25p5 | 6s26p5 |
| 3. Степень окисления в соединениях | -1 | -1, +1, +3, +5, +7 | -1, +1, +3, +5, +7 | -1, +1, +3, +5, +7 | -1, +1, +3, +5, +7 |
Они легко присоединяют по одному электрону, проявляя степень окисления -1. Такую степень окисления галогены имеют в соединениях с водородом и металлами.
Однако атомы галогенов, кроме фтора, могут проявлять и положительные степени окисления : +1, +3, +5, +7. Возможные значения степеней окисления объясняются электронным строением, которое у атомов фтора можно представить схемой
Электронное строение атома хлора выражается схемой:
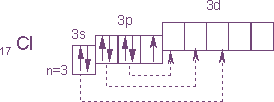
У атома хлора один неспаренный электрон на 3р-подуровне и в обычном (невозбужденном) состоянии хлор одновалентен. Но поскольку хлор находится в третьем периоде, то у него имеется еще пять орбиталей 3 -подуровня, в которых могут разместиться 10 электронов.
В возбужденном состоянии атома хлора электроны переходят с 3p - и 3s-подуровней на 3d-подуровень (на схеме показано стрелками). Разъединение (распаривание) электронов, находящихся в одной орбитали, увеличивает валентность на две единицы. Очевидно, хлор и его аналоги (кроме фтора) могут проявлять лишь нечетную переменную валентность 1, 3, 5, 7 и соответствующие положительные степени окисления. У фтора нет свободных орбиталей, а значит, при химических реакциях не происходит разъединения спаренных электронов в атоме. Поэтому при рассмотрении свойств галогенов всегда надо учитывать особенности фтора и соединений.
Водные растворы водородных соединений галогенов являются кислотами: НF - фтороводородная (плавиковая), НСl - хлороводородная (соляная), НВr - бромводородная, НI - йодоводородная.
Простые вещества - неметаллы F2(газ), Cl2(газ), Вг2(ж), l2(тв.).
При образовании ковалентных связей галогены чаще всего используют один неспаренный р-электрон, имеющийся в невозбужденном атоме, проявляя при этом В = I.
Образуя связи с атомами более электроотрицательных элементов, атомы хлора, брома и йода могут переходить из основного валентного состояния в возбужденные, что сопровождается переходом электронов на вакантные орбитали d-подуровня. При этом число неспаренных электронов увеличивается, вследствие чего атомы CI, Br, I могут образовывать большее число ковалентных связей:
В атоме F валентные электроны находятся на 2-м энергетическом уровне, имеющем только s- и р- подуровни. Это исключает возможность перехода атомов F в возбужденные состояния, поэтому фтор во всех соединениях проявляет постоянную В, равную I. Кроме того, фтор - самый электроотрицательный элемент, вследствие чего имеет и постоянную с. о. -1.
I. Галогеноводороды HHal.
II Галогениды металлов (соли галогеноводородных кислот) - самые многочисленные и устойчивые соединения галогенов
III. Галогенорганические соединения
IV. Кислородсодержащие вещества:
- неустойчивые оксиды, из которых достоверным можно считать существование 6 оксидов (Cl2O, ClO2, Cl2O7, Вr2O, ВrO2, I2O5);
- неустойчивые оксокислоты, из которых только 3 кислоты выделены как индивидуальные вещества (НСlO4, НlO3, НlO4);
- соли оксокислот, главным образом хлориты, хлораты и перхлораты.
Вопрос №48
Серная кислота. Сульфаты
Первые описания получения «купоросного масла» (т. е. концентрированной серной кислоты) дали итальянский учёный В. Бирингуччо в 1540 г. и немецкий алхимик, чьи труды были опубликованы под именем Василия Валентина в конце XVI - начале XVII вв. В 1690 г. французские химики Н. Лемери и Н. Лефевр положили начало первому промышленному способу получения серной кислоты, реализованному в Англии в 1740 г. По этому методу смесь серы и селитры сжигалась в ковше, подвешенном в стеклянном баллоне, содержавшем некоторое количество воды. Выделявшийся SO3 реагировал с водой, образуя серную кислоту. В 1746 г. Дж. Робек в Бирмингеме заменил стеклянные баллоны камерами из листового свинца и положил начало камерному производству серной кислоты. Непрерывное совершенствование процесса получения серной кислоты в Великобритании и Франции привело к появлению в 1908 г. первой башенной системы.
Сырьём для получения серной кислоты могут служить сера, серный колчедан FeS2, отходящие газы печей окислительного обжига сульфидных руд Си, Рb, Zn и других металлов, содержащие SO2.
Серную кислоту получают из SO2 двумя способами: нитрозным (башенным) и контактным. Переработка SO2 в серную кислоту по нитрозному способу осуществляется в продукционных башнях – цилиндрических резервуарах (высотой 15 м и более), заполненных насадкой из керамических колец.
Серная кислота, получаемая нитрозным способом, имеет недостаточно высокую концентрацию и содержит вредные примеси (например, соединения мышьяка). Её производство сопровождается выбросом в атмосферу оксидов азота.
Принцип контактного способа производства серной кислоты был предложен в 1831 г. П. Филипсом (Великобритания). Первым катализатором была платина. В конце XIX – начале XX вв. было открыто ускорение окисления SO2 в SO3 ванадиевым ангидридом V2O5. Все ванадиевые катализаторы проявляют свою активность только при температуре не ниже 420 °С. В контактном аппарате газ проходит обычно 4 или 5 слоев контактной массы.
Серная кислота образует два типа солей: сульфаты и гидросульфаты. Они проявляют все свойства солей.
Термическая устойчивость сульфатов определяется природой катиона, а состав продуктов разложения зависит от температуры процесса. Сульфаты щелочных и щелочно-земельных металлов плавятся без разложения выше 1000 °С. Сульфат свинца начинает разлагаться при 1170 °С, марганца (II) – при 850 °С, алюминия – при 770 °С, железа – при 600 °С. Главными продуктами разложения являются оксид металла и серный ангидрид, однако, чем выше температура разложения, тем в большей степени серный газ распадается на сернистый газ и кислород: Fe2(SO4)3 = Fe2O3 + 3SO3. Если нагревать сульфаты металлов в низшей степени окисления, то выделяющийся серный ангидрит окисляет металл: 3MnSO4 = Mn3O4 + 3SO2 + O2; 2FeSO4 = Fe2O3 + SO2 + SO3.
Качественной реакцией на сульфат-ион является образование белого осадка, нерастворимого в воде и кислотах, при приливании раствора соли бария: SO42- + Ba2+ = BaSO4↓.
Гидросульфаты щелочных металлов при нагревании превращаются в сульфаты: 2NaHSO4 = Na2SO4 + SO3 + H2O.
Оксид серы (VI) применяется для получения серной кислоты и олеума, используется в производстве азотной кислоты.
Серная кислота – один из важнейших продуктов основной химической промышленности. Служит электролитом в свинцовых аккумуляторах. Применяется в производстве фосфорной, соляной, борной, плавиковой и др. кислот. Концентрированная серная кислота служит для очистки нефтепродуктов от сернистых и непредельных органических соединений. Разбавленная серная кислота применяется для удаления окалины с проволоки и листов перед лужением и оцинкованием, для травления металлических поверхностей перед покрытием хромом, никелем, медью и др. Серная кислота – необходимый компонент нитрующих смесей и сульфирующее средство при получении многих красителей и лекарственных веществ. Благодаря высокой гигроскопичности применяется для осушки газов, для концентрирования азотной кислоты.
Вопрос №49.
Фосфорные кислоты. Получение, свойства, фосфаты
Фосфорные кислоты - соединения фосфора в степени окисления +5 общей формулы P2O5·nH2O:
