Ответы на вопросы по химии. Д. И. Менделеева. Структура периодической системы
 Скачать 0.81 Mb. Скачать 0.81 Mb.
|
|
Таблица 1.Некоторые характеристики атомов галогенов.
*) По шкале Олреда-Рохова. A.L.Allred, E.G.Rochow. J.Inorg.Nucl.Chem. 1958, 5, 264. В основном состоянии атомы галогенов имеют электронную конфигурацию ns2np5, где n - главное квантовое число, или номер периода. По сравнению с атомами других галогенов у атомов фтора 2s2 и 2p5 электроны слабо экранированы от ядра, что приводит к высокой удельной (на единицу объема) электронной плотности и, соответственно, меньшему радиусу, большим значениям энергии ионизации и электроотрицательности. При переходе от фтора к иоду размер атомов и возможные координационные числа увеличиваются, а энергии ионизации и электроотрицательность (ЭО) уменьшаются. Свойства фтора, как и других элементов второго периода (Li-F), отличаются от свойств более тяжелых элементов соответствующих групп. Например, сродство к электрону у фтора меньше, чем у хлора. Это связано с высокой электронной плотностью и сильным межэлектронным отталкиванием. При переходе от хлора к иоду сродство к электрону уменьшается из-за увеличения радиуса атома галогена. К особенностям фтора относится также высокая электроотрицательность, что приводит к тому, что для фтора из всех возможных степеней окисления -1, 0, +1, +3, +5, +7 характерны только две первых. Следует также отметить высокие по сравнению с другими галогенами энтальпии образования ионных и ковалентных фторидов. В случае ионных фторидов это обусловлено небольшим размером иона Галогены проявляют положительные степени окисления в соединениях с более электроотрицательными элементами, например, с фтором (ClF7, IF7, см.12) и кислородом (8, 9,11). Соединения, в которых атом галогена выступал бы как одновалентный катион Х+, неизвестны, поскольку энергетические затраты на ионизацию (табл.1) не компенсируются энергией кристаллической решетки и сольватации. Однако для иода и брома известны комплексные соединения, например, Астат по своим свойствам напоминает иод, например, идентифицированы соединения HAt, CH3At, BiAt, Ba(AtO3)2. Однако соединения с высшей степенью окисления At (VII) не получены. Соединения, содержащие поликатионы галогенов Фторвстречается в природе в виде фторидов, например, флюорита CaF2. Фтор получают электролизом расплавов фторидов щелочных металлов. Для понижения температуры плавления электролизу подвергают кислые фториды состава KF. 2HF * ), что позволяет проводить процесс при 1000С (Тпл. чистого KF составляет 8570С). Материалом для электролизера служат медь, никель или сталь, которые покрываются с поверхности плотной пленкой фторида, препятствующей дальнейшей коррозии реактора. В лабораторных условиях фтор можно получить термолизом высших фторидов некоторых металлов, например, 2CeF4 = 2CeF3 + F2 . Хлор встречается в природе, в основном, в виде хлоридов. Например, известны мощные залежи галита (NaCl), образовавшиеся при испарении соленых морей и озер. Основным методом получения хлора из галита является электролиз концентрированного раствора NaCl с диафрагмой, разделяющей катодное и анодное пространства: 2NaCl + 2H2O 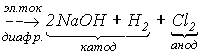 В лабораторных условиях хлор получают взаимодействием концентрированной HCl с такими окислителями, как КMnO4 , а также MnO2, K2Cr2O7 и т.д. 16HCl + 2KMnO4 = Cl2 +2KCl +2MnCl2 + 8H2O. Реакция твердого KMnO4 с концентрированной HCl протекает с образованием темно-коричневого малорастворимого гексахлороманганата (IV) калия и раствора, содержащего хлоридные комплексы Mn(III): Полное восстановление KMnO4 доMnCl2 осуществляется при большом избытке HCl. Бром, содержащийся в морской воде и буровых водах в виде бромидов, извлекают путем обработки реакционной смеси хлором при рН=3.5, чтобы избежать образования солей оксокислот брома. Аналогичным образом из буровых вод и золы, образующейся при сгорании морских водорослей, выделяют иод. В лаборатории бром и иод получают взаимодействием галогенидов с окислителем (MnO2) в кислой среде, например: MnO2 + 2H2SO4 + 2KI = I2 + MnSO4 + 2H2O + K2SO4. Образующийся иод экстрагируют или отделяют перегонкой с водяным паром. Вопрос №20 Строение атома. Модель Резерфорда. Современные понятия. Опыты Резерфорда. Новая модель атома была предложена Резерфордом в результате проделанных опытов по изучению рассеяния быстрых α-частиц на атомах вещества. В этих опытах в свинцовый кон тейнер 1 помещался радиоактивный препарат 2 (радий, рис.18.1). Узкий пучок 3 α-частиц (полностью ионизированных атомов гелия, испускаемых радием) направлялся на тонкую металлическую фольгу 4. За ней помещался экран 5, покрытый слоем кристаллов сульфида цинка, способных светиться под ударами быстрых заряжен ных частиц. Вспышки на экране наблюдались с помощью микроскопа 6. 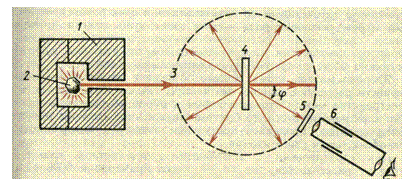 Обнаружено, что α-частицы проникают через тонкие металлические пластины почти без отклонения от прямолинейного пути. Вместе с тем небольшая часть альфа-частиц испытывала отклонение на значительно большие (до 180○) углы. Резерфорд предположил, что рассеяние альфа-час тиц на большие углы объясняется тем, что положительный заряд в атоме не распределен равномерно в шаре радиусом 10-10 м, а сосредоточен в центральной части атома в области значительно меньших размеров. В этой центральной положительно заряженной части атома – атомном яд ре, сосредоточена почти вся масса атома. Расчеты Резерфорда показали, что для объяснения опытов по рассеянию альфа-частиц нужно принять радиус ядра равным примерно 10-15 м. При таком малом радиусе напряженность электрического поля ядра вблизи его поверхности очень велика. В этом поле на движущуюся α-частицу действует большая сила , которая и отклоняет частицу на большие углы, в том числе и в обратном направлении. После обнаружения в опытах Резерфорда положительно за ряженного ядра необходимо было ответить на вопросы о том, где же в атоме находятся электроны и чем занято в нем остальное пространство. Резерфорд предположил, что атом устроен по добно планетной системе. Как вокруг Солнца на больших рас стояниях от него обращаются планеты, так вокруг ядерного ядра в атоме обращаются электроны. Радиус орбиты самого удаленного от ядра электрона и есть радиус атома. Такая модель строения атома была названа планетарной или ядерной моделью. Однако атомные системы отличаются от планетарных систем физической природой сил, удерживающих планеты и элек троны на их орбитах: планеты притягиваются к звездам силами всемирного тяготения, а во взаимодействии электронов с атомным ядром основную роль играют силы кулоновского притяжения разноименных электрических зарядов. Силы гравитационного притяжения между электроном и атомным ядром ничтожно малы по сравнению с электромагнитными. Ядерная модель атома хорошо объясняет основные законо мерности рассеяния заряженных частиц. Так как большая часть пространства между атомным ядром и обращающимися вокруг него электронами пуста, то быстрые заряженные частицы могут почти свободно проникать через слои вещества, содержащие несколько тысяч слоев атомов. При столкновении с электроном альфа-частица практи чески не рассеивается, так как ее масса примерно в 8000 раз больше массы электрона. Однако в том случае, когда альфа-частица пролетает вблизи одного из атомных ядер, под действием электрического поля атомного ядра может произойти ее рассеяние на любой угол до 180°. Но из-за малых размеров ядра по сравнению с размерами атома такие события происходят весьма редко. Ядерная модель атома позволила объяснить результаты опытов по рассеянию альфа-частиц в веществе, но встретилась с другой принципиальной трудностью: законы движения электронов в атоме Резерфорда противоречили законам электродинамики. Как известно, любое ускоренное движение электрических зарядов сопровождается излучением электро магнитных волн. Движение по ок ружности является ускоренным дви жением, поэтому электрон в атоме, должен излучать электромагнитные волны с частотой, равной частоте обращения вокруг ядра. Это должно приводить к уменьшению энергии электрона, постепенному его приближению к атомному ядру и падению на ядро. Таким образом, атом, состоящий из атомного ядра и обращающихся вокруг него электронов, согласно законам классической физики, неустойчив. Но в действи тельности атомы устойчивы и в невозбужденном состоянии не излучают свет. Современные представления о строении атома До конца XIX в. атом считали неделимой частицей, но последовавшие позже открытия (радиоактивность, фотоэффект) поколебали это убеждение. Сейчас известно, что атом состоит из элементарных частиц, основные из которых – протон, нейтрон, электрон.
|
