№1 Роль медицинского лабораторного техника в исследовании биохим. Дипломная работа Роль медицинского лабораторного техника в исследовании биохимических показателей, работы печени в норме и патологии
 Скачать 1.04 Mb. Скачать 1.04 Mb.
|
1.1.5 Участие печени в водно-минеральном обменеУчастие печени в водно-минеральном обмене состоит в том, что она дополняет деятельность почек в поддержании водно-солевого равновесия и является как бы внутренним фильтром, организма. Печень задерживает ионы Na+, К+, Сl-, Ca2+ и воду и выделяет их в кровь. Кроме того, печень депонирует макро- (К, Na, Ca, Mg, Fe) и микро- (Cu, Mn, Zn, Cо, As, Cd, Pb, Se) элементы и участвует в их распределении по другим тканям с помощью транспортных белков. Для накопления железа гепатоциты синтезируют специальный белок – ферритин. В ретикулоэндотелиоцитах печени и селезенки регистрируется водонерастворимый железосодержащий протеиновый комплекс – гемосидерин. В гепатоцитах синтезируется церулоплазмин, который, кроме вышеназванных функций, выполняет роль транспортного белка для ионов меди. Трансферрин, обладающий как и церулоплазмин, полифункциональностью, также образуется в печени и используется для переноса в плазме крови только ионов железа. Данный белок необходим для эмбрионального клеточного роста в период формирования печени. В печени ион Zn включается в алкогольдегидрогеназу, необходимую для биотрансформации этанола. Поступившие в гепатоциты соединения селена преобразуются в Se-содержащие аминокислоты и с помощью специфической т-РНК включаются в различные Se-протеины: глутатионпероксидазу (ГПО), 1-йодтиронин-5’-дейодиназу, Se-протеин Р. Последний считают основным транспортёром этого микроэлемента. Дейодиназа, обнаруженная не только в печени, обеспечивает конверсию прогормона тироксина в активную форму – трийодтиронин. Как известно, глутатионпероксидаза – ключевой фермент антирадикальной защиты. В печени сера, включённая в аминокислоты, окисляется до сульфатов, которые в виде ФАФС (фосфоаденозилфосфосульфатов) используются в реакциях сульфирования ГАГов, липидов, а также в процессах биотрансформации ксенобиотиков и некоторых эндогенных веществ (примеры продуктов инактивации – скатоксилсульфат, индоксилсульфат). Печень способна служить временным депо воды, особенно при отёках (количество Н2О может составлять до 80 % от массы органа). 1.1.6 Участие печени в пигментном обменеУчастие печени в обмене пигментов проявляется в превращении хромопротеидов до билирубина в клеткахРЭС, имеющихся в печени, конъюгации билирубина в самих печеночных клетках и разложении в них всасывающегося из кишечника уробилиногена до непигментных продуктов. Гемохромогенные пигменты, образуются в организме при распаде гемоглобина (в значительно меньшей степени при распаде миоглобина, цитохромов и др.). Начальным этапом распада гемоглобина (в клетках макрофагов, в частности в звездчатых ретикулоэндотелиоцитах, а также в гистиоцитах соединительной ткани любого органа) является разрыв одного метинового мостика с образованием вердоглобина. В дальнейшем от молекулы вердоглобина отщепляются атом железа и белок глобин. В результате образуется биливердин, который представляет собой цепочку из четырех пиррольных колец, связанных метановыми мостиками. Затем биливердин, восстанавливаясь, превращается в билирубин – пигмент, выделяемый с желчью и поэтому называемый желчным пигментом. Образовавшийся билирубин называется непрямым (неконъюгированным) билирубином. Он нерастворим в воде, дает непрямую реакцию с диазореактивом, т.е. реакция протекает только после предварительной обработки спиртом. В печени билирубин соединяется (конъюгирует) с глюкуроновой кислотой. Эта реакция катализируется ферментом УДФ-глюкуронилтрансферазой, при этом глюкуроновая кислота вступает в реакцию в активной форме, т.е. в виде УДФГК. Образующийся глюкуронид билирубина получил название прямого билирубина (конъюгированный билирубин). Он растворим в воде и дает прямую реакцию с диазореактивом. Большая часть билирубина соединяется с двумя молекулами глюкуроновой кислоты, образуя диглюкуронид билирубина. Образовавшийся в печени прямой билирубин вместе с очень небольшой частью непрямого билирубина выводится с желчью в тонкую кишку. Здесь от прямого билирубина отщепляется глюкуроновая кислота и происходит его восстановление с последовательным образованием мезобилирубина и мезобилиногена (уробилиногена). Из тонкой кишки часть образовавшегося мезобилиногена (уробилиногена) резорбируется через кишечную стенку, попадает в воротную вену и током крови переносится в печень, где расщепляется полностью до ди- и трипирролов. Таким образом, в норме в общий круг кровообращения и мочу мезобилиноген не попадает. Основное количество мезобилиногена из тонкой кишки поступает в толстую и здесь восстанавливается до стеркобилиногена при участии анаэробной микрофлоры. Образовавшийся стеркобилиноген в нижних отделах толстой кишки (в основном в прямой кишке) окисляется до стеркобилина и выделяется с калом. Лишь небольшая часть стеркобилиногена всасывается в систему нижней полой вены (попадает сначала в геморроидальные вены) и в дальнейшем выводится с мочой. 1.2 Мочевинообразовательная функция Печень — единственный орган, имеющий все ферменты цикла образования мочевины из аммиака. Аммиак, образующийся в других тканях, в печени превращается в индифферентный продукт— мочевину, которая выделяется в кровь. При интенсивном катаболизме белков и небелковых азотистых соединений (аминокислот, пуринов, пиримидинов, биогенных аминов) повышено образование мочевины в печени, ее содержание в крови и выделение с мочой. Биосинтез мочевины (орнитиновый цикл мочевинообразования) является основным механизмом обезвреживания аммиака в организме (приложение 19). На долю мочевины приходится до 80–85% от всего азота мочи. Впервые Г. Кребс и К. Гензеляйт в 1932 г. вывели уравнения реакций синтеза мочевины, которые представлены в виде цикла, получившего в литературе название орнитинового цикла мочевинообразования Кребса. Весь цикл мочевинообразования может быть представлен следующим образом. На первом этапе синтезируется макроэргическое соединение карбамоилфосфат – метаболически активная форма аммиака, используемая в качестве исходного продукта для синтеза пиримидиновых нуклеотидов (соответственно ДНК и РНК) и аргинина (соответственно белка и мочевины): 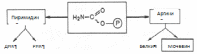 Существуют два разных пути синтеза карбамоилфосфата в клетках печени, катализируемые разными ферментами. Первую необратимую реакцию катализирует регуляторный фермент – аммиакзависимая карбамоилфосфатсинтетаза:  Реакция требует затраты двух молекул АТФ, проходит в митохондриях клеток печени и используется преимущественно для синтеза аргинина и мочевины. В этой реакции в качестве активного стимулирующего аллостерического эффектора действует N-ацетилглутамат. Вторую, также необратимую, реакцию катализирует глутаминзависимая карбамоилфосфатсинтетаза: 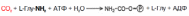 Данная реакция открыта в цитозоле клеток печени и требует наличия ионов Mg2+. На втором этапе цикла мочевинообразования происходит конденсация карбамоилфосфата и орнитина с образованием цитруллина; реакцию катализирует орнитин-карбамоилтрансфераза. На следующей стадии цитруллин превращается в аргинин в результате двух последовательно протекающих реакций. Первая из них, энергозависимая,– это конденсация цитруллина и аспарагиновой кислоты с образованием аргининосукцината (эту реакцию катализирует аргининосукцинатсинтетаза). Аргининосукцинат распадается в следующей реакции на аргинин и фумарат при участии другого фермента – аргининосукцинатлиазы. На последнем этапе аргинин расщепляется на мочевину и орнитин под действием аргиназы. Суммарная реакция синтеза мочевины без учета всех промежуточных продуктов может быть представлена в следующем виде: 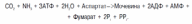 Учитывая выше изложенные данные о механизмах обезвреживания аммиака в организме, можно сделать следующее заключение. Часть амиака используется на биосинтез аминокислот путем восстановительного аминирования б-кетокислот по механизму реакции трансаминирования. Аммиак связывается при биосинтезе глутамина и аспарагина. Некоторое количество аммиака выводится с мочой в виде аммонийных солей. В форме креатинина, который образуется из креатина и креатинфосфата, выделяется из организма значительная часть азота аминокислот. Наибольшее количество аммиака расходуется на синтез мочевины, которая выводится с мочой в качестве главного конечного продукта белкового обмена в организме человека и животных. Подсчитано, что в состоянии азотистого равновесия организм взрослого здорового человека потребляет и соответственно выделяет примерно 15 г азота в сутки; из экскретируемого с мочой количества азота на долю мочевины приходится около 85%, креатинина – около 5%, аммонийных солей – 3%, мочевой кислоты – 1% и на другие формы – около 6% [2]. |
