№1 Роль медицинского лабораторного техника в исследовании биохим. Дипломная работа Роль медицинского лабораторного техника в исследовании биохимических показателей, работы печени в норме и патологии
 Скачать 1.04 Mb. Скачать 1.04 Mb.
|
Глава 1. Функциональная биохимия печениУсловно функции печени по биохимическим показателям можно разделить на: регуляторно-гомеостатическую функцию, включающую основные виды обмена (углеводный, липидный, белковый, обмен витаминов, водно-минеральный и пигментный обмены), мочевинообразовательную, желчеобразовательную и обезвреживающую функции. Такие основные функции и их регуляция подробно рассмотрены далее в этой главе. 1.1 Регуляторно–гомеостатическая функция печени.Печень – центральный орган химического гомеостаза, где чрезвычайно интенсивно протекают все обменные процессы и где они тесно переплетаются между собой. 1.1.1 Углеводный обмен в печени и его регуляция.Моносахариды (в частности глюкоза) поступают в печень по воротной вене и подвергаются различным преобразованиям. Например, при избыточном поступлении глюкозы из кишечника она депонируется в виде гликогена, так же глюкоза производится печенью в ходе гликогенолиза и глюконеогенеза, поступает в кровь и расходуется большинством тканей. Регуляция углеводного обмена осуществляется благодаря тому, что печень является практически единственным органом, который поддерживает постоянный уровень глюкозы в крови даже в условиях голодания. Судьба моносахаридов различна в зависимости от природы, их содержания в общем кровотоке, потребностей организма. Часть их отправится в печёночную вену, чтобы поддержать гомеостаз, в первую очередь, глюкозы крови и обеспечить нужды органов. Концентрация глюкозы в крови определяется балансом скоростей ее поступления, с одной стороны, и потребления тканями с другой. В постабсорбтивном состоянии (постабсорбтивное состояние развивается через 1,5—2 часа после приема пищи, так же называется истинным или метаболическим насыщением. Типичным постабсорбтивным состоянием считают состояние утром до завтрака, после примерно десятичасового ночного перерыва в приеме пищи) и в норме концентрация глюкозы в крови равна 60-100 мг/дл (3,3-5,5 моль\л). А остальную часть моносахаридов (в основном глюкозы) печень использует для собственных нужд. В гепатоцитах интенсивно протекает метаболизм глюкозы. Поступившая с пищей глюкоза только в печени с помощью специфических ферментных систем преобразуются в глюкозо-6-фосфат (лишь в такой форме глюкоза используется клетками). Фосфорилирование свободных моносахаридов – обязательная реакция на пути их использования, она приводит к образованию более реакционно-способных соединений и поэтому может рассматриваться как реакция активации. Глюкоза, поступающая в клетки печени, так же подвергается фосфорилированию с использованием АТФ. Эту реакцию катализирует ферменты гексокиназа и глюкокиназа. Гексокиназа обладает высоким сродством к глюкозе (Км <0,1 ммоль/л), поэтому максимум скорости реакции достигается при низкой концентрации глюкозы. В постабсорбтивном состоянии концентрация глюкозы в крови низкая, около 5 ммоль/л и скорость глюкокиназной реакции примерно 1/5 от максимальной скорости. В таких условиях максимально работает гексокиназа. Во время пищеварения в воротную вену и далее в печень поступают большие количества глюкозы, и ее концентрация достигает и превышает 10 ммоль/л. Соответственно увеличивается скорость глюкокиназной реакции, причем если не происходит ингибирование гексокиназы глюкозо-6-фосфатом, то скорость гексокиназной реакции не падает. Синтез глюкозы (глюконеогенез из аминокислот и глицерина). Глюкоза в печени может синтезироваться из аминокислот и глицерина. При катаболизме аминокислот в качестве промежуточных продуктов образуются пируват или оксалоацетат, которые могут включаться в путь глюконеогенеза на стадии первого субстратного цикла. Глицерин образуется при гидролизе жиров и может превращаться в глюкозу. Аминокислоты и глицерин используются для синтеза глюкозы главным образом при голодании или при низком содержании углеводов в рационе (углеводное голодание). Глюконеогенез может так же происходить из лактата. Молочная кислота не является конечным продуктом обмена, но ее образование — это тупиковый путь метаболизма: единственный способ использования молочной кислоты связан с ее превращением вновь в пируват при участии той же лактатдегидрогеназы. Из клеток, в которых происходит гликолиз, образующаяся молочная кислота поступает в кровь и улавливается в основном печенью, где и превращается в пируват. Пируват в печени частично окисляется, частично превращается в глюкозу — цикл Кори, или глюкозолактатпый цикл. В организме взрослого человека за сутки может синтезироваться около 80 г глюкозы, главным образом в печени. Биологическое значение глюконеогенеза заключается не только в возвращении лактата в метаболический фонд углеводов, но и в обеспечении глюкозой мозга при недостатке углеводов в организме, например, при углеводном или полном голодании. Синтез гликогена (гликогенез). Как уже говорилось выше, часть глюкозы поступившей в печень используется в синтезе гликогена. Гликоген — разветвленный гомополимер глюкозы, в котором остатки глюкозы соединены в линейных участках -1,4-гликозидной связью. В точках ветвления мономеры соединены -1,6-гликозидными связями. Эти связи образуются примерно с каждым десятым остатком глюкозы. При полимеризации глюкозы снижается растворимость образующейся молекулы гликогена и, следовательно, ее влияние на осмотическое давление в клетке. Это обстоятельство объясняет, почему в клетке депонируется гликоген, а не свободная глюкоза. Гликоген хранится в цитозоле клетки в форме гранул диаметром 10—40 нм. После приёма пищи, богатой углеводами, запас гликогена в печени может составлять примерно 5% от её массы. Распад гликогена печени служит в основном для поддержания уровня глюкозы в крови в постабсорбтивном периоде. Поэтому содержание гликогена в печени изменяется в зависимости от ритма питания. При длительном голодании оно снижается почти до нуля. Гликоген синтезируется в период пищеварения (через 1—2 ч после приёма углеводной пищи). Синтез гликогена из глюкозы требует затрат энергии. Прежде всего глюкоза подвергается фосфорилированию при участии фермента гексокиназы и глюкокиназы. Далее глюкозо-6-фосфат под влиянием фермента фосфоглюкомутазы переходит в глюкозо-1-фосфат. Образовавшийся глюкозо-1-фосфат уже непосредственно вовлекается в синтез гликогена. На первой стадии синтеза глюкозо-1-фосфат вступает во взаимодействие с УТФ (уридинтрифосфат), образуя уридиндифосфатглюкозу (УДФ-глюкоза) и пирофосфат. Данная реакция катализируется ферментом глюкозо-1-фосфат-уридилилтрансферазой (УДФГ-пирофосфорилаза). На второй стадии — стадии образования гликогена — происходит перенос глюкозного остатка, входящего в состав УДФ-глюкозы, на глюкозидную цепь гликогена («затравочное» количество). При этом образуется б-1,4-гликозидная связь между первым атомом углерода добавляемого остатка глюкозы и 4-гидроксильной группой остатка глюкозы цепи. Эта реакция катализируется ферментом гликогенсинтазой. Образующийся УДФ затем вновь фосфорилируется в УТФ за счет АТФ, и таким образом весь цикл превращений глюкозо-1-фосфата начинается сначала. Распад гликогена или его мобилизация происходят в ответ на повышение потребности организма в глюкозе. Гликоген печени распадается в основном в интервалах между приёмами пищи, распад ускоряется во время физической работы. Распад гликогена происходит при участии двух ферментов: гликогенфосфорилазы и фермента с двойной специфичностью — 4:4-трансферазы-б-1,6-гликозидазы. Гликогенфосфорилаза катализирует фосфоролиз 1,4-гликозидной связи нередуцирующих концов гликогена, глюкозные остатки отщепляются один за другим в форме глюкозо-1-фосфата. Голодание в течение 24 ч приводит практически к полному исчезновению гликогена в клетках печени. Однако при ритмичном питании каждая молекула гликогена может существовать неопределенно долго: при отсутствии пищеварения и поступления в ткани глюкозы молекулы гликогена уменьшаются за счет расщепления периферических ветвей, а после очередного приема пищи вновь вырастают до прежних размеров. Регуляция процессов гликогенеза и гликогенолиза осуществляется гормонами: инсулином, глюкагоном, адреналином. Первичный сигнал для синтеза инсулина и глюкагона — изменение концентрации глюкозы в крови. Инсулин и глюкагон постоянно присутствуют в крови, но при смене абсорбтивного периода на постабсорбтивный изменяется их относительная концентрация, что является главным фактором, переключающим метаболизм гликогена в печени. Отношение концентрации инсулина в крови к концентрации глюкагона называют «инсулин-глюкагоновый индекс». В постабсорбтивном периоде инсулин-глюкагоновый индекс снижается, и решающее значение в регуляции концентрации глюкозы и крови приобретает концентрация глюкагона. В период пищеварения преобладает влияние инсулина, так как инсулин-глюкагоновый индекс в этом случае повышается. В целом инсулин влияет на обмен гликогена противоположно глюкагону. Инсулин снижает концентрацию глюкозы в крови в период пищеварения. Гормон адреналин стимулирует выведение глюкозы из печени в кровь, для того чтобы снабдить ткани (в основном мозг и мышцы) «топливом» в экстремальной ситуации. Регуляторным фактором в метаболизме гликогена является также величина Кмглюкокиназы, которая много выше, чем Км гексокиназы - печень не должна потреблять глюкозу для синтеза гликогена, если её количество в крови в пределах нормы. 1.1.2 Регуляция липидного обмена Липидный обмен в печени включает биосинтез различных липидов (холестерина, триацилглицерина, фосфоглицеридов, сфингомиелина и др.) которые поступают в кровь и распределяются по другим тканям и сгорание (окисление) жирных кислот с образованием кетоновых тел, которые используются как источник энергии для внепеченочных тканей. Доставка жирных кислот к месту окисления – к митохондриям клеток печени – происходит сложным путем: при участии альбумина осуществляется транспорт жирных кислот в клетку; при участии специальных белков – транспорт в пределах цитозоля; при участии карнитина – транспорт жирной кислоты из цитозоля в митохондрии. Процесс окисления жирных кислот складывается из следующих основных этапов. Активация жирных кислот. Активация протекает на наружной поверхности мембраны митохондрии при участии АТФ, коэнзима А (HS-KoA) и ионов Mg2+. Реакция катализируется ферментом ацил-КоА-синтетазой:  Активация протекает в 2 этапа. Сначала жирная кислота реагирует с АТФ с образованием ациладенилата, далее сульфгидрильная группа КоА действует на прочно связанный с ферментом ациладенилат с образованием ацил-КоА и АМФ. Затем следует транспорт жирных кислот внутрь митохондрий. Переносчиком активированных жирных кислот с длинной цепью через внутреннюю митохондриальную мембрану служит карнитин. Ацильная группа переносится с атома серы КоА на гидроксильную группу карнитина. 2. Образуется ацилкарнитин, который диффундирует через внутреннюю митохондриальную мембрану. Реакция протекает при участии спецефического цитоплазматического фермента карнитин-ацилтрансферазы. После прохождения ацилкарнитина через мембрану митохондрий происходит обратная реакция – расщепление ацилкарнитина при участии HS-KoA и митохондриальной карнитин-ацилтрансферазы. 3. Внутримитохондриальное окисление жирных кислот. Процесс окисления жирной кислоты в митохондриях клетки включает несколько последовательных реакций. Первая стадия дегидрирования. Ацил-КоА в митохондриях подвергается ферментативному дегидрированию, при этом ацил-КоА теряет 2 атома водорода в б- и в-положениях, превращаясь в КоА-эфир ненасыщенной кислоты. Реакцию катализирует ацил-КоА-дегидрогеназа, продуктом является еноил-КоА. Стадия гидратации. Ненасыщенный ацил-КоА (еноил-КоА) при участии фермента еноил-КоА-гидратазы присоединяет молекулу воды. В результате образуется в-оксиацил-КоА (или 3-гидроксиацил-КоА). Вторая стадия дегидрирования. Образовавшийся в-оксиацил-КоА (3-гидроксиацил-КоА) затем дегидрируется. Эту реакцию катализируют НАД-зависимые дегидрогеназы. Тиолазная реакция. Расщепление 3-оксоацил-КоА с помощью тиоловой группы второй молекулы КоА. В результате образуется укороченный на два углеродных атома ацил-КоА и двууглеродный фрагмент в виде ацетил-КоА. Данная реакция катализируется ацетил-КоА-ацилтрансферазой (в-ке-тотиолазой). Образовавшийся ацетил-КоА подвергается окислению в цикле трикарбоновых кислот, а ацил-КоА, укоротившийся на два углеродных атома, снова многократно проходит весь путь в-окисления вплоть до образования бутирил-КоА (4-углеродное соединение), который в свою очередь окисляется до 2 молекул ацетил-КоА. Биосинтез жирных кислот. Синтез жирных кислот протекает в цитоплазме клетки. В митохондриях в основном происходит удлинение существующих цепей жирных кислот. Установлено, что в цитоплазме печеночных клеток синтезируется пальмитиновая кислота (16 углеродных атомов), а в митохондриях этих клеток из этой пальмитиновой кислоты или из жирных кислот экзогенного происхождения, т.е. поступающих из кишечника, образуются жирные кислоты, содержащие 18, 20 и 22 углеродных атома. Митохондриальная система биосинтеза жирных кислот, включает несколько модифицированную последовательность реакций в-окисления, и осуществляет только удлинение существующих в организме среднецепочечных жирных кислот, в то время как полный биосинтез пальмитиновой кислоты из ацетил-КоА активно протекает в цитозоле, т.е. вне митохондрий, по совершенно другому пути. Внемитохондриальная система биосинтеза жирных кислот (липогенез) находится в растворимой (цитозольной) фракции клеток печени. Биосинтез жирных кислот протекает с участием НАДФН, АТФ, Мn2+ и НСО3– (в качестве источника СО2); субстратом является ацетил-КоА, конечным продуктом – пальмитиновая кислота. Образование ненасыщенных жирных кислот. Элонгация жирных кислот. Две наиболее распространенные мононенасыщенные жирные кислоты – пальмитоолеиновая и олеиновая – синтезируются из пальмитиновой и стеариновой кислот. Эти превращения протекают в микросомах клеток печени. Превращению подвергаются только активированные формы пальмитиновой и стеариновой кислот. Ферменты, участвующие в этих превращениях, получили название десатураз. Наряду с десатурацией жирных кислот (образование двойных связей) в микросомах происходит и их удлинение (элонгация), причем оба эти процесса могут сочетаться и повторяться. Удлинение цепи жирной кислоты происходит путем последовательного присоединения к соответствующему ацил-КоА двууглеродных фрагментов при участии малонил-КоА и НАДФН. Ферментная система, катализирующая удлинение жирных кислот, получила название элонгазы. Биосинтез триглицеридов. Синтез триглицеридов происходит из глицерина и жирных кислот (главным образом стеариновой, пальмитиновой и олеиновой). Первый путь биосинтеза триглицеридов в печени протекает через образование б-глицерофосфата (глицерол-3-фосфата) как промежуточного соединения, глицерин фосфорилируется за счет АТФ с образованием глицерол-3-фосфата:  Второй путь в основном связан с процессами гликолиза и гликогенолиза. Известно, что в процессе гликолитического распада глюкозы образуется дигидроксиацетонфосфат, который в присутствии цитоплазматической глицерол-3-фосфатдегидрогеназы способен превращаться в глицерол-3-фосфат:  Образовавшийся тем или иным путем глицерол-3-фосфат последовательно ацилируется двумя молекулами КоА-производного жирной кислоты. В результате образуется фосфатидная кислота (фосфатидат):  Ацилирование глицерол-3-фосфата протекает последовательно, т.е. в 2 этапа. Сначала глицерол-3-фосфат-ацилтрансфераза катализирует образование лизофосфатидата. Далее фосфатидная кислота гидролизуется фосфатидат-фосфогидролазой до 1,2-диглицерида (1,2-диацилглицерола):  Затем 1,2-диглицерид ацилируется третьей молекулой ацил-КоА и превращается в триглицерид (триацилглицерол). Эта реакция катализируется диацилглицерол-ацилтрансферазой:  Установлено, что большинство ферментов, участвующих в биосинтезе триглицеридов, находятся в эндоплазматическом ретикулуме, и только некоторые, например глицерол-3-фосфат-ацилтрансфераза,– в митохондриях. Метаболизм фосфолипидов. Фосфолипиды играют важную роль в структуре и функции клеточных мембран, активации мембранных и лизосомальных ферментов, в проведении нервных импульсов, свертывании крови, иммунологических реакциях, процессах клеточной пролиферации и регенерации тканей, в переносе электронов в цепи дыхательных ферментов. Особая роль фосфолипидам отводится в формировании липопротеидных комплексов. Наиболее важные фосфолипиды синтезируются главным образом в эндоплазматической сети клетки. Центральную роль в биосинтезе фосфолипидов играют 1,2-диглицериды (в синтезе фосфатидилхолинов и фосфатидилэтаноламинов), фосфатидная кислота (в синтезе фосфатидилинозитов) и сфингозин (в синтезе сфингомиелинов). Цитидинтрифосфат (ЦТФ) участвует в синтезе практически всех фосфолипидов. Биосинтез холестерина. В синтезе холестерина можно выделить три основные стадии: I – превращение активного ацетата в мевалоновую кислоту, II – образование сквалена из мевалоновой кислоты, III – циклизация сквалена в холестерин. Рассмотрим стадию превращения активного ацетата в мевалоновую кислоту. Начальным этапом синтеза мевалоновой кислоты из ацетил-КоА является образование ацетоацетил-КоА посредством обратимой тиолазной реакции. Затем при последующей конденсации ацетоацетил-КоА с 3-й молекулой ацетил-КоА при участии гидроксиметилглутарил-КоА-синтазы (ГМГ-КоА-синтаза) образуется в-гидрокси-в-метилглутарил-КоА. Далее в-гидрокси-в-метилглутарил-КоА под действием регуляторного фермента НАДФ-зависимой гидроксиметилглутарил-КоА-редуктазы (ГМГ-КоА-редуктаза) в результате восстановления одной из карбоксильных групп и отщепления HS-KoA превращается в мевалоновую кислоту. Наряду с классическим путем биосинтеза мевалоновой кислоты имеется второй путь, в котором в качестве промежуточного субстрата образуется в-гидрокси-в-метилглутарил-S-АПБ. Реакции этого пути идентичны начальным стадиям биосинтеза жирных кислот вплоть до образования ацетоацетил-S-АПБ. В образовании мевалоновой кислоты по этому пути принимает участие ацетил-КоА-карбоксилаза – фермент, осуществляющий превращение ацетил-КоА в малонил-КоА. На II стадии синтеза холестерина мевалоновая кислота превращается в сквален. Реакции II стадии начинаются с фосфорилирования мевалоновой кислоты с помощью АТФ. В результате образуется 5-фосфорный эфир, а затем 5-пирофосфорный эфир мевалоновой кислоты 5-пирофосфомевалоновая кислота в результате последующего фосфорилирования третичной гидроксильной группы образует нестабильный промежуточный продукт – 3-фосфо-5-пирофосфомевалоновую кислоту, которая, декарбоксилируясь и теряя остаток фосфорной кислоты, превращается в изопентенилпирофосфат. Последний изомеризуется в диметил-аллилпирофосфат. Затем оба изомерных изопентенилпирофосфата (диметилаллилпирофосфат и изопентенилпирофосфат) конденсируются с высвобождением пирофосфата и образованием геранилпирофосфата. К геранилпирофосфату вновь присоединяется изопентенилпирофосфат. В результате этой реакции образуется фарнезилпирофосфат. В заключительной реакции данной стадии в результате НАДФН-зависимой восстановительной конденсации 2 молекул фарнезилпирофосфата образуется сквален. На III стадии биосинтеза холестерина сквален под влиянием сквален-оксидоциклазы циклизируется с образованием ланостерина. Дальнейший процесс превращения ланостерина в холестерин включает ряд реакций, сопровождающихся удалением трех метильных групп, насыщением двойной связи в боковой цепи и перемещением двойной связи. Регуляция синтеза и распада жиров в печени. В клетках печени есть активные ферментные системы и синтеза, и распада жиров. Регуляция обмена жиров в значительной мере определяется регуляцией обмена жирных кислот, но не исчерпывается этими механизмами. Синтез жирных кислот и жиров активируется при пищеварении, а их распад — в постабсорбтивном состоянии и при голодании. Кроме того, скорость использования жиров пропорциональна интенсивности мышечной работы. Регуляция обмена жиров тесно сопряжена с регуляцией обмена глюкозы. Как и в случае обмена глюкозы, в регуляции обмена жиров важную роль играют гормоны инсулин, глюкагон, адреналин и процессы переключения фосфорилирования-дефосфорилирования белков. 1.1.3 Регуляция обмена белков Регуляция обмена белков в печени осуществляется благодаря интенсивному биосинтезу в ней белков и окислению аминокислот. За сутки в организме человека образуется около 80—100 г белка, из них половина в печени. При голодании печень быстрее всех расходует свои резервные белки для снабжения аминокислотами других тканей. Потери белка в печени составляют примерно 20%; в то время как в других органах не более 4%. Белки самой печени в норме обновляются полностью каждые 20 суток. Большинство синтезированных белков печень отправляет в плазму крови. При потребности (например, при полном или белковом голодании) эти протеины так же служат источниками необходимых аминокислот. Поступив через воротную вену в печень, аминокислоты подвергаются ряду превращений, так же значительная часть аминокислот разносится кровью по всему организму и используется для физиологических целей. Печень обеспечивает баланс свободных аминокислот организма путем синтеза заменимых аминокислот и перераспределения азота. Всосавшиеся аминокислоты в первую очередь используются в качестве строительного материала для синтеза специфических тканевых белков, ферментов, гормонов и других биологически активных соединений. Некоторое количество аминокислот подвергается распаду с образованием конечных продуктов белкового обмена (СО2, Н2О и NH3) и освобождением энергии. Все альбумины, 75-90% б-глобулинов (б1-антитрипсин, б2-макроглобулин – ингибиторы протеаз, белки острой фазы воспаления), 50% в-глобулинов плазмы синтезируются гепатоцитами. В печени происходит синтез белковых факторов свертывания крови (протромбина, фибриногена, проконвертина, акцелератора глобулина, фактора Кристмаса, фактора Стюарта-Прауэра) и часть естественных основных антикоагулянтов (антитромбин, протеин С и др.). Гепатоциты участвуют в образовании некоторых ингибиторов фибринолиза, регуляторы эритропоэза – эритропоэтины – образуются в печени. Гликопротеин гаптоглобин, вступающий в комплекс с гемоглобином для предупреждения его выделения почками, тоже имеет печёночное происхождение. Данное соединение принадлежит к белкам острой фазы воспаления, обладает пероксидазной активностью. Церулоплазмин, также являющийся гликопротеином, синтезируемым печенью, можно считать внеклеточной супероксиддисмутазой, что позволяет защищать мембраны клеток; мало того, он стимулирует продукцию антител. Подобным действием, только на клеточный иммунитет, обладает трансферрин, полимеризация которого так же осуществляется гепатоцитами. Ещё один углеводсодержащий белок, но с иммуносупрессивными свойствами, способен синтезироваться печенью – б-фетопротеин, рост концентрации которого в плазме крови служит ценным маркёром некоторых опухолей печени, яичек и яичников. Печень - источник большей части протеинов системы комплемента. В печени наиболее активно протекает обмен мономеров белков - аминокислот: синтез заменимых аминокислот, синтез небелковых азотистых соединений из аминокислот (креатина, глутатиона, никотиновой кислоты, пуринов и пиримидинов, порфиринов, дипептидов, коферментов пантотената и др.), окисление аминокислот с образованием аммиака, который обезвреживается в печени при синтезе мочевины. Итак, рассмотрим общие пути обмена аминокислот. Общие пути превращения аминокислот в печени включают реакции дезаминирования, трансаминирования, декарбоксилирования и биосинтез аминокислот. Дезаминирование аминокислот. Доказано существование 4 типов дезаминирования аминокислот (отщепление аминогруппы). Выделены соответствующие ферментные системы, катализирующие эти реакции, и идентифицированы продукты реакции. Во всех случаях NH2-группа аминокислоты освобождается в виде аммиака. Помимо аммиака, продуктами дезаминирования являются жирные кислоты, оксикислоты и кетокислоты. Трансаминирование аминокислот. Под трансаминированием подразумевают реакции межмолекулярного переноса аминогруппы (NH2—) от аминокислоты на б-кетокислоту без промежуточного образования аммиака. Реакции трансаминирования являются обратимыми и протекают при участии специфических ферментов аминотрансфераз, или трансаминаз. Пример реакции трансаминирования: 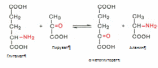 Декарбоксилирование аминокислот. Процесс отщепления карбоксильной группы аминокислот в виде СО2. Образующиеся продукты реакции – биогенные амины. Реакции декарбоксилирования в отличие от других процессов промежуточного обмена аминокислот являются необратимыми. Они катализируются специфическими ферментами – декарбоксилазами аминокислот. Обезвреживание аммиака в организме. В организме человека подвергается распаду около 70 г аминокислот в сутки, при этом в результате реакций дезаминирования и окисления биогенных аминов освобождается большое количество аммиака, являющегося высокотоксичным соединением. Поэтому концентрация аммиака в организме должна сохраняться на низком уровне. Уровень аммиака в крови в норме не превышает 60 мкмоль/л . Аммиак должен подвергаться связыванию в печени с образованием нетоксичных соединений, легко выделяющихся с мочой. Один из путей связывания и обезвреживания аммиака в организме это биосинтез глутамина (и, возможно, аспарагина). Глутамин и аспарагин выделяются с мочой в небольшом количестве. Скорее они выполняют транспортную функцию переноса аммиака в нетоксичной форме. Синтеза глутамина, катализируется глутаминсинтетазой. 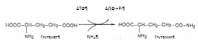 Второй и основной путь обезвреживания аммиака в печени – образование мочевины, который будет рассмотрен ниже в мочевинообразовательной функции печени. В гепатоцитах отдельные аминокислоты подвергаются специфическим преобразованиям. Из серосодержащих аминокислот образуется таурин, который позднее включается в парные жёлчные кислоты (таурохолевая, тауродезоксихолевая), а также может служить антиоксидантом, связывая гипохлорит анион, стабилизировать мембраны клеток; происходит активация метионина, который в виде S-аденозилметионина служит источником метильных групп реакциях окончания генеза креатина, синтеза холина для холинфосфатидов (липотропных веществ). Биосинтез заменимых аминокислот. Любая из заменимых аминокислот может синтезироваться в организме в необходимых количествах. При этом углеродная часть аминокислоты образуется из глюкозы, а аминогруппа вводится из других аминокислот путем трансаминирования. Алании, аспартат, глутамат образуются из пирувата, оксалоацетата и б-кетоглутарата соответственно. Глутамин образуется из глутаминовой кислоты при действии глутаминсинтетазы: 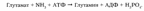 Аспарагин синтезируется из аспарагиновой кислоты и глутамина, который служит донором амидной группы; реакцию катализирует аспарагинсинтетаза пролин образуется из глутаминовой кислоты. Гистидин (частично заменимая аминокислота) синтезируется из АТФ и рибозы: пуриновая часть АТФ поставляет фрагмент —N=CH—NH— для имидазольного цикла гистидина; остальная часть молекулы образуется за счет рибозы. Если в пище нет заменимой аминокислоты, клетки синтезируют ее из других веществ, и тем самым поддерживается полный набор аминокислот, необходимый для синтеза белков. Если же отсутствует хотя бы одна из незаменимых аминокислот, то прекращается синтез белков. Это объясняется тем, что в состав подавляющего большинства белков входят все 20 аминокислот; следовательно, если нет хотя бы одной из них, синтез белков невозможен. Частично заменимые аминокислоты синтезируются в организме, однако скорость их синтеза недостаточна для обеспечения всей потребности организма в этих аминокислотах, особенно у детей. Условно заменимые аминокислоты могут синтезироваться из незаменимых: цистеин — из метионина, тирозин — из фенилаланина. Иначе говоря, цистеин и тирозин — это заменимые аминокислоты при условии достаточного поступления с пищей метионина и фенилаланина. 1.1.4 Участие печени в обмене витаминов Участие печени в обмене витаминов складывается из процессов депонирования всех жирорастворимых витаминов: А, Д, Е, К, F (секреция желчи так же обеспечивает всасывание этих витаминов) и многих из гидровитаминов (В12, фолиевая кислота, В1, В6, РР и др.), синтеза некоторых витаминов (никотиновая кислота) и коферментов. Особая печени заключается в том, что в ней происходит активация витаминов: Фолиевая кислота с помощью витамина С восстанавливается в тетрагидрофолиевую кислоту (ТГФК) [8]; Восстановление сводится к разрыву двух двойных связей и присоединению четырех водородных атомов в положениях 5, 6, 7 и 8 с образованием тетрагидрофолиевой кислоты (ТГФК). Оно протекает в 2 стадии тканях при участии специфических ферментов, содержащих восстановленный НАДФ. Сначала при действии фолатредуктазы образуется дигидрофолиевая кислота (ДГФК), которая при участии второго фермента – дигидрофолатредуктазы – восстанавливается в ТГФК:  Витамины В1 и В6 фосфорилируются в тиаминдифосфат и пиридоксальфосфат соответственно [8]. Витамин В6 (пиридоксин) производный 3-оксипиридина. Термином витамин В6 обозначают все три производных 3-оксипиридина, обладающих одинаковой витаминной активностью: пиридоксин (пиридоксол), пиридоксаль и пиридоксамин:  Хотя все три производных 3-оксипиридина наделены витаминными свойствами, коферментные функции выполняют только фосфорилированные производные пиридоксаля и пиридоксамина. Фосфорилирование пиридоксаля и пиридоксамина является ферментативной реакцией, протекающей при участии специфических киназ. Синтез пиридоксальфосфата, например, катализирует пиридоксалькиназа:  Витамин В1(тиамин). В химической структуре его содержатся два кольца – пиримидиновое и тиазоловое, соединенных метиленовой связью. Обе кольцевые системы синтезируются отдельно в виде фосфорилированных форм, затем объединяются через четвертичный атом азота. В превращении витамина B1 в его активную форму – тиаминпирофосфат (ТПФ), называемый также тиаминдифосфатом (ТДФ), участвует специфический АТФ-зависимый фермент тиаминпирофосфокиназа. Часть каротинов преобразуется в витамин А под влиянием каротиндиоксигеназы. Каротины являются провитаминами для витамина А. Известны 3 типа каротинов: б-, в- и г-каротины, отличающиеся друг от друга химическим строением и биологической активностью. Наибольшей биологической активностью обладает в-каротин, поскольку он содержит два в-иононовых кольца и при распаде в организме из него образуются две молекулы витамина А. При окислительном распаде б- и г-каротинов образуется только по одной молекуле витамина А, поскольку эти провитамины содержат по одному в-иононовому кольцу. 4. Витамин Д подвергается первому гидроксилированию на пути получения гормона кальцитриола; в печени осуществляется гидроксилирование в 25-м положении. Ферменты, катализирующие эти реакции, называются гидроксилазами, или монооксигеназами. В реакциях гидроксилирования используется молекулярный кислород. 5. Окислившийся витамин С восстанавливается в аскорбиновую кислоту; 6. Витамины РР, В2, пантотеновая кислота включаются в соответствующие нуклеотиды (НАД+, НАД+Ф, ФМН, ФАД, КоА-SH); 7. Витамин К окисляется, чтобы в виде своего пероксида служить коферментом в созревании (посттрансляционной модификации) белковых факторов свёртывания крови. В печени синтезируются белки, выполняющие транспортные функции по отношению к витаминам. Например, ретинолсвязывающий белок (его содержание уменьшается при опухолях), витамин Е-связывающий белок и т.д. Часть витаминов, в первую очередь жирорастворимых, а также продуктов их преобразований выделяется из организма в составе жёлчи. |
