ШПОРЫ БХ 2 ИТОГОВАЯ. Эндергонические процессы, протекающие с увеличением свободной энергии. Катаболические превращения
 Скачать 2.83 Mb. Скачать 2.83 Mb.
|
|
Терморегуляторная функция ЦПЭ На синтез молекул АТФ расходуется примерно 40-45% всей энергии электронов, переносимых по ЦПЭ, приблизительно 25% тратится на работу по переносу веществ через мембрану. Остальная часть энергии рассеивается в виде теплоты и используется на поддержание температуры тела. Кроме того, дополнительное образование теплоты может происходить при разобщении дыхания и фосфорилирования. Разобщение окислительного фосфорилирования может быть биологически полезным. Оно позволяет генерировать тепло для поддержания температуры тела у новорождённых, у зимнеспящих животных и у всех млекопитающих в процессе адаптации к холоду. У новорождённых существует особая ткань, специализирующаяся на теплопродукции посредством разобщения дыхания и фосфорилирования - бурый жир. Бурый жир содержит много митохондрий. В мембране митохондрий имеется большой избыток дыхательных ферментов по сравнению с АТФ-синтазой. Около 10% всех белков приходится на так называемый разобщающий белок (РБ-1) - термогенин. По своей структуре термогенин близок к АТФ/АДФ-антипортеру, но не способен к транспорту нуклеотидов, хотя сохранил способность переносить анионы жирных кислот, служащих разобщителями. На внешней стороне мембраны анион жирной кислоты присоединяет протон и в таком виде пересекает мембрану; на внутренней стороне мембраны диссоциирует, отдавая протон вматрикс и тем самым снижает протонный градиент. Образующийся анион возвращается на наружную сторону мембраны с помощью АТФ/ АДФ-антипортера. При охлаждении стимулируется освобождение норадреналина из окончаний симпатических нервов. В результате происходят активация липазы в жировой ткани и мобилизация жира из жировых депо .Образующиеся свободные жирные кислоты служат не только "топливом", но и важнейшим регулятором разобщения дыхания и фосфорилирования. Билет 9 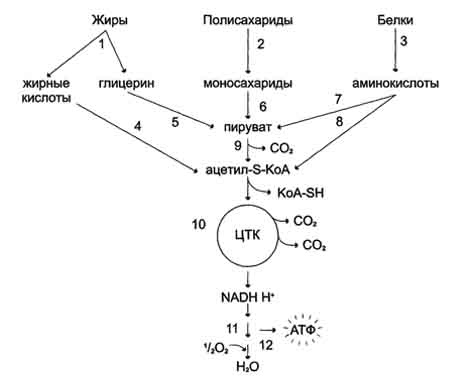 Катаболизм основных пищевых веществ. 1-3 - пищеварение; 4-8 - специфические пути катаболизма; 9-10 - заключительный (общий путь) катаболизма; 11 - ЦПЭ; 12 - окислительное фосфорилирование. Специфический путь катаболизма - это совокупность превращений, свойственных только 1 соединению.этот путь различен для разных классов соединений.Из глюкозы при гликолизе образуется ПВК. Из жирных кислот при бета-окислении обр-ся Ко-А. Аминокислоты образуют ПВК. В результате специфических путей катаболизма продукты переваривания пищевых веществ (моносахариды, глицерин, жирные кислоты, аминокислоты) превращаются всего в два соединения – пировиноградную кислоту и ацетил-КоА, которые затем направляются в общий путь катаболизма, включающий в себя процесс декарбоксилирования пировиноградной кислоты и цикл трикарбоновых кислот. Некоторые специфические пути включаются в общий путь на стадии пирувата(аниона пировиноградной кислоты), другие – на стадии ацетил-КоА. Ряд веществ поступает в общий путь катаболизма на промежуточных стадиях цикла трикарбоновых кислот. Именно общий путь катаболизма является источником основной массы первичных доноров водорода для дыхательной цепи. Окислительноед декарбоксилирование пировиноградной кислоты. можно отразить следующим суммарным уравнением: H3CC(О) COOH+ HS-KoA + НАД+→Н3С-C(O)- S- KoA + НАДН + Н+ + СО2 Пируват Ацетил-КоА В результате этой реакции образуются ацетил-КоА, восстановленная форма (НАДН + Н+) и диоксид углерода. Билет 10. Окислительное декарбоксилирование пирувата. происходит в матриксе митохондрий. Транспорт пирувата в митохондриальный матрикс через внутреннюю мембрану митохондрий осуществляется при участии специального белка-переносчика по механизму симпорта с Н+. Превращение пирувата в ацетил-КоА описывают следующим суммарным уравнением: СН3-СО-СООН + NAD++ HSKoA → CH3-CO ∼SKoA + NADH + H++ CO2 В ходе этой реакции происходит окислительное декарбоксилирование пирувата, в результате которого карбоксильная группа удаляется в виде СО2, а ацетильная группа включается в состав ацетил- КоА. Один атом водорода оказывается в составе NADH, а другой в виде Н+ поступает в среду. Реакция необратима, поскольку ΔG0' = -33,5 кДж/моль. Превращение пирувата в ацетил-КоА включает 5 стадий: Стадия I. На этой стадии пируват соединяется с ТДФ в составе Е1 и подвергается декарбоксилированию. Пируват + Е1-ТДФ → Гидроксиэтил-ТДФ + CO2. В результате этой реакции образуется производное ТДФ с гидроксиэтильной группой при тиазоловом кольце Стадия П. Дигидролипоилтрансацетилаза (Е2) катализирует перенос атома водорода и ацетильной группы от ТДФ на окисленную форму липоиллизиновых групп с образованием ацетилтиоэфира липоевой кислоты Стадия III. На стадии III КоА взаимодействует с ацетильным производным Е2, в результате чего образуются ацетил-КоА и полностью восстановленный липоильный остаток, простетическая группа Е2 Стадия IV. На стадии IV дигидролипоилде-гидрогеназа (Е3) катализирует перенос атомов водорода от восстановленных липоильных групп на FAD - простетическую группу фермента Е3. Стадия V . На стадии V восстановленный FADH2 передаёт водород на NAD+ с образованием NADH. Билет 11. Строение пируватдегидрогеназного комплекса. Процесс окислительного декарбоксилирования пирувата катализирует сложнооргани-зованный пируватдегидрогеназный комплекс. В пируватдегидрогеназный комплекс (ПДК) входят 3 фермента: пируватдекарбоксилаза (Е1), дигидролипоилтрансацетилаза (Е2) и дигидролипоилдегидрогеназа (Е3), а также 5 коферментов: тиаминдифосфат (ТДФ), липоевая кислота,. FAD, NAD+ и КоА. Кроме того, в состав комплекса входят регуляторные субъединицы: протеинкиназа и фосфопротеинфосфатаза Пируватдегидрогеназный комплекс (ПДК) млекопитающих
Билет12. Цикл лимонной кислоты центральная часть ОПК, циклич аэробный процесс, в ходе которого происходит превращение двух- и трёхуглеродных промеж продуктовдо CO2. При этом освобождённый водород направляется в цепь тканевого дыхания, где в дальнейшем окисляется до воды, принимая участие в синтезе АТФ.это ключевой этап дыхания всех клеток, использующих кислород, Кроме значительной энергетической роли цикл это важный источник молекул-предшественников, из которых в ходе других биохимических превращений синтезируются как АК, ЖК углев.  Билет 13. Ключевые реакции цикла лимонной кислоты Образование цитрата В реакции образования цитрата углеродный атом метильной труппы ацетил-КоА связывается с карбонильной группой оксалоацетата (одновременно расщепляется тиоэ-фирная связь и освобождается коэнзим A . Реакция сопровождается потерей большого количества энергии в виде теплоты. Катализирует реакцию цитрат синтаза, фермент, локализованный в матриксе митохондрий. Превращение цитрата в изоцитрат обратимое превращение цитрата в изоцитрат Фермент, катализирующий эту реакцию, назван аконитазой по промежуточному продукту, цис-аконитовой кислоте, которая предположительно образуется в реакции. Однако это соединение не обнаруживается в свободном виде, так как не отделяется от активного центра фермента до завершения реакции. Окислительное декарбоксилирование изоцитрата Эту реакцию катализирует изоцитратдегидрогеназа. Существуют 2 формы изоцитратдегидрогеназы: одна содержит в качестве коферментa NAD+, вторая - NADP+. NAD-зависимый фермент локализован в митохондриях и участвует в ЦТК; NADP-зависимый фермент, присутствующий и в митохондриях, и В) цитоплазме, играет иную метаболическую роль, В результате действия этого фермента на изоцитрат образуется α-кетоглутарат. Реакция, катализируемая NAD-зависимой изоцитратдегидрогеназой, - самая медленная реакция цитратного цикла. АДФ - аллостерический активатор фермента. Окислительное декарбоксилирование α-кетоглутарата α-кетоглутарат подвергается окислительному декарбоксилированию с образованием в качестве конечных продуктов сук-цинил-КоА, СО2 и NADH + Н+. В результате этой реакции образуется сукцинил-КоА. Реакцию катализирует α-кетоглутаратдегидрогеназный комплекс, который по структуре и функциям сходен с пируватдегидрогеназным комплексом (ПДК). Подобно ПДК, он состоит из 3 ферментов: α-кетоглутаратдекарбоксилазы, дигидролипоилтранссукцинилазы и дигидролипоилдегидрогеназы. Кроме того, в этот ферментный комплекс входят 5 коферментов: тиаминдифосфат, кофермент А, липоевая кислота, NAD+ и FAD. она не имеет сложного механизма регуляции, , в этом комплексе отсутствуют регуляторные субъединицы. Превращение сукцинил-КоА в сукцинат Сукцинил-КоА - высокоэнергетическое соединение. В митохондриях разрыв тиоэфирной связи сук-цинил-КоА сопряжён с реакцией фосфорилирования (ГДФ) до ГТФ). Эту сопряжённую реакцию катализирует сукцинаттиокиназа. Промежуточный этап реакции - фосфорилирование молекулы фермента по одному из гистидиновых остатков активного центра. Затем остаток фосфорной кислоты присоединяется к ГДФ с образованием ГТФ. С ГТФ концевая фосфатная группа может переноситься на АДФ с образованием АТФ; эту обратимую реакцию катализирует нуклеозид-дифосфаткиназа. ГТФ + АДФ ↔ ГДФ + АТФ. Образование высокоэнергетической фосфо-ангидридной связи за счёт энергии субстрата (сукцинил-КоА) - пример субстратного фосфорилирования. Дегидрирование сукцината сукцинат превращается в фумарат под действием сукцинатдегидрогеназы. Этот фермент - флавопротеин, молекула которого содержит прочно связанный кофермент FAD. Сукцинат дегидрогеназа прочно связана с внутренней митохондриальной мембраной. Она состоит из 2 субъединиц, одна из которых связана с FAD. Кроме того, обе субъединицы содержат железо-серные центры; одна - Fe2S2, a другая - Fe4S4. В железо-серных центрах атомы железа меняют свою валентность, участвуя в транспорте электронов. Образование малата из фумарата Образование малата происходит при участии фермента фумаратгидратазы. Этот фермент более известен как фумараза. Фумараза - олигомерный белок, состоящий из 4 идентичных полипептидных цепей. Он расположен в матриксе митохондрий. Фумаразу относят к ферментам с абсолютной субстратной специфичностью: она катализирует гидратацию только транс-формы фумарата. Дегидрирование малата В заключительной стадии цитратного цикла малат дегидрируется с образованием оксалоа-цетата. Реакцию катализирует NAD-зависимая малатдегидрогеназа, содержащаяся в матриксе митохондрий. Равновесие малатдегидрогеназной реакции сильно сдвинуто влево. Билет14. Анаплеротические реакции цикла лимонной кислоты. Анаболическое значение ЦТК - один из амфиболических путей метаболизма. В нём осуществляются не только окислительные превращения энергетических субстратов до конечных продуктов СО2 и Н2О, но и происходит образование субстратов для других метаболических путей. Некоторые промежуточные продукты цикла лимонной кислоты: α-кетоглутарат, сукцинат, оксалоацетат могут использоваться для синтеза заменимых аминокислот. Убыль промежуточных продуктов цикла восполняется в реакциях, катализируемых специфическими ферментами. В н.у. реакции, отвлекающие промежуточные продукты из цикла и восполняющие их убыль, находятся в состоянии динамического равновесия, так что концентрация этих продуктов в митохондриях остаётся постоянной. Реакции, обеспечивающие пополнение фонда промежуточных продуктов ЦТК, называются анаплеротическими (пополняющими). Важнейшая из них - реакция синтеза оксалоацетата из пирувата. Эту реакцию катализирует митохондриальный фермент - пируваткарбоксилаза. 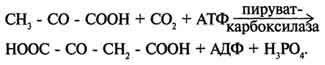 Пируваткарбоксилаза - сложный олигомерный фермент. Молекула фермента содержит 4 простетические группы, представленные биотином , который ковалентно связан амидной связью с е-аминогруппами остатков лизина, находящегося в активном центре фермента. Если для цикла лимонной кислоты не хватает оксалоацетата или какого-нибудь другого промежуточного продукта, то карбоксилирование пирувата ускоряется. В этой реакции в качестве источника энергии используется АТФ. Реакция протекает в 2 стадии. На первой стадии происходит активация СО2 путём присоединения к одному из атомов азота в молекуле биотина. Эта реакция сопряжена с гидролизом АТФ. АТФ + СО2+ Е-биотин + Н2О → АДФ + Н3РО4 + Е-биотин-СОО- + 2 Н+. На второй стадии активированная карбоксильная группа переносится на пируват. Е-биотин-СОО" + Пируват -" Е-биотин + Оксалоацетат. Пируваткарбоксилаза - регуляторный фермент. Если концентрация ацетил-КоА увеличивается, то он действует как аллостерический активатор пируваткарбоксилазы, ускоряя образование оксалоацетата. Таким образом, избыток ацетил-КоА способствует активации цитратного цикла. Метаболиты цитратного цикла используются не только как субстраты синтеза углеродного скелета ряда соединений, но и являются донорами водорода для образования восстановленных коферментов, участвующих в реакциях синтеза жирных кислот, стероидов и других веществ ). Два метаболита нитратного цикла могут дегидрироваться при участии NADP-зависимых дегидрогеназ: малата и изоцитрата. Например, малат может поступать из митохондрий в цитозоль клетки. В цитозоле находится NADP-зависимая дегидрогеназа (малик-фермент), катализирующая реакцию: 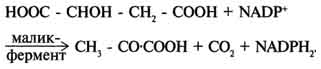 Малат и изоцитрат обеспечивают образование около половины общего фонда NADPH, используемого в восстановительных синтезах; вторая половина образуется в пентозофосфатном пути превращения глюкозы. Билет 15. Образование активных форм кислорода ОБРАЗОВАНИЕ ТОКСИЧНЫХ ФОРМ КИСЛОРОДА В ЦПЭ В ЦПЭ поглощается около 90% поступающего в клетки О2. Остальная часть О2 используется в других окислительно-восстановительных реакциях. Ферменты, участвующие в окислительно-восстановительных реакциях с использованием Кислорода, делятся на 2 группы: оксидазы и оксигеназы. Оксидазы используют молекулярный кислород только в качестве акцептора электронов, восстанавливая его до Н2О или Н2О2. Оксигеназы включают один (монооксигеназы) или два (диоксигеназы) атома кислорода в образующийся продукт реакции. Хотя эти реакции не сопровождаются синтезом АТФ, они необходимы для многих специфических реакций в обмене аминокислот (см. раздел 9), синтезе жёлчных кислот и стероидов, в реакциях обезвреживания чужеродных веществ в печени. В большинстве реакций с участием молекулярного кислорода его восстановление происходит поэтапно с переносом одного электрона на каждом этапе. При одноэлектронном переносе происходит образование промежуточных высокореактивных форм кислорода. В невозбуждённом состоянии кислород нетоксичен. Образование токсических форм кислорода связано с особенностями его молекулярной структуры. О2 содержит 2 неспаренных электрона с параллельными спинами, которые не могут образовывать термодинамически стабильную пару и располагаются на разных орбиталях. Каждая из этих орбиталей может принять ещё один электрон. Полное восстановление О2 происходит в результате 4 одноэлектронных переходов. Супероксид, пероксид и гидроксильный радикал - активные окислители, что представляет серьёзную опасность для многих структурных компонентов клетки (рис. 6-30). Активные формы кислорода могут отщеплять электроны от многих соединений, превращая их в новые свободные радикалы, инициируя цепные окислительные реакции. Большая часть активных форм кислорода образуется при переносе электронов в ЦПЭ, прежде всего, при функционировании QH2-дегидрогеназного комплекса. Это происходит в результате неферментативного переноса ("утечки") электронов с QH2 на кислород. В отличие от рассмотренного механизма на этапе переноса электронов при участии цитохромоксидазы (комплекс IV) "утечка" электронов не происходит благодаря наличию в ферменте специальных активных центров, содержащих Fe и Сu и восстанавливающих О2 без освобождения промежуточных свободных радикалов. В фагоцитирующих лейкоцитах (гранулоцитах, макрофагах и эозинофилах) в процессе фагоцитоза усиливаются поглощение кислорода и образование активных радикалов. Активные формы кислорода образуются в результате активации NADPH-оксидазы, преимущественно локализованной на наружной стороне плазматической мембраны, инициируя так называемый "респираторный взрыв" с образованием активных форм кислорода. Защита организма от токсического действия активных форм кислорода связана с наличием во всех клетках высокоспецифичных ферментов: супероксиддисмутазы, каталазы, глутатион-пероксидазы, а также с действием антиоксидантов. |
