Информ.материал_протозоозы. Эпидемиология и профилактика протозоозов (амебиаз, лямблиоз, малярия, трипаносомоз, лейшманиоз и др.).
 Скачать 3.57 Mb. Скачать 3.57 Mb.
|
|
Рис. 21. Жизненный цикл Naegleria fowleri. i - инфекционная стадия; d - диагностическая стадия. Диагностика. Клиническая диагностика затруднена вследствие сходства симптомов первичного амебного поражения мозга с симптоматикой менингитов и менингоэнцефалитов бактериальной или вирусной этиологии. Принимаются во внимание данные анамнеза (купание в богатых илом водоемах с теплой водой, контакт со сточными водами и т. д.). Окончательный диагноз первичного амебного менингоэнцефалита устанавливают микроскопически при обнаружении N. fowleri в осадке спинномозговой жидкости или биоптатах мозга. От окружающих клеток они отличаются подвижностью. Используют также культуральный метод. Профилактика заключается в соблюдении правил личной гигиены. Особое внимание следует обращать на предотвращение заражения при купании в бассейнах и открытых водоемах, в которых температура воды достигает 35 оС и более. 2.3. Отряд Diplomonadida Простейшие этого отряда обладают двойным набором всех органоидов и характеризуются билатеральной симметрией. Они имеют 2 ядра, некоторые свободноживущие - 2 цитостома. Происхождение этих жгутиконосцев, видимо, связано с не доведенным до конца продольным делением. Из числа паразитических дипломонад наибольший интерес представляет род Lamblia. Известно около 40 видов лямблий - паразитов млекопитающих: собак, кошек, волков, белок, мышей и др., включая человека. Лямблии имеют характерную грушевидную форму с расширенным передним и суженным задним концом. Спинная сторона тела выпуклая, на брюшинной стороне отчетливо видна впадина - присасывательный диск, ограниченный опорными фибриллами. Это органоид прикрепления к поверхности кишечника. Лямблия кишечная (Lamblia intestinalis) - возбудитель лямблиоза. Этиология. Лямблии (L. intestinalis) - представители одной из ранних ветвей филогенетического дерева эукариотов, но имеют особенности, свойственные прокариотам (отсутствие митохондрий, интронов в генах и др.). Этот возбудитель впервые был обнаружен в фекалиях человека, больного диареей, и описан Антони ван Левенгуком в 1684 г.; в 1859 г. его подробно описал Д. Ф. Лямбль, который наблюдал этого представителя жгутиковых простейших в фекалиях детей с диареей в клинике Праги. Лямблия по форме напоминает грушу, разрезанную пополам, имеет тело длиной 10-18 мкм, 2 ядра и 4 пары жгутиков. По средней линии вдоль всего тела проходят два тонких аксостиля. В расширенной части тела расположены два присасывательных диска, с помощью которых паразит прикрепляется к ворсинкам кишечника. Питаются лямблии веществами с поверхности клеток кишечного эпителия. Лямблии обитают в тонкой кишке, иногда проникают в желудок и желчный пузырь. Биология развития (рис. 21). Существуют вегетативные формы лямблий и цисты, которые из них образуются. Из одной цисты при заглатывании ее новым хозяином образуется 2 трофозоита. Вегетативная форма имеет длину 10-18 мкм, ширину 8-10 мкм. Дорсальная сторона тела выпуклая, вентральная уплощена, и на передней расширенной стороне имеются присасывательные диски. Захватывая с помощью диска микроворсинки щеточной каемки, лямблия удерживается на поверхности слизистой оболочки. Она «откачивает» раствор питательных веществ из промежутков между ворсинками. У человека максимум численности лямблий приходится на верхние 2,5 м тонкой кишки. Здесь же наиболее высока интенсивность контактного пищеварения и всасывается большая часть углеводов, белков, жиров, витаминов, минеральных солей и микроэлементов. Лямблии способны поглощать питательные вещества и различные ферменты непосредственно из щеточной каемки, а следовательно, вмешиваться в процесс мембранного пищеварения и нарушать его. В более поздние периоды лямблии перемещаются из проксимальных в средние или дистальные отделы тонкой кишки. Большинство исследователей отрицают возможность паразитирования лямблий в желчных путях, желчном пузыре. Концентрированная желчь оказывает губительное действие не только на лямблий, но и на другие простейшие. Образование цист происходит в дистальном отделе тонкой кишки и в ободочной кишке и длится 12-14 ч. Здесь под влиянием неблагоприятных для них условий лямблии инцистируются. Вначале они теряют подвижность, на поверхности их тела появляются псевдоподиеобразные выпячивания цитоплазмы, жгутики отбрасываются. Тело приобретает овальную форму, происходит деление ядер. Цисты, покрытые плотной оболочкой, имеют округлую или овальную форму. На переднем конце видны 4 ядра, тесно прилегающие друг к другу, аксонемы и серповидно изогнутые фибриллы, длина которых 8-12 мкм, ширина 7-10 мкм. Как правило, из кишечника хозяина наружу выходят только цисты. Вегетативные стадии могут попадать во внешнюю среду лишь при очень сильных кишечных расстройствах. Размножение лямблий происходит путем продольного деления. Сначала делятся ядра, потом присасывательный диск и кинетосомы. У дочерних особей жгутики формируются заново. Цитокинез начинается с расширенного переднего конца тела. Эпидемиология. Лямблиоз распространен во всем мире. В большинстве стран, в том числе в России, случаи лямблиоза (жиардиаза) подлежат обязательной регистрации и статистическому учету. Во всем мире клинические формы лямблиоза обнаруживают примерно у 500 тыс. больных в год. В Российской Федерации ежегодно регистрируют более 100 тыс. больных, из них до 90 тыс. детей. Лямблиоз относится к контагиозным протозоозам. Факторами передачи возбудителя являются грязные руки, вода, пища, содержащие цисты лямблий. Насекомые (мухи, тараканы, мучные хрущаки, навозные жуки) также могут способствовать распространению цист лямблий. Механизм передачи инвазии гео-оральный. Заражающая доза составляет 10-100 цист. Период выделения цист у человека начинается в среднем на 9-12-е сутки после заражения и может длиться многие месяцы. Возможно бессимптомное носительство. Частота лямблиоза у детей в возрасте до 9 лет в 2-3 раза превышает таковую у взрослых. Дети начинают заражаться с 3-месячного возраста. Патогенез. Лямблии размножаются в кишечнике человека в огромных количествах, что не может быть безразличным для организма хозяина. В течение жизни они многократно прикрепляются к стенке кишки и открепляются от нее, что вызывает механическое раздражение, а также воздействует на нервные окончания стенки кишки и может привести к патологическим рефлекторным реакциям со стороны органов пищеварения. Происходят усиление митотических процессов и частая смена эпителия с заменой зрелых и функционально полноценных клеток молодыми, функционально незрелыми. Это приводит к нарушению всасывания пищевых веществ, в первую очередь жиров и жирорастворимых витаминов, а также углеводов и белков. Длительное паразитирование лямблий в организме человека вызывает нарушение функций печени и кишечника. Клинические проявления. Острый период лямблиоза характеризуется диареей, тошнотой, анорексией, резкими болями в эпигастрии и мезогастрии, вздутием кишечника. Часты жалобы на головные боли, уменьшение массы тела, повышенную утомляемость. Диагностика. Диагноз устанавливают путем микроскопического исследования фекалий и дуоденального содержимого. В дуоденальном соке обнаруживают вегетативные формы. В плотных оформленных фекалиях обнаруживают только цисты, а в жидких наряду с цистами можно найти и вегетативные формы. Профилактика. Основными мерами профилактики лямблиоза являются предотвращение фекального загрязнения внешней среды, продуктов питания, воды, соблюдение правил личной гигиены, уничтожение механических переносчиков (мух и тараканов). Род Plasmodium. Малярийные плазмодии вызывают малярию - острое протозойное заболевание человека с трансмиссивным механизмом заражения, характеризующееся выраженными симптомами интоксикации, циклическим течением с чередованием приступов лихорадки и периодов апирексии, увеличением селезенки и печени, развитием гемолитической анемии при прогредиентном течении, рецидивами. Историческая справка. Изучение малярии (одной из древнейших болезней человека) неразрывно связано с историей развития человеческой цивилизации. Предполагается, что малярия стала распространяться на Земле (из Африканского региона Средиземноморья) около 10 000 лет назад в связи с интенсивным развитием земледелия, торговли, освоением новых земель. В старинных египетских папирусах, древней китайской литературе и канонах (Charaka и Sushrutha) классической древнеиндийской медицины (Ayurveda) до нашего времени сохранились описания клинической картины и эпидемий малярии, и уже тогда высказывались предположения о возможной связи болезни с укусами комаров. Позже (VI-V вв. до н. э.) врачи Древней Греции Гиппократ и Эмпедокл подробно описали клинику малярии. Гиппократу принадлежит заслуга в том, что он выделил малярию из группы лихорадочных заболеваний и предложил различать 3 формы болезни: «quotidian» (ежедневные приступы), «tertian» (приступы через день) и «quartan» (приступы через 2 дня). Эпоха научных открытий в изучении малярии началась в 1640 г., когда испанский врач-конкистадор Хуан дель Вего впервые для лечения больных малярией использовал настой коры хинного дерева, ранее использовавшийся индейцами Перу и Эквадора как противолихорадочное средство. Своим названием малярия обязана итальянскому естествоиспытателю Д. Ланчизи (1717), который связывал заражение людей с «ядовитыми» испарениями болот (итал. mal aria - дурной воздух). В 1880 г. французский врач A. Лаверан, работая в Алжире, подробно описал морфологию возбудителя малярии. В 1897 г. английским военным врачом Р. Россом в Индии был установлен трансмиссивный механизм передачи малярии. В настоящее время малярия является одной из серьезнейших проблем здравоохранения для более 100 стран Африки, Азии и Южной Америки, около половины населения Земли живут в условиях риска заражения малярией. Практически во всех странах Европы и Северной Америки ежегодно регистрируют сотни завозных случаев малярии среди людей, прибывших из регионов ее распространения; растет число случаев так называемой «аэропортной» малярии. По данным ВОЗ, ежегодно в мире малярией заболевают 200-250 млн человек, не менее 80 % всех случаев малярии регистрируют в странах Африки, расположенных к югу от Сахары. Каждый год от малярии умирают от 1 до 2 млн человек, в основном детей в возрасте до 5 лет. Социальные и экономические потери только в Африке оценивают в 2 млрд долл. США в год. С 1998 г. под эгидой ВОЗ, Всемирного банка и ЮНИСЕФ реализуется научно-практическая программа (Roll Back Malaria Initiative) по контролю за малярией (в основном в развивающихся странах). Программа рассчитана до 2010-2015 гг. Активно ведутся разработки по созданию эффективной противомалярийной вакцины, однако для этого потребуется как минимум еще 10-15 лет. Поиск, разработка и совершенствование препаратов для лечения малярии являются одними из приоритетных направлений деятельности ВОЗ, различных фармацевтических компаний, научно-исследовательских институтов во всем мире. В последние годы в России в результате роста миграционных процессов, интенсивного развития международного туризма отмечено увеличение числа завозных случаев малярии. Этиология. Название болезни «малярия» фактически обобщает четыре отдельных протозойных заболевания, вызываемых соответственно четырьмя видами возбудителей. Возбудители малярии относятся к подцарству Protozoa, типу Apicomplexa, роду Plasmodium, который подразделяется на два подрода: Plasmodium и Laverania (табл. 3). Для каждой из четырех форм малярии характерны свои клинические, патогенетические и эпидемиологические особенности. Важнейшее место занимает малярия falciparum, возбудитель которой относится к особому подроду (Laverania). Только малярия falciparum может протекать злокачественно, приводя к летальному исходу, на ее долю приходится 80-90 % от всех случаев малярии в мире. Эпидемиология. При малярии возможны различные механизмы передачи инфекции. ♦ Трансмиссивный механизм (при укусе комара). Этот механизм является основным, обеспечивающим существование плазмодиев как биологического вида. Источник инфекции - человек (больной малярией или паразитоноситель), в крови которого имеются зрелые гаметоциты (мужские и женские половые клетки паразита) (рис. 24). Переносчики малярии - только женские особи комаров рода Anopheles. В желудке комара, куда вместе с кровью попадают мужские и женские гаметоциты, находящиеся внутри эритроцитов, происходит их дальнейшее созревание (после лизиса эритроцитов), слияние и многократное деление с образованием спорозоитов, которые накапливаются в слюнных железах комара. Бесполые формы паразита (трофозоиты, шизонты), попав в желудок комара, погибают. Таким образом, в организме человека происходит бесполое развитие паразитов (шизогония) с образованием и накоплением гаметоцитов, в организме комара - половое развитие (спорогония), слияние мужских и женских гамет с дальнейшим развитием и образованием спорозоитов. ♦ Вертикальный механизм передачи (от матери плоду или от матери новорожденному, в процессе родов - парентеральный механизм). При вертикальной передаче плод редко заражается через плаценту. Чаще заражение происходит во время родов при попадании в кровоток новорожденного не- Таблица 2.3. Возбудители и формы малярии 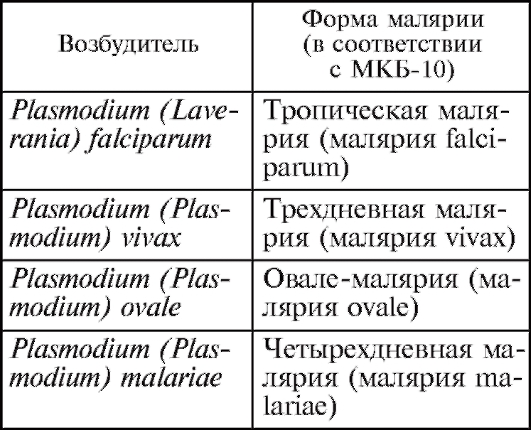 Рис. 2.24. Эритроциты, пораженные малярийным плазмодием. 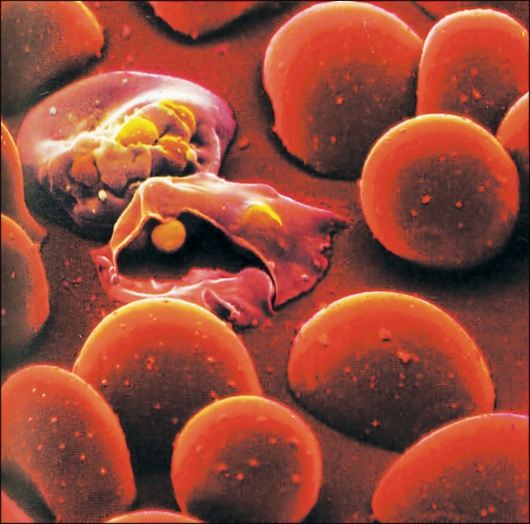 которого количества материнской крови, в эритроцитах которой находятся бесполые формы паразита. ♦ Парентеральный механизм заражения приводит к развитию так называемой шизонтной малярии. Он наблюдается при гемотрансфузиях и реже при нарушениях асептики при инъекциях (например, среди наркоманов, использующих один шприц). В случае заражения при переливании крови источником инфекции является донор-паразитоноситель, часто имеющий субпатентную паразитемию (количество паразитов менее 5 в 1 мкл крови). В связи с этим в эндемичных по малярии регионах мира для контроля донорской крови необходимо использовать наряду с паразитологическими методами (определение паразита в препаратах толстой капли и мазках крови) и серологические (иммунологические) методы лабораторной диагностики малярии - реакцию непрямой иммунофлюоресценции (РНИФ), иммуноферментный анализ (ИФА) и др. Поскольку при парентеральном заражении обычно вводится небольшое количество паразитов (особенно при инъекциях), инкубационный период может длиться до 3 мес (при массивном заражении инкубационный период, наоборот, может быть и очень коротким - несколько дней), что важно знать при диагностике малярии у больных, перенесших хирургическую операцию, наркоманов. Для распространения малярии в определенном регионе (стране, крае, области) необходимы следующие условия. ♦ Источник инфекции (больной малярией или паразитоноситель). ♦ Наличие эффективного переносчика (комары рода Anopheles). Восприимчивость к малярийным паразитам - главное качество конкретного вида комаров из этого рода. Численность комаров рода Anopheles среди популяций других видов не столь высока, как немалярийных комаров, и они в редких случаях серьезно беспокоят своими укусами. Между тем и малочисленные виды при прочих благоприятных условиях (близость мест вы- плода комаров к жилищу людей) могут играть достаточно существенную роль. Более 70 видов комаров рода Anopheles (среди более 200 известных видов) могут служить эффективными переносчиками малярии. ♦ Благоприятные климатические условия (среднесуточная температура воздуха выше 16 оС и наличие мест для выплода комаров: водоемы, резервуары для воды, ирригационные сооружения и др.). Минимальная среднесуточная температура воздуха, необходимая для развития в организме комара P. vivax, - 16 оС, P. falciparum - 18 оС, при более низкой температуре спорогонии не происходит. Продолжительность спорогонии тем меньше, чем выше температура, но до определенного уровня, так как среднесуточная температура 30 оС и выше неблагоприятна для спорогонии. При оптимальной среднесуточной температуре (25-26 оС) спорогония P. vivax длится 8-9 дней, P. falciparum - 10-11 дней. Весь ареал распространения малярии на земном шаре (от 45о с. ш. и 40о ю. ш. до 64о с. ш. и 45о ю. ш. в разные годы) занимает малярия vivax. Ареал малярии falciparum и малярии malariae несколько меньше вследствие необходимости в более высокой температуре для эффективной спорогонии, ареал малярии ovale расположен в двух не связанных территориально регионах - тропической Африке и государствах западной части Тихого океана (Индонезия, Вьетнам, Филиппины, Новая Гвинея и др.). В горных странах очаги малярии могут формироваться до высоты 1000 м в зоне умеренного климата и до 1500-2500 м в зоне субтропиков и тропиков, причем на больших высотах (1000-1500 м и выше) встречаются очаги только малярии vivax. Малярия отличается выраженной сезонностью. В условиях умеренного и субтропического климата малярийный сезон делится на периоды эффективной заражаемости комаров, передачи инфекции и массовых проявлений заболевания. Начало периода эффективной заражаемости комаров (при наличии источников инфекции - больных, паразитоносителей) совпадает с моментом устойчивого повышения среднесуточной температуры до 16 оС. Начало периода передачи инфекции связано с завершением спорогонии в организме комара, что зависит от конкретных среднесуточных температур данного года. В Московском регионе длительность периода передачи малярии vivax может достигать 1,5-2 мес и более, до первых осенних заморозков. Границы периода массовых проявлений менее определенны. В очагах, где передается только трехдневная малярия, период массовой заболеваемости может начинаться задолго до начала периода передачи. Наблюдаемые случаи представляют собой первичные проявления малярии vivax с длительной инкубацией (3- 10 мес) за счет заражения в прошлом сезоне и сохранения в печени гипнозоитов (без первичных проявлений с короткой инкубацией), а также отдаленные экзоэритроцитарные рецидивы (после серии приступов малярии с короткой инкубацией в прошлом сезоне без адекватной противорецидивной терапии). Восприимчивость к малярии всеобщая. Исход заражения после попадания возбудителя в кровоток и клиническое течение болезни зависят от индивидуального иммунологического статуса, активности действия факторов неспецифической врожденной резистентности, напряженности постинфекционного иммунитета, а у новорожденных - от уровня специфических антител класса G, полученных от матери. Исключение составляют коренные жители Западной Африки и Новой Гвинеи, в большинстве своем невосприимчивые к заражению P. vivax, что связано с генетически детерминированным отсутствием у них эритроцитарных изоангигенов системы Даффи, выполняющих функцию рецепторов для мерозоитов P. vivax. Соответственно в этом регионе значительно реже, чем в других регионах тропической Африки, регистрируют случаи малярии vivax. Относительной устойчивостью к заражению всеми видами плазмодиев обладают лица, являющиеся носителями аномального гемоглобина (при талассемии, серповидно-клеточной анемии, носительстве гемоглобинов Е и С и др.), имеющие нарушения строения цитоскелета эритроцитов (при наследственном сфероцитозе, юго-восточном овалоцитозе, наследственном эллиптоцитозе) или дефицит глюкозо-6-фосфатдегидрогеназы эритроцитов. При заражении малярией они болеют легко, численность паразитов в крови сохраняется на сравнительно низком уровне, случаи злокачественного течения (церебральной формы малярии falciparum) практически отсутствуют. Вместе с тем у лиц с дефицитом глюкозо-6-фосфатдегидрогеназы возникает риск острого гемолиза при использовании ряда противомалярийных препаратов (примахин, хинин и др.). Механизмы естественной устойчивости к различным формам малярии во многом еще не ясны, их изучение продолжается. Определенной устойчивостью к заражению всеми формами малярии обладают также новорожденные. Это объясняется наличием пассивного иммунитета за счет антител класса G, получаемых от гипериммунной матери (в очагах с высокой заболеваемостью малярией); поддержанием специфического иммунитета после рождения за счет антител класса А, получаемых с грудным молоком; наличием у новорожденного фетального гемоглобина, малопригодного для развития малярийного паразита. После первых 3-6 мес жизни у новорожденных значительно возрастает риск развития тяжелых, злокачественных форм малярии falciparum (замена эритроцитов, содержащих фетальный гемоглобин, эритроцитами, содержащими нормальный гемоглобин; перевод на смешанное питание, т. е. поступление в пищу парааминобензойной кислоты, необходимой для развития паразита, которая отсутствует в материнском молоке). Иммунитет при малярии нестерильный, видо- и штаммоспецифический, нестойкий и непродолжительный. Для поддержания защитного уровня антител необходима постоянная антигенная стимуляция в виде повторных заражений малярией. Иммунитет к P. malariae и P. vivax формируется раньше и сохраняется дольше, чем к P. falciparum. Противомалярийный иммунитет включает клеточный и гуморальный ответы. Началом иммунных процессов, которые стимулируют синтез антител, является фагоцитирование малярийных паразитов макрофагами. Это проявляется гиперплазией гистиофагоцитарной системы селезенки, печени, костного мозга. Генетические варианты, связанные с изменением свойств эритроцитов и обеспечивающие устойчивость к возбудителям малярии. Малярия является направляющей силой эволюции, которая привела к отсутствию антигенов Даффи, появлению разных форм гемоглобинопатий (талассемия, серповидно-клеточная анемия и др.), дефицита глюкозо-6-фосфатдегидрогеназы, овалоцитоза и других менделевских болезней человечества, обеспечивающих устойчивость к малярии. Широкое распространение ряда генетических аномалий среди населения регионов, высокоэндемичных по малярии, можно рассматривать как результат длительного взаимодействия популяций возбудителей и их хозяев. Наибольшее влияние возбудителей малярии испытали представители негроидной расы, проживающие в тропическом поясе Земли, у которых эта инфекция играла роль основного фактора генетического отбора. Серповидно-клеточные анемии. Это группа генетических заболеваний, возникающих у гомо- и гетерозигот в результате точечной мутации в гене HbB, ответственном за продукцию β-цепи гемоглобина человека. Эта мутация приводит к пониженной растворимости гемоглобина и повышению его полимеризации, что в свою очередь обусловливает изменение формы эритроцитов, которые становятся серповидными. Такие эритроциты теряют эластичность, закупоривают мелкие сосуды и гемолизируются. Гемоглобин S. Мутация HbS в 6-м кодоне (ГАГ вместо ГТС с заменой глутаминовой кислоты на валин) приводит к полимеризации гемоглобина, вызывающей серповидно-клеточную анемию у гомозигот. У гетерозигот гемоглобин S в 90 % случаев защищает от летального исхода тропической малярии. Гомозиготность является летальной, а гетерозиготность - нелетальной. Мутация HbS весьма широко распространена в некоторых районах Африки. Мутантная β-цепь менее эффективна в предотвращении генерации кислородных радикалов внутри эритроцитов самой клеткой или паразитами. Предполагают, что эта мутация появилась от 2000 до 3000 лет назад. Гемоглобин С. Происходит мутация в гене HbB, при которой глутаминовая кислота или валин заменяются на лизин в 6-м положении. Аллель HbC в гомозиготном состоянии обеспечивает защиту на 90 %, в гетерозиготном - на 30 %. Эта мутация у носителей не сопровождается тяжелыми клиническими проявлениями по сравнению с мутацией HbS. Гемоглобин Е. Происходит мутация в гене HbB, при которой глутаминовая кислота заменяется на лизин в 26-м положении. Эта гемоглобинопатия может обеспечивать защиту от трехдневной малярии. У гомозигот по HbE анемия протекает бессимптомно. Носительство гемоглобина Е обычно встречается в странах Юго-Восточной Азии, его имеют до 50 % населения. Предполагают, что эта мутация возникла относительно недавно и быстро распространилась в популяции. Талассемии. Это класс анемий, вызываемых аномалиями в генах, кодирующих продукцию гемоглобина, при которых происходят утрата, уменьшение или замена (например, на γ или δ) α- или β-цепей в молекуле гемоглобина в результате делеции или других перестроек копий глобиновых генов на хромосомах 11 и 16. К настоящему времени описано более 300 подобных мутаций, приводящих к самым разнообразным клиническим проявлениям. Наличие талассемии в гомозиготном состоянии приводит к тяжелой болезни или гибели. В гетерозиготном состоянии инфицированный малярийным плазмодием человек является практически здоровым. Защитный механизм талассемии неизвестен. В Европе высокая частота талассемий обнаружена в регионах, прилегающих к Средиземному морю. Дефицит глюкозо-6-фосфатдегидрогеназы (Г-6-ФД) в эритроцитах. Дефицит Г-6-ФД - патология, связанная с мутациями в гене G6PD на Х-хромосоме и снижающая способность эритроцитов препятствовать окислению. Ген Г-6-ФД локализован в области Хq28-хромосомы и содержит 13 экзонов. Описано более 300 различных мутаций в этом гене, приводящих к значительному полиморфизму заболеваний. В результате разрушения гемоглобина паразитом высвобождаются протеиды и железо, участвующие в окислительном процессе, токсичном для плазмодия. Дефицит Г-6-ФД способствует окислению, что приводит к снижению частоты тяжелых клинических проявлений тропической малярии у гетерозиготных женщин и гомозиготных мужчин как в странах Востока, так и в Западной Африке примерно на 50 %. Это одна из распространенных наследственных болезней человека: данную мутацию имеют около 100 млн человек в мире. Наибольшее распространение заболевание получило в странах Средиземноморья, Ближнего и Среднего Востока, северных регионов Африки и Юго-Восточной Азии. Отсутствие антигенов Даффи в эритроцитах. Единственной аномалией, защищающей от малярии и не вызывающей патологию, является отсутст- вие антигенов Даффи в эритроцитах жителей Западной и Центральной Африки. Эта мутация делает ее носителей невосприимчивыми к трехдневной малярии, так как P. vivax не могут проникать в эритроциты, не имеющие антигенов Даффи, выполняющих роль рецепторов для плазмодия данного вида. В Западной и Центральной Африке частота такой аномалии составляет 97 %. Только в этих регионах земного шара встречаются гомозиготы по данной мутации. Овалоцитоз. Эта эритроцитарная патология связана с делецией в 27-й паре нуклеотидов гена SLC4A1. В норме данный ген кодирует синтез белка мембраны эритроцитов, который осуществляет обмен анионов. Указанная аномалия проявляется только в гетерозиготном состоянии. Мутация в гене SLC4A1 ассоциируется с механизмом защиты от малярии, в том числе церебральной. Этот механизм еще не ясен, но, возможно, связан со снижением клеточной адгезии на эндотелии или с ингибирующим влиянием мутации на рост паразитов. Овалоцитоз встречается в Юго-Восточной Азии. Генетически обусловленная недостаточность мембранных эритроцитарных белков - гликофоринов А, В, С. Эти белки выполняют роль рецепторов для связывания с паразитом. Их генетическая недостаточность делает эритроциты относительно устойчивыми к инвазии P. falciparum. Gerbich (резус-отрицательная группа крови). Данная мутация, вызванная делецией в экзоне 3 гена GYPS, также приводит к снижению инвазии P. falciparum. Она часто встречается в Папуа-Новой Гвинее. Генетические варианты, связанные с патогенезом малярии. Наиболее изученной является генетика чувствительности/устойчивости к P. falciparum. В некоторых районах Африки до 70 % случаев тяжелой малярии сопровождается комой, которая приводит к смерти 15-30 % заболевших. Клеточная адгезия - основной фактор в патогенезе малярии. На мембране паразита расположен мембранный белок-1 (PFEMP-1) (лиганд), закодированный в генном семействе var. Каждый паразит содержит много различных копий гена, и путем переключения экспрессии между копиями он может вызвать значительную антигенную изменчивость. У человека на мембране эндотелия, тромбоцитов, макрофагов, эритроцитов имеются различные молекулы, которые служат связывающими рецепторами для различных форм мембранных белков PFEMP-1 паразита и обеспечивают слипание (адгезию) пораженных плазмодием клеток хозяина между собой и с эндотелием сосудов. Известны гены, участвующие в синтезе этих белков-рецепторов, - CD36, ICAM-1, CR1. Эти гены отвечают за синтез соответствующих белков - CD36, ICAM-1, CR1. Исследования в Гамбии и Кении показали, что гомозиготы по аллелю с нонсенс-мутацией в гене CD36 (CD36+ 1264 G) восприимчивы к церебральной малярии, а гетерозиготность ассоциируется с защитой от тяжелой малярии. Недостаточность CD36 довольно распространена в Африке. ICAM Kilifi, который является вариантом ICAM, чаще обнаруживают у кенийских детей с тяжелой малярией. Полиморфизм по CR1 и его недостаточность также ассоциируются с устойчивостью к тяжелой малярии. Присутствие инфицированных P. falciparum эритроцитов ведет к локальному скоплению паразитов и высвобождению продуктов их метаболизма, которые стимулируют Т-лимфоциты к синтезу цитокинов (TNF-α и IL-1 и IL-6), способствующих иммунной активации. TNF-α усиливает экспрессию молекул адгезии на эндотелии, увеличивая таким образом прилипание инфицированных эритроцитов. Поскольку у больных неинфицированные эритроциты слипаются с инфицированными, значительная агрегация эрит- роцитов в капиллярах мозга вызывает локальный тромбоз и местное воспаление. По-видимому, продукты, высвобождающиеся из воспалительных инфильтратов, вызывают разрушение эндотелия и просачивание плазмы и эритроцитов в ткани мозга. Такие точечные геморрагии наблюдаются в тканях мозга после смерти от церебральной малярии. На основании этого гипотетического механизма патогенеза было выбрано несколько кандидатных генов, которые включали гены, кодирующие TNF-α, iNOS и ICAM-1. По этим генам был описан полиморфизм, связанный с увеличенной или сниженной чувствительностью к малярии. Стадии развития малярийных паразитов. Жизненный цикл всех возбудителей малярии (рис. 2.25) включает двух хозяев: человека (шизогония - бесполый цикл развития) и комаров рода Anopheles (спорогония - половой цикл развития). В ходе шизогонии у всех видов малярийных паразитов традиционно выделяют 3 стадии: экзоэритроцитарную шизогонию (ЭЭШ), эритроцитарную шизогонию (ЭШ) и гаметогонию. Кроме того, в жизненных циклах P. vivax и P. ovale выделяют отдельную стадию («спячку») вследствие возможного внедрения в организм человека при укусе комара спорозоитов морфологически неоднородной группы - тахиспорозоитов и брадиспорозоитов или только брадиспорозоитов. В этих случаях брадиспорозоиты (гипнозоиты) длительно сохраняются в гепатоцитах в неактивном состоянии до начала ЭЭШ. Экзоэритроцитарная шизогония. Внедренные со слюной комара в организм человека спорозоиты очень быстро (в течение 15-30 мин) попадают с кровотоком в печень, где активно проникают в гепатоциты, не повреждая их. Спорозоиты P. falciparum, P. malariae и тахиспорозоиты P. vivax и P. ovale немедленно начинают ЭЭШ с образованием большого количества экзоэритроцитарных мерозоитов (до 40 000 из одного спорозоита при малярии falciparum). Гепатоциты разрушаются, и мерозоиты снова попадают в кровоток с последующим быстрым (в течение 15-30 мин) внедрением в эритроциты. Длительность ЭЭШ при малярии falciparum обычно составляет 6 дней, при малярии vivax - 8, при малярии ovale - 9, при малярии malariae - 15 дней. Стадия «спячки». При малярии vivax и малярии ovale брадиспорозоиты, внедрившиеся в гепатоциты, превращаются в неактивные формы - гипнозоиты, которые могут оставаться без деления несколько месяцев или даже лет до последующей реактивации (деление и образование мерозоитов). Таким образом, с гипнозоитами связаны характерные только для этих форм малярии длительная инкубация (до 3-10 мес и более) и возникновение отдаленных экзоэритроцитарных рецидивов. Эритроцитарная шизогония. После внедрения мерозоитов в эритроциты малярийные паразиты многократно (циклически) последовательно проходят стадии трофозоита (питающаяся одноядерная клетка), шизонта (делящаяся многоядерная клетка) и морулы (сформировавшиеся паразиты, находящиеся внутри эритроцита). В последующем после разрушения эритроцитов в плазму крови попадают мерозоиты. Наибольшее количество дочерних мерозоитов образуется при тропической малярии - до 40 в одном эритроците. Стадия ЭШ имеет строго определенную длительность: 48 ч при малярии falciparum, малярии vivax и малярии ovale и 72 ч при малярии malariae. Патогенез. Особенности цикла ЭШ и основные патогенетические механизмы развития тяжелых и осложненных форм малярии falciparum включают: • скопление (секвестрацию) инвазированных эритроцитов, содержащих взрослые трофозоиты (со стадии амебовидного трофозоита), шизонты |
