Информ.материал_протозоозы. Эпидемиология и профилактика протозоозов (амебиаз, лямблиоз, малярия, трипаносомоз, лейшманиоз и др.).
 Скачать 3.57 Mb. Скачать 3.57 Mb.
|
|
Трипаносома родезийская (Trypanosoma rhodesiense). T. rhodesiense вызывает африканский трипаносомоз родезийского типа, который во многом сходен с гамбийским типом африканского трипаносомоза, но это зооноз. Этиология и биология развития. Возбудитель - Т. rhodesiense - по морфологии близок к Т. gambiense. Основными хозяевами Т. rhodesiense служат различные виды антилоп, а также крупный рогатый скот, козы, овцы и реже человек. Главными переносчиками возбудителя родезийского типа являются мухи цеце группы morsitans (G. morsitans, G. pallidipes и др.). Они обитают в саваннах и саванновых лесах, более светолюбивы и менее влаголюбивы, чем palpalis, более зоофильны и охотнее нападают на крупных копытных и мелких бородавочников, чем на людей. Эпидемиология. Резервуарами Trypanosoma rhodesiense в природе являются различные виды антилоп и других копытных. В ряде случаев дополнительным резервуаром может стать крупный рогатый скот. Зоонозная форма сонной болезни распространена в равнинной саванне в отличие от антропонозной, тяготеющей к долинам рек. В естественных условиях саванны Т. rhodesiense циркулирует по цепи антилопа - муха це- це - антилопа без участия человека. Человек заражается эпизодически при посещении энзоотичных очагов. Относительную редкость заражения людей в дикой природе можно также объяснить выраженной зоофилией переносчика, вследствие чего мухи цеце соответствующих видов неохотно нападают на человека. В этих условиях заболевают представители определенных профессий - охотники, рыболовы, военнослужащие, а также путешественники. Мужчины болеют значительно чаще, чем женщины и дети. Патогенез и клинические проявления сонной болезни родезийского типа отличаются более острым и тяжелым течением. Инкубационный период короче, чем при гамбийском типе, и составляет 1-2 нед. В месте укуса возникает первичный аффект - трипаносомный шанкр - в виде фурункула, который исчезает через несколько дней, оставляя иногда небольшой рубец. Трипаносомный шанкр отмечается не у всех больных, чаще у европейцев, чем у африканцев. В период развития шанкра или через несколько дней после его появления паразит появляется в крови, и с этим ассоциируется начало лихорадочного периода. Лихорадка носит неправильный характер, сопровождается головной болью. Смерть больных при отсутствии лечения нередко наступает через 9-12 мес. Гемолимфатическая фаза инвазии выражена слабо. У всех больных обнаруживают трипаносомы в крови, у многих в СМЖ. Диагностика такая же, как при гамбийском типе. Профилактика и меры борьбы такие же, как при гамбийском типе. Трипаносома американская (Trypanosoma cruzi). T. cruzi вызывает американский трипаносомоз (болезнь Шагаса) - трансмиссивную природно-очаговую протозойную болезнь, которая характеризуется наличием острой и хронической фаз. В 1907 г. бразильский врач С. Шагас обнаружил в триатомовых (поцелуйных) клопах, а в 1909 г. выделил из крови больного возбудителя и описал болезнь, названную в честь него болезнью Шагаса. Этиология. Возбудитель Trypanosoma cruzi отличается от возбудителей африканского трипаносомоза меньшей длиной тела (13-20 мкм) и более крупным кинетопластом трипомастиготных форм. В фиксированных препаратах крови Т. cruzi часто имеет изогнутую форму наподобие букв С или S (С- и S-формы). Возбудитель американского трипаносомоза относится к секции Stercoralia (лат. stercus- кал, oralis - ротовой), т.е. передается через фекалии клопа-переносчика. Кроме того, для T. cruzi характерна персистенция (лат. persistere - оставаться, упорствовать) - способность паразита сохраняться в организме хозяина в течение всей жизни с развитием резистентности (устойчивости) к реинвазии (повторному заражению). Трипаносомы при этом продолжают медленно размножаться в течение всей жизни хозяина в клетках некоторых тканей. Биология развития. Цикл развития T. cruzi проходит со сменой хозяев: а) позвоночных животных (более 100 видов) и человека; б) переносчика возбудителя (клопы подсемейства Triatominae) (рис. 2.11). 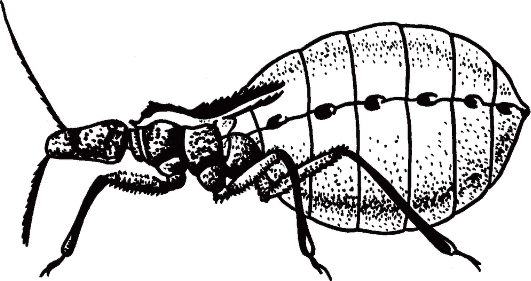 Рис. 11. Triatoma infestans (поцелуйный клоп) - специфический переносчик трипаносом, напитавшийся кровью. 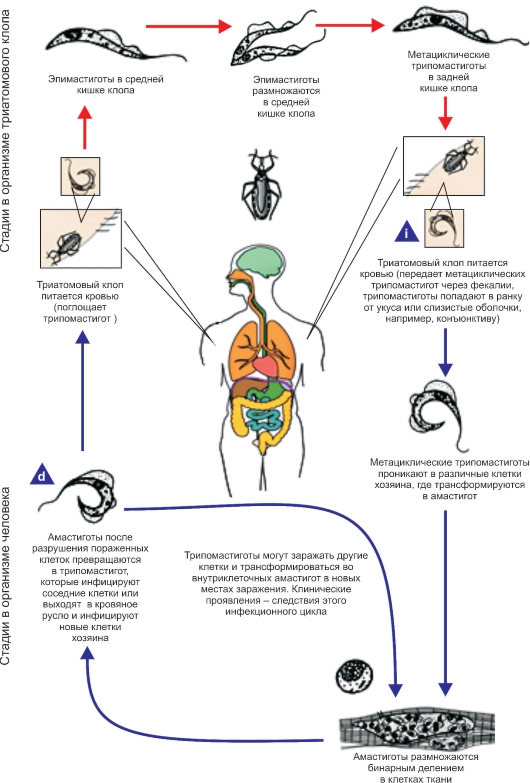 Рис. 12. Жизненный цикл Trypanosoma cruzi. Цикл развития в переносчике (рис. 12). Инвазионной стадией для переносчика, как и для позвоночного животного и человека, являются трипомастиготы. Поскольку колющий ротовой аппарат в отличие от такового мухи цеце у клопов очень слабый и не может проколоть даже кожу человека, они ищут ссадины или слизистые оболочки конъюнктивы, носовой полости, рта (за что получили название поцелуйных клопов). Заражение клопов происходит при питании кровью человека или животных, содержащей трипомастиготы. Попадая в организм триатомовых клопов (переносчики американского трипаносомоза), T. cruzi достигают желудка насекомого, превращаются здесь в эпимастиготы и размножаются в течение нескольких дней. Затем они проходят в заднюю и прямую кишку, где возвращаются к трипомастиготной форме. С этого момента клопы становятся заразными. После или во время засасывания крови клопы опорожняют прямую кишку, и возбудители попадают на кожу человека или слизистые оболочки. Однократно инвазированный клоп сохраняет паразитов до конца жизни (около 2 лет). Трансовариальная передача отсутствует. Инвазионной стадией для позвоночного хозяина является трипомастиготная форма. Передача инвазии человеку и другим теплокровным происходит не прямо через укус клопа, а путем контаминации экскрементами клопов, содержащими трипаносом, ранки от укуса или слизистых оболочек. В месте укуса формируется шагома - первичный симптом трипонасомоза. Как правило, дефекация у клопов происходит непосредственно во время кровососания. Укусы клопов вызывают сильный зуд и воспаление, в результате чего паразиты могут быть занесены в ранку при расчесывании. У человека зарегистрированы также случаи врожденного трипаносомоза. После попадания в организм позвоночного животного (природного резервуара) или человека трипомастиготы некоторое время остаются в периферической крови, но не размножаются. Затем они проникают в мышечные клетки и клетки эндотелия легких, печени, лимфатических узлов и других органов, однако паразиты скапливаются преимущественно в клетках сердечной мышцы. Внутри клеток трипомастиготы трансформируются в эпимастиготную, промастиготную формы и в конце трансформации превращаются в округлую безжгутиковую форму - амастиготу длиной 2,5-6,5 мкм, содержащую круглое ядро и мелкий овальной формы кинетопласт. Внутри клетки амастиготы размножаются бинарным делением. Наполненная амастиготами клетка человека или животного увеличивается в размерах и превращается в псевдоцисту, оболочкой которой служит стенка клетки хозяина. Перед разрывом и сразу после разрыва такой псевдоцисты амастигота (минуя промастиготную и эпимастиготную стадии) превращается в трипомастиготу. Трипомастиготы инвазируют соседние клетки, размножаются в стадии амастигот с образованием новых псевдоцист. Таким образом, амастиготы - сугубо внутриклеточная форма паразита. Часть трипомастигот, высвободившихся из псевдоцисты и не попавших в соседние клетки, попадает в кровь, где циркулирует и может попасть оттуда в организм переносчика. Эпидемиология. Основными переносчиками возбудителя американского трипоносомоза являются летающие клопы Triatoma megistis, Triatoma infestans и др. Эти насекомые отличаются яркой окраской и сравнительно крупными размерами - 15-35 мм в длину. Нападают на человека и животных ночью. Трансовариальная передача трипаносом из поколения в поколение у триатомовых клопов отсутствует.  Рис. 13. Основной резервуар возбудителя в природе - броненосцы Южной и Центральной Америки, имеющие высокий уровень паразитемии. Передача возбудителя болезни Шагаса происходит по типу специфической контаминации. Грипаносомы, выделенные с фекалиями клопов во время кровососания, проникают в организм человека или животных через поврежденную кожу или слизистые оболочки глаз, носа, полости рта вблизи места укуса. Заражение трипаносомозом возможно также алиментарным путем (в том числе с молоком матери), при гемотрансфузиях. В настоящее время установлено, что возможна и трансплацентарная передача Т. cruzi, но уровень ее сравнительно невысок: в среднем у больных матерей рождаются 2-4 % инфицированных детей. Механизм протективного действия плаценты полностью не изучен. Известны синантропные и природные очаги болезни Шагаса. В синантропных очагах, кроме человека, резервуарами возбудителя являются собаки, кошки, свиньи и другие домашние животные. По имеющимся данным, инфицированность собак в синантропных очагах в отдельных районах Бразилии составляет 28,2 %, в Чили - 9 %, кошек в Бразилии - 19,7 %, в Чили - 12 %. В природных очагах резервуарами возбудителя служат броненосцы (сами не болеют) (рис. 2.13), опоссумы (наиболее важны, так как имеют высокий индекс паразитемии), муравьеды, лисы, обезьяны и др. В Боливии и некоторых районах Перу определенное значение в качестве резервуара Т. cruzi имеют морские свинки, которых население держит дома для употребления в пищу. Естественная зараженность морских свинок достигает 25-60 %. Болезнь Шагаса широко распространена, ее выявляют практически во всех странах Американского континента от 42о с. ш. до 43о ю. ш. Наиболее часто инфекцию регистрируют в Бразилии, Аргентине, Венесуэле. Она встречается также в Боливии, Гватемале, Гондурасе, Колумбии, Коста-Рике, Панаме, Парагвае, Перу, Сальвадоре, Уругвае, Чили, Эквадоре. Патогенез и клинические проявления. Т. cruzi паразитируют и размножаются в организме человека и позвоночного хозяина сначала в макрофагах кожи и подкожной клетчатки, затем в регионарных лимфатических узлах, далее - во всех органах. Наиболее поражаемым органом при болезни Шагаса является сердце. В острой стадии инфекции в миокарде развивается распространенный интерстициальный воспалительный процесс с отеком и разрушением миофибрилл (рис. 2.14). У некоторых больных, инвазированных Т. cruzi (более часто у детей раннего возраста), развивается острый специфический менингоэнцефалит с мононуклеарной инфильтрацией мягких мозговых оболочек, периваскулярными воспалительными реакциями, иногда в сочетании с геморрагией и пролиферацией глии. 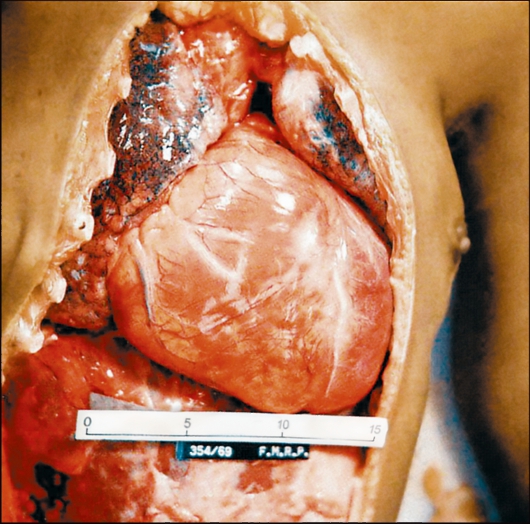 Рис. 14. Кардиомегалия при американском трипаносомозе. На снимке видно сильно увеличенное сердце больного, особенно хорошо заметны расширения правого предсердия и обоих желудочков. Серьезно страдают структуры ганглиев вегетативной нервной системы, что приводит к расстройствам иннервации внутренних органов. Считается, что инкубационный период при американском трипаносомозе колеблется от 1 до 2 нед. В месте инокуляции паразитов возникает воспалительная реакция - шагома. В случае проникновения паразитов через кожу первичное местное воспаление напоминает ненагнаивающийся фурункул. Среди общих симптомов необходимо указать на лихорадку постоянного или ремиттирующего типа с повышением температуры тела до 39-40оС, общую аденопатию, гепатоспленомегалию, отеки, иногда макулезные высыпания. Эти клинические симптомы возникают на фоне острого миокардита и раздражения менингеальной оболочки. Такая симптоматика, как правило, наблюдается у детей в эндемичных районах, при этом тяжесть течения увеличивается с уменьшением возраста больного. Примерно 10 % случаев заканчиваются летально в результате прогрессирующего менингоэнцефалита или тяжелого миокардита с сердечной недостаточностью. После острого периода болезнь переходит в хроническую стадию. Диагностика. В острой стадии паразитов легко обнаруживают путем микроскопии препаратов периферической крови. Наряду с окрашенными фиксированными препаратами можно исследовать раздавленную каплю крови, при этом подвижные паразиты хорошо видны под микроскопом. В хронической стадии микроскопия малоэффективна. В целях диагностики прибегают к серологическим реакциям, чаще к реакции связывания комплемента с антигеном из пораженного трипаносомами сердца. Широкое распространение в эндемичных районах получила ксенодиагностика - кормление незараженных триатомовых клопов на больном с последующим исследованием экскрементов насекомых для обнаружения паразитов. Профилактика. К профилактическим мерам относятся применение стойких контактных инсектицидов для уничтожения клопов-переносчиков, благоустройство жилищ. В связи с наличием бессимптомных носителей в эндемичных районах обязательно обследование доноров серологическими методами и с помощью ксенодиагностики. Род Leishmania (лейшмании). Простейшие рода Leishmania вызывают лейшманиозы - облигатно-трансмиссивные заболевания. Жизненный цикл лейшманий (рис. 15) протекает со сменой хозяев и включает две морфологические формы - амастиготную (безжгутиковую) и промастиготную (жгутиковую). У теплокровных амастиготы и микромастиготы лейшманий обнаруживают в протоплазме клеток ретикулоэндотелиальной системы, способных к фагоцитозу. Они имеют вид мелких овальных или круглых телец длиной от 2 до 5 мкм (рис. 2.16). В амастиготной форме лейшмании паразитируют в клетках (макрофагах) природных резервуаров (позвоночные животные) и человека, в промастиготной - обитают в различных частях пищеварительного тракта москитов, которые служат их переносчиками, и в питательных средах. 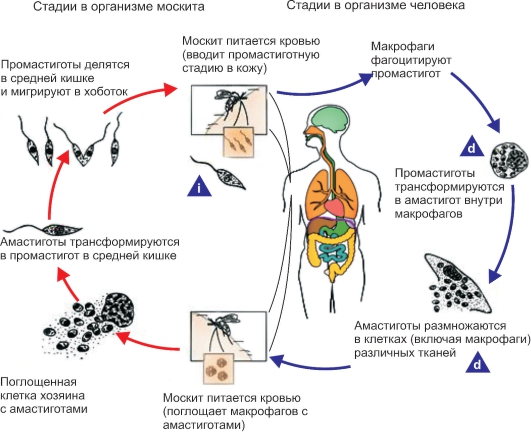 Рис. 15. Жизненный цикл Leishmania. i - инфекционная стадия; d - диагностическая стадия. 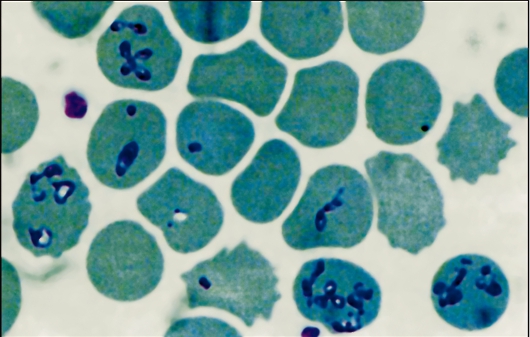 Рис. 16. Амастигота (лейшманиальная форма) лейшманий в клетках хозяина. 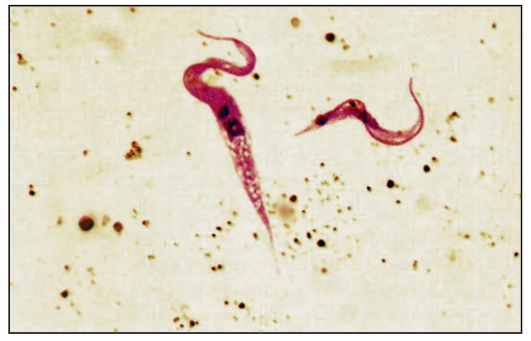 Рис. 2.17. Промастиготы лейшманий в культуре. Промастиготы лейшманий имеют удлиненную веретеновидную форму; их длина составляет 10-20 мкм, ширина - 3-5 мкм. Их ядро, протоплазма и кинетопласт окрашены так же, как и у амастигот. В культурах промастиготы часто представляют собой скопления в виде розеток со жгутиками, обращенными к центру (явление агломерации) (рис. 17). Переносчиками лейшманий являются двукрылые насекомые: в Старом Свете - москиты рода Phlebotomus, в Новом Свете - москиты рода Lutzomyia. Основные природные резервуары - грызуны и представители семейства псовых. Лейшманиозы распространены в странах с жарким и теплым климатом. Заболевания людей зарегистрированы в 76 странах Азии, Африки, Южной Европы, Центральной и Южной Америки. Во многих странах лейшманиозы наносят существенный социально-экономический ущерб. В России местные случаи заболевания в настоящее время отсутствуют, однако ежегодно регистрируют завозные случаи среди заразившихся при посещении стран ближнего и дальнего зарубежья, эндемичных по лейшманиозам. Различают три клинические формы лейшманиоза: кожный, слизистокожный и висцеральный лейшманиозы. При кожном лейшманиозе поражаются кожные покровы; при слизисто-кожном - кожа и слизистые оболочки, главным образом верхних дыхательных путей, иногда с разрушением мягких тканей и хрящей; при висцеральном лейшманиозе возбудитель локализируется в печени, селезенке, костном мозге и лимфатических узлах. В России чаще всего регистрируют кожный и висцеральный лейшманиозы. Молекулярные и генетические исследования патогенеза лейшманиоза. Патология, возникающая в результате инфекции Leishmania, в значительной мере зависит от генетических факторов хозяина. Чувствительность к Leishmania donovani, Salmonella typhimurium и Mycobacterium bovis контролируется одним и тем же геном на хромосоме 1 у мышей. Этот ген (NRAMP1) кодирует белок-1, ассоциированный с устойчивостью к лейшманиозу у мышей и человека. Слизистый лейшманиоз как осложнение кожного лейшманиоза ассоциирован с аллельными генами, кодирующими цитокины (фактор некроза опухоли). Эти цитокины связываются с одним из двух рецепторов фактора некроза опухоли. Мыши, у которых отсутствовал рецептор, не излечивались от кожных язв, несмотря на то что были способны контролировать размножение паразита. Для заболеваний, при которых клеточный иммунитет играет решающую роль, характерно участие главного комплекса гистосовместимости. В экспериментах на мышах было показано, что различные главные комплексы гистосовместимости были ассоциированы с разной чувствительностью к висцеральному лейшманиозу. Важная роль главного комплекса гистосовместимости в развитии кожного лейшманиоза установлена для человека и подтверждена при анализе генетического сцепления на мышах. В исследованиях был выявлен локус на хромосоме 1 мыши, который контролирует быстрое размножение Leishmania donovani у этих животных. Несколько групп исследователей выполнили большую работу на иммунологическом и генетическом уровнях и идентифицировали новый ген на хромосоме 1 мыши, который имел локусы lsh, bcg, ity. Этот ген белка-1, ассоциированного с природной устойчивостью макрофагов NRAMP1 (natural resistance-associated macrophage protein-1), локализован на мембране фаголизосом и является транспортером двухвалентных катионов. По-видимому, влияние этого белка на концентрацию Fe+ в вакуоли играет определенную роль в образовании кислородных радикалов в фаголизосоме. Исследования лейшманиоза на мышах также показали, что генетический контроль инфекции, вероятно, является полигенным. В ранних исследованиях было обнаружено, что HLA и локус H1 в дополнение к lsh определяли фенотип чувствительности у мышей. Более поздние исследования подтвердили эту точку зрения. В них было выявлено несколько генетических областей, которые содержат гены, определяющие чувствительность к Leishmania major, вызывающих кожный лейшманиоз у человека. Гены чувствительности до сих пор не идентифицированы. |
