Задачи с решением ТЛФ. Фармацевтическая технология Recipe
 Скачать 1.87 Mb. Скачать 1.87 Mb.
|
|
9. Оценка качества. – Анализ документации. Имеющийся рецепт, паспорт письменного контроля и номер лекарственной формы соответствуют. Расчеты сделаны верно. – Правильность упаковки, укупорки и оформления. Объем флакона из нейтрального стекла соответствует объему. Лекарственная форма укупорена герметично. Оформление соответствует требованиям приказа МЗ РФ №120 от 05.09.97г. – Полный химический контроль проводится в соответствии с требованиями приказа МЗ РФ № 214 от 16.07.97г. – Механические включения отсутствуют. – Органолептический контроль. Бесцветная прозрачная жидкость без запаха. – Отклонение в объеме ± 4% (от 48 до 52 мл) в соответствии с требованиями приказа МЗ РФ № 305 от 16.10.97 г. – Стерильность. В соответствии с требованиями ГФ ХI, ст. «Испытание на стерильность» не реже двух раз в квартал. – Апирогенность. В соответствии с требованиями ГФ ХI, ст. «Испытание на пирогенность» один раз в квартал. 10. Применение. Средство для парентерального питания (поддержание концентрации глюкозы в крови). № 44. 1. Recipe: Solutionis Acidi Ascorbinici 5% 50 мл Sterilisetur! Da. Signa: Для внутримышечного введения по 2 мл 1 раз в день. 2. Свойства ингредиентов. Acidum ascorbinicum (ГФ Х, ст. 6) – белый кристаллический порошок без запаха, кислого вкуса. Легко растворим в воде. Aqua pro injectionibus ( ФС 42-2620-97)- бесцветная, прозрачная жидкость без вкуса и запаха, не содержит пирогенные вещества. 3. Ингредиенты: совместимы. 4. Характеристика лекарственной формы. Инъекционный раствор для внутримышечного введения, представляющий собой истинный водный раствор легкоокисляющегося лекарственного вещества – кислоты аскорбиновой, требующего стабилизации, выдерживающего термическую стерилизацию. 5. Проверка доз: не проводится, так как вещества списков А и Б в рецепте отсутствуют. 6. Паспорт письменного контроля.  7. Технология лекарственной формы с теоретическим обоснованием. Изготовление инъекционного раствора ведется в соответствии с требованиями приказа МЗ РФ № 214 от 16.07.97 г. и № 308 от 21.10.97 г. и статьи ГФ ХI «Инъекционные лекарственные формы». Рабочее место оборудуется и подготавливается в соответствии с требованиями приказа МЗ РФ № 309 от 21.10.97 г. Паспорт письменного контроля оформляется на основании приказа МЗ РФ № 214 от 16.07.97 г. Кислота аскорбиновая имеет в своей структуре ендиеновую группу с подвижными атомами водорода. Она при воздействии кислорода, находящегося в растворе и над его поверхностью переходит в 2,3 – дикетогулоновую кислоту, лишенную С-витаминной активности. 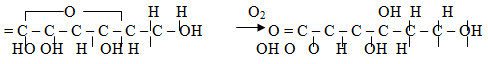 Для стабилизации применяют антиоксидант натрия сульфит безводный (2,0 на 1000 мл). С целью снижения болезненности инъекций к раствору добавляют натрия гидрокарбонат в эквивалентном количестве. Рассчитанные количества стабилизатора (натрия сульфата), натрия гидрокарбоната и кислоты аскорбиновой растворяют при перемешивании в 1/3 расчетного количества свежепрокипяченной воды для инъекций до окончания бурного выделения пузырьков углерода диоксида, затем добавляют еще 1/3 часть воды и перемешивают до полного растворения веществ. После окончания выделения пузырьков газа раствор доливают водой до требуемого объема и перемешивают. Раствор фильтруют через стерильный бумажный фильтр с подложенным под него комочком стерильной медицинской длинноволокнистой ваты в стерильный флакон нейтрального стекла вместимостью 50 мл. Флакон заполняют раствором доверху. Изготовленный раствор подвергают полному химическому контролю до и после стерилизации. (Для этого во флакон из стеклодрота отливают 2-3 мл раствора. Флакон укупоривают «под обкатку», стерилизуют вместе с основным флаконом. После стерилизации раствор из флакона используют для проведения полного химического анализа.) Кроме того, флакон с раствором просматривают невооруженным глазом на отсутствие механических включений на белом и черном фоне, освещенном электрической лампочкой матового стекла мощностью 40 Вт. Причем проверка на отсутствие механических включений проводится также дважды: до и после стерилизации. После первичной оценки на отсутствие механических включений и положительного химического анализа флакон укупоривают стерильной резиновой пробкой с металлическим колпачком «под обкатку», пробку обвязывают пергаментной бумагой. На обвязке надписывают простым карандашом состав, концентрацию раствора и фамилию лица, изготовившего раствор. Проверяют качество укупорки. Стерилизацию раствора проводят насыщенным паром при температуре 120°С в течение 8 мин в паровом стерилизаторе. После стерилизации вторично проводят полный химический контроль, вторично проверяют на отсутствие механических включений и качество укупорки. 8. Упаковка и оформление. Флакон с готовым раствором в соответствии с требованиями приказа МЗ РФ № 120 от 05.09.97г. оформляют этикеткой «Для инъекций», на которой кроме общих для всех этикеток пунктов указывают: «Раствор кислоты аскорбиновой 5% 50 мл. Для внутримышечного введения по 2 мл 1 раз в день» и указывают номер анализа. Предупредительные надписи: «Беречь от детей», «Хранить в защищенном от света месте». Наклеивают номер рецепта. Срок хранения укупоренного «под обкатку» в аптеке составляет 30 с уток при температуре не выше 25°С, в защищенном от света месте. 9. Оценка качества. – Анализ документации. Имеющийся рецепт, паспорт письменного контроля и номер лекарственной формы соответствуют. Расчеты сделаны верно. – Правильность упаковки, укупорки и оформления. Объем флакона нейтрального стекла соответствует объему раствора. Лекарственная форма укупорена герметично. Колпачок не прокручивается. Оформление соответствует требованиям приказа МЗ РФ № 120 от 05.09.97 г. – Полный химический контроль проводится в соответствии с требованиями приказа МЗ РФ № 214 от 16.07.97г. – Механические включения отсутствуют. – Органолептический контроль. Прозрачная бесцветная или желтоватого цвета жидкость без запаха, кислого вкуса. – Отклонения в объеме ± 4% (от 48 до 52 мл.) – Стерильность. В соответствии с требованиями. ГФ ХI, ст. «Испытание на стерильность» не реже двух раз в квартал. – Апирогенность. В соответствии с требованиями ГФ ХI, сп. «Испытание на пирогенность» один раз в квартал. 10. Применение. Применяют при гипо- или авитаминозах витамина С. № 45. 1. Recipe: Solutionis Coffeini – natrii benzoatis 20% 25 мл Sterilisetur! Da. Signa: Для подкожного введения по 2 мл 2 раза в день. 2. Свойства инггредиентов. Coffeinum – natrii benzoas (ГФ, ст. 173) – белый порошок без запаха, легко растворим в воде. Aqua pro injectionibus ( ФС 42-2620-97)- бесцветная, прозрачная жидкость без вкуса и запаха, не содержит пирогенные вещества. 3. Ингредиенты: совместимы. 4.Характеристика лекарственной формы. По определению ГФ XI лекарственные средства для парентерального применения – стерильные водные и неводные растворы, суспензии, эмульсии и сухие твердые вещества (порошки, пористые массы, таблетки), которые растворяют в стерильном растворителе непосредственно перед введением. Данная лекарственная форма представляет собой истинный водный стерильный раствор для инъекционного применения, в состав которого входит вещество списка Б. По дисперсологической классификации – свободнодисперсные системы с жидкой дисперсионной средой и максимально измельченной дисперсной фазой (гомогенная система) – раствор. 5. Проверка доз веществ списка А и Б и норм одноразового отпуска. Кофеин – бензоат натрия – сп.Б В.р.д. под кожу 0,4 В.с.д. под кожу 1,0 В 2 мл 20% раствора содержится 0,4 кофеина бензоата натрия. Р.д. – 0,4 С.д. – 0,4 ? 2 = 0,8 -Дозы не завышены. Веществ, имеющих нормы одноразового отпуска, в прописи нет. 6. Паспорт письменного контроля.  7. Технология лекарственной формы с теоретическим обоснованием. Рабочее место оборудуется и подготавливается в соответствии с требованиями приказа МЗ РФ № 309 от 21.10.97г. Изготовление раствора ведут в соответствии с требованиями общей статьи ГФ ХI «Инъекционные лекарственные формы», а также в соответствии с приказом МЗ РФ № 308 от 97г., приказом МЗ РФ № 214 от 16.07.97г. В рецепте прописан раствор для подкожного введения, в состав которого входит вещество легко растворимое в воде и являющееся солью сильного основания и слабой кислотой. Инъекционные растворы кофеина бензоата натрия нуждаются в стабилизации 0,1 М раствором едкого натрия, т.к. для подавления гидролиза подобных растворов солей необходимо добавлять щелочь. При расчете количества воды для инъекций необходимо учитывать, что концентрация кофеина бензоата натрия превышает 3% и согласно приказа МЗ ЗФ № 308 от 97г. необходимо учитывать коэффициент увеличения объема. В асептических условиях в стерильной подставке в 21,65 мл воды для инъекций растворяют 5,0 г кофеина бензоата натрия (сорта х.ч.), добавляют 0,1 мл 0,1 М раствора едкого натра. Приготовленный раствор фильтруют в склянку для отпуска емкостью 30мл из нейтрального стекла через двойной стерильный беззольный фильтр с подложенным комочком длинноволокнистой ваты. Флакон укупоривают стерильной резиновой пробкой, обкатывают металлическим колпачком, маркеруют. Проверяют раствор на прозрачность, отсутствие механических включений, цветность. Затем раствор стерилизуют в автоклаве при температуре 120°С 8 минут. После стерилизации и охлаждения раствор передают на контроль повторно. |
