Окисление. Федеральное агентство по образованию
 Скачать 1.34 Mb. Скачать 1.34 Mb.
|
|
3.5. АЛЛИЛЬНОЕ ОКИСЛЕНИЕ АЛКЕНОВ При обработке алкенов диоксидом селена в уксусном ангидриде или смеси последнего с уксусной кислотой образуются аллиловые спирты, которые тотчас же ацилируются уксусным ангидридом и реакция на этом заканчивается: 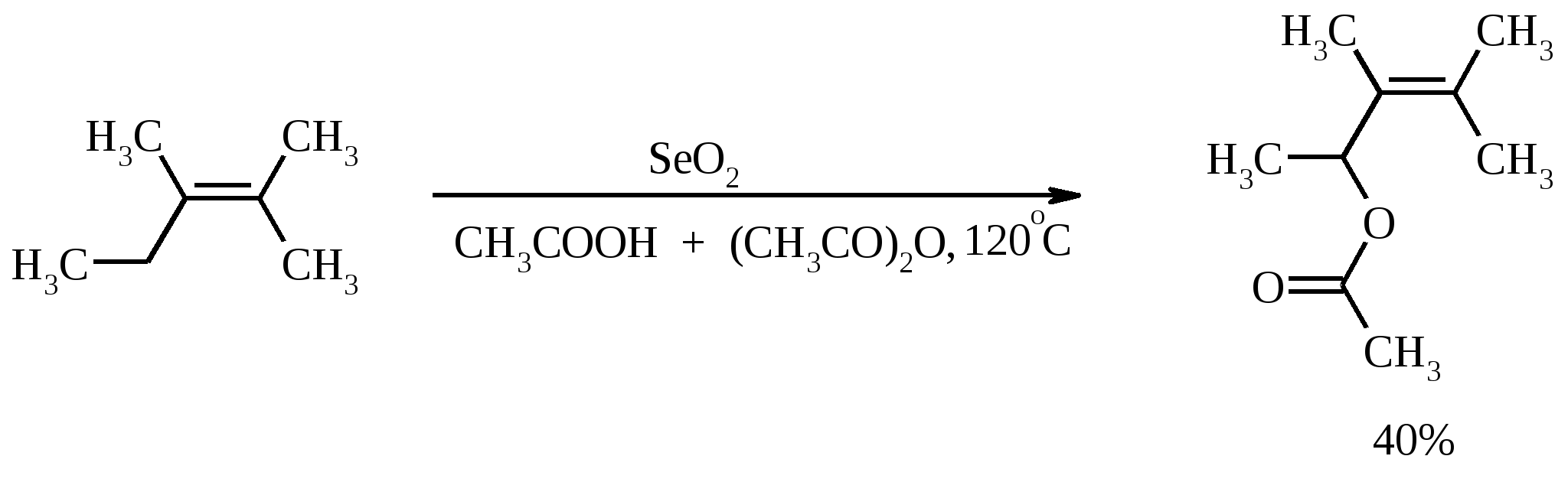 Окисление можно проводить эфирами надкислот (обычно трет-бутиловыми эфирами надбензойной и надуксусной кислот) в присутствии солей Cu(I).  Возможно аллильное окисление алкенов и кислородом воздуха в присутствии оксида меди (промышленный способ синтеза акролеина):  Как и в случае алканов первичным продуктом окисления здесь является гидропероксид. При действии на пропилен кислорода и аммиака протекает так называемый окислительный аммонолиз и образуется акрилонитрил: Хотя выход акрилонитрила в этом случае не превышает 70%, окислительный аммонолиз пропилена представляет собой самый дешевый и безопасный способ производства акрилонитрила. Катализатором этого процесса служит фосфомолибдат висмута. Аналогичным образом может быть получен бензонитрил из толуола. 4. ОКИСЛЕНИЕ АЛКИНОВ В мягких условиях алкины окисляются до 1,2-дикарбонильных соединений:  В большинстве же случаев окисление сопровождается расщеплением тройной связи и образованием карбоновых кислот: 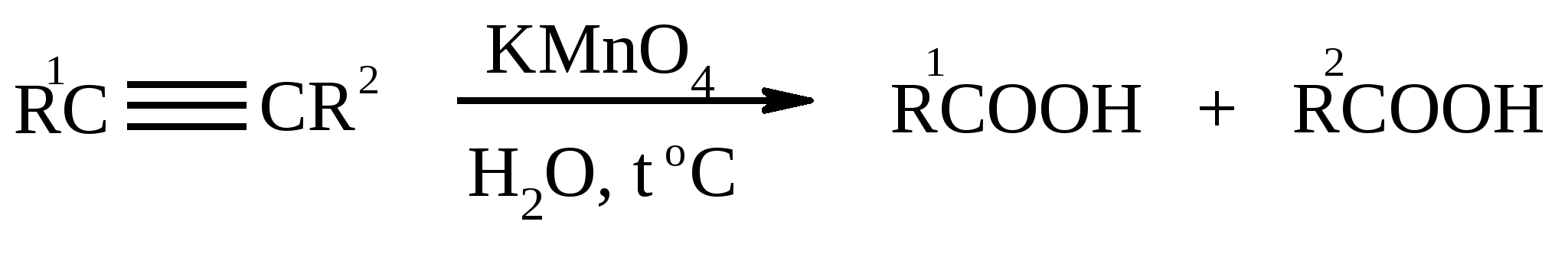 Озонолиз алкинов также протекает с расщеплением тройной углерод-углеродной связи: 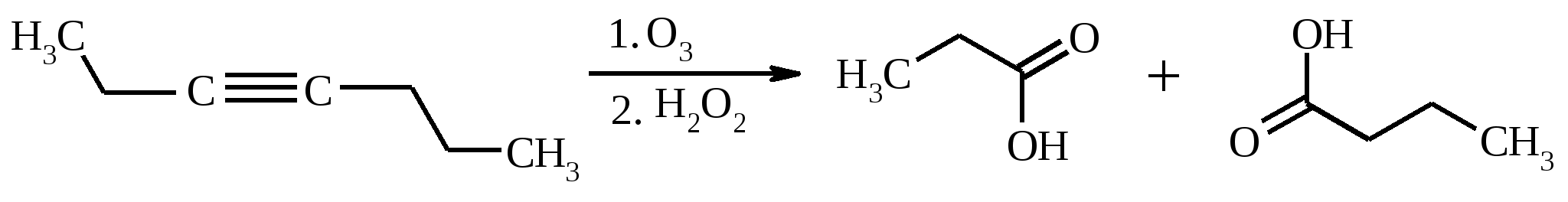 Под действием кислорода воздуха в спирте, пиридине и др. растворителях или гексацианоферрата (III) калия K3[Fe(CN)6] в диметоксиэтане или ДМФА ацетилениды меди (I) окисляются в 1,3-диины (реакция Глазера):  Эглинтон предложил значительно более удобную модификацию окислительной конденсации алкинов. Алкин-1 окисляют ацетатом меди (I) в растворе пиридина при 60-70С. Для получения несимметричных диинов используют конденсацию галогенацетиленов с алкином-1 в присутствии солей меди (I) и первичного амина (сочетание по Кадио-Ходкевичу): 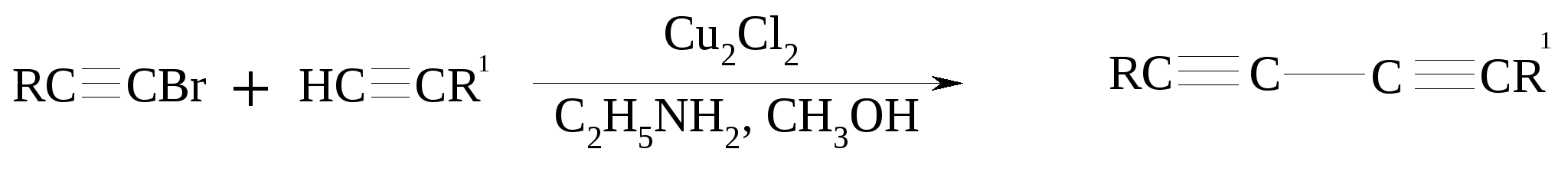 5. ОКИСЛЕНИЕ АРОМАТИЧЕСКОГО КОЛЬЦА Ароматические системы довольно устойчивы к действию окислителей. Обычно для окисления ароматического ядра приходится или применять достаточно энергичные окислители, или предварительно активировать ядро введением электронодонорного заместителя. 5.1. ГИДРОКСИЛИРОВАНИЕ АРЕНОВ Бензол и его алкилпроизводные подвергаются окислительному электрофильному гидроксилированию в фенолы под действием пероксида водорода и органических перкислот в суперкислых средах: 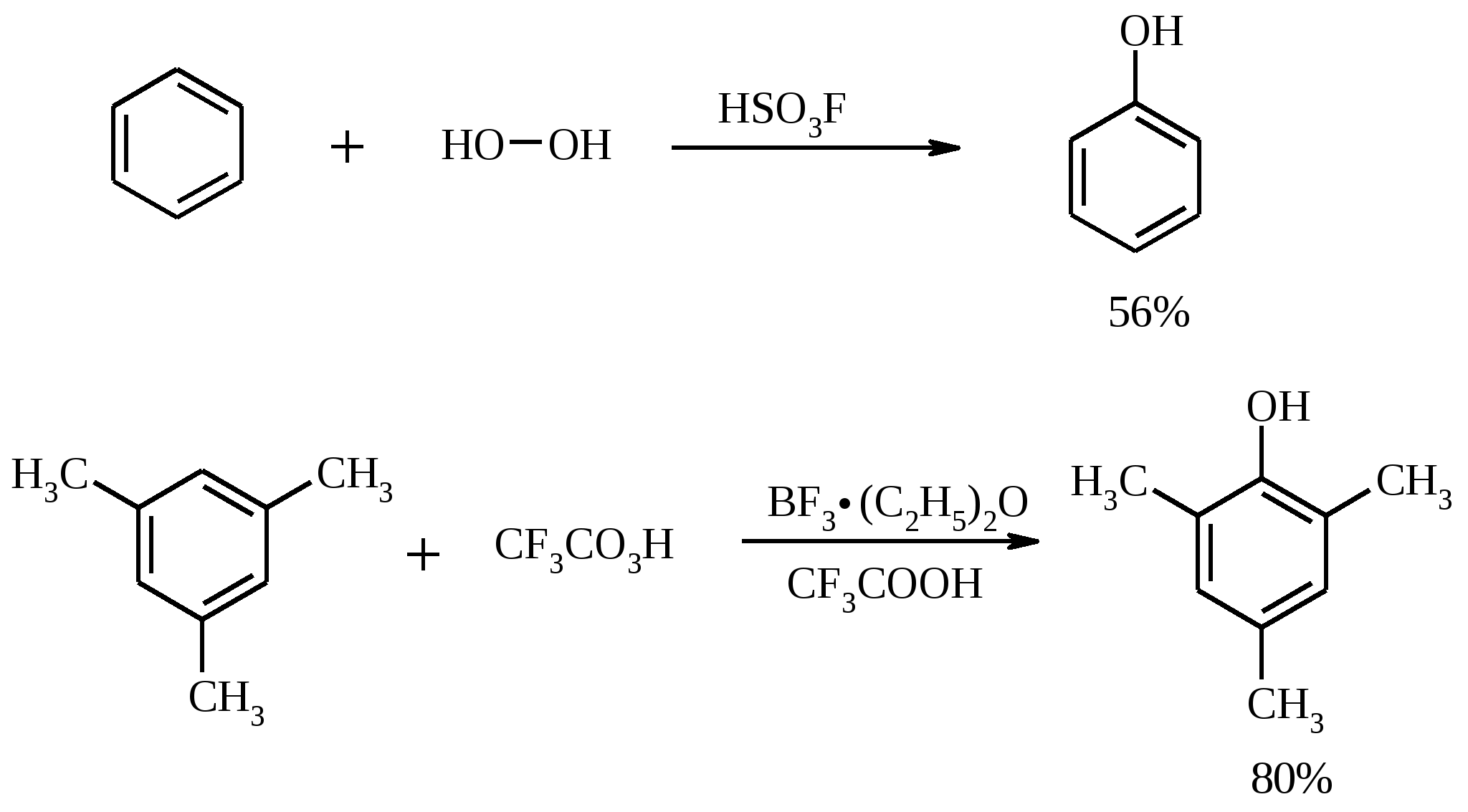 Бензол окисляется до фенола реактивом Фентона – пероксида водорода, содержащего соли Fe(II) и Fe(III). При этом в результате восстановления H2O2 одноэлектронным восстановителем – ионом железа (II) – образуется гидроксильный радикал, который далее присоединяется к бензолу с образованием гидроксилциклогексадиенильных радикалов. Окисление этих радикалов ионом Fe(III) приводит к получению фенола, а при димеризации радикалов образуется 1,1′,4,4′-тетрагидробифенил-4,4′-диол, который превращается в бифенил в результате дегидратации: 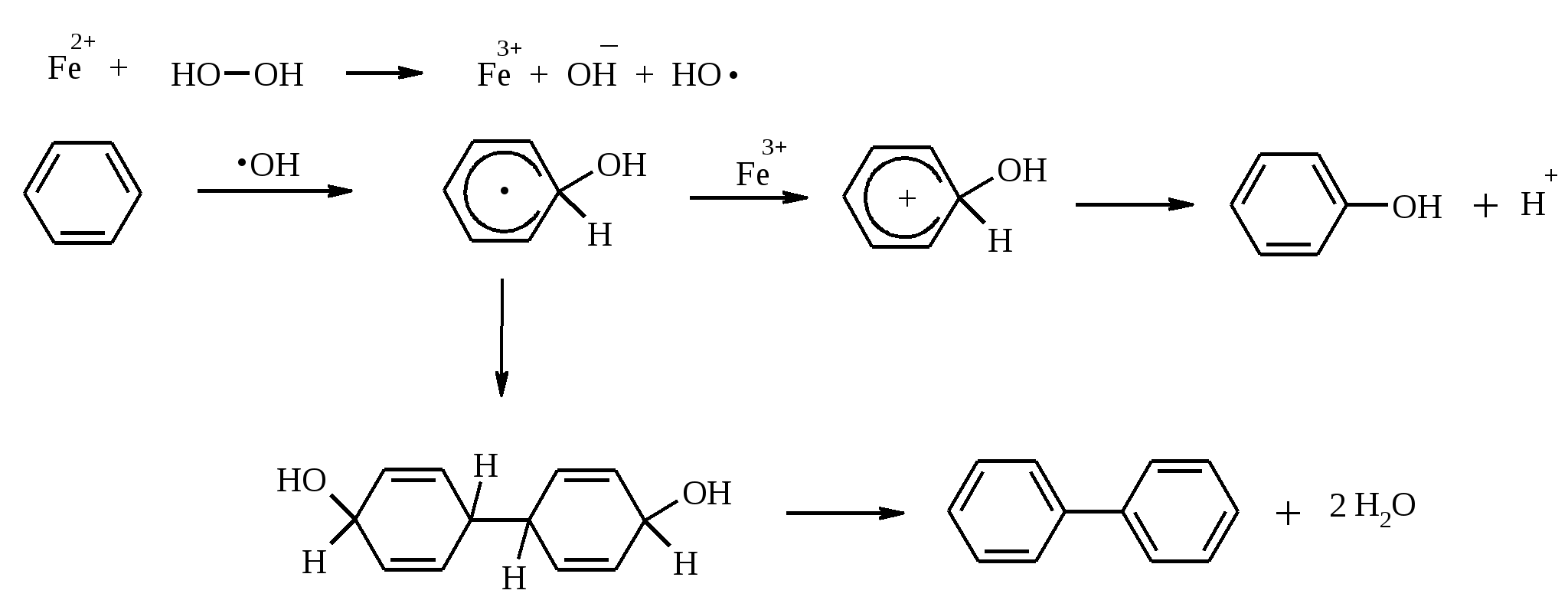 5.2. СИНТЕЗ ХИНОНОВ Сам бензол и алкилбензолы не удается окислить в хиноны с препаративными выходами. Фенолы и первичные амины легко вступают в эту реакцию, что связано с повышением нуклеофильности ароматического ядра под влиянием электронодонорных заместителей. Самый удобный способ получения хинонов заключается в окислении одноатомных фенолов солью Фреми – нитрозодисульфонатом калия. Эта реакция осуществляется в исключительно мягких условиях в водном спирте или ацетоне, выход обычно превышает 90%.  Приведенный на этой схеме циклогексадиеновый интермедиат был выделен, что доказывает механизм одноэлектронного окисления фенолов солью Фреми. Незамещенный n-бензохинон кроме того получают окислением гидрохинона или анилина. В качестве окислителей используются бромат калия, хлорат натрия, дихромат калия или натрия, диоксид свинца и др. В случае анилина реакция идет через стадию образования фенилгидроксиламина, который в кислой среде перегруппировывается в n-аминофенол и затем – в монохинонимин, гидролизующийся далее в хинон: 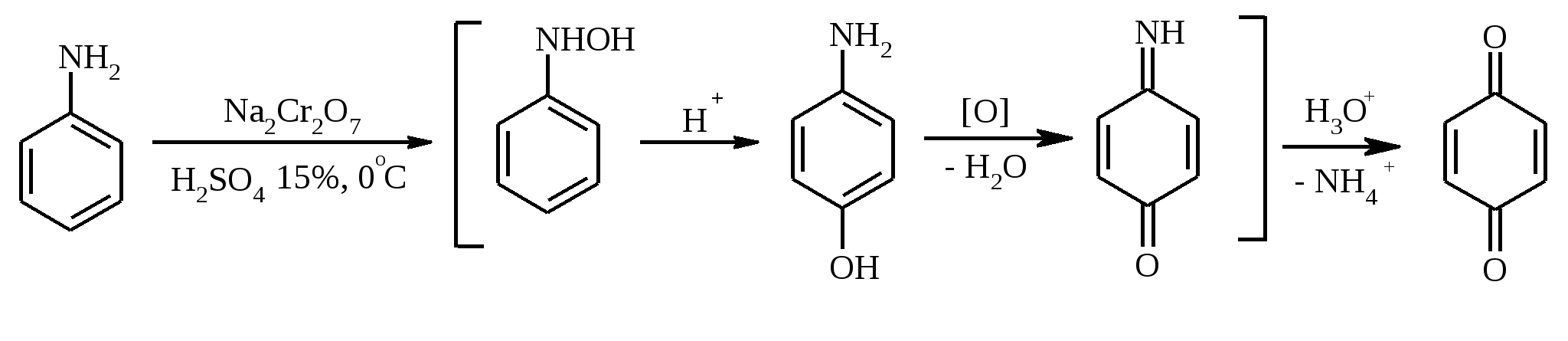 В случае окисления гидрохинона процесс протекает через промежуточное образование хингидрона – молекулярного соединения, в котором оба фрагмента образуют структуру сэндвичевого типа и связаны переносом заряда и водородными связями. 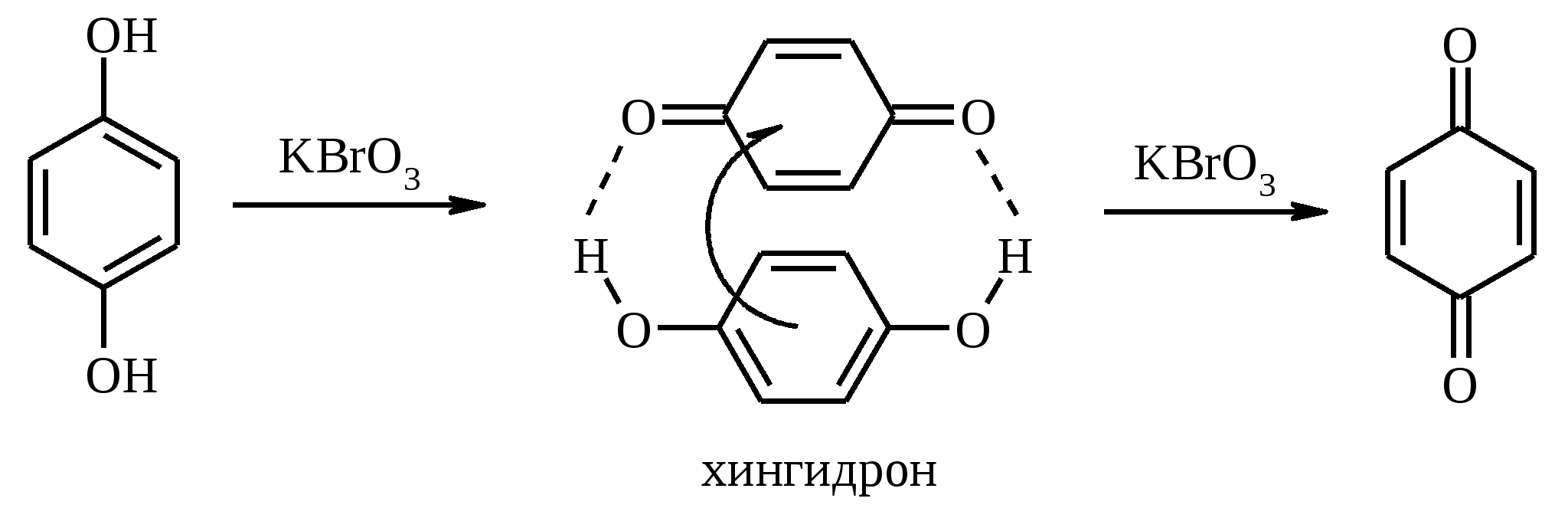 Ди- и полиалкил-n-бензохиноны обычно синтезируют, используя более мягкие окислители – соли Fe(III):  o-Бензохиноны вследствие неустойчивости получают окислением соответствующих пирокатехинов свежеприготовленным оксидом серебра или диоксидом свинца в инертном растворителе (часто в эфире).  Для получения хинонов, содержащих электроноакцепторные заместители, применяют более жесткие окислители, например HNO3.  Конденсированные ароматические системы окисляются до хинонов значительно легче бензола. Так нафталин окисляется в 1,4-нафтохинон CrO3 в уксусной кислоте:  Алкил- и арилнафталины легко окисляются по замещенному ароматическому кольцу:  Хорошие результаты, как и в ряду бензола, дает окисление гидрокси- и аминопроизводных:  Ядро антрацена окисляется еще легче нафталинового:  В промышленности тот же самый результат достигается при окислении кислородом в присутствии оксида ванадия (V) как катализатора. Таким способом можно получать антрахинон и фенантренхинон: 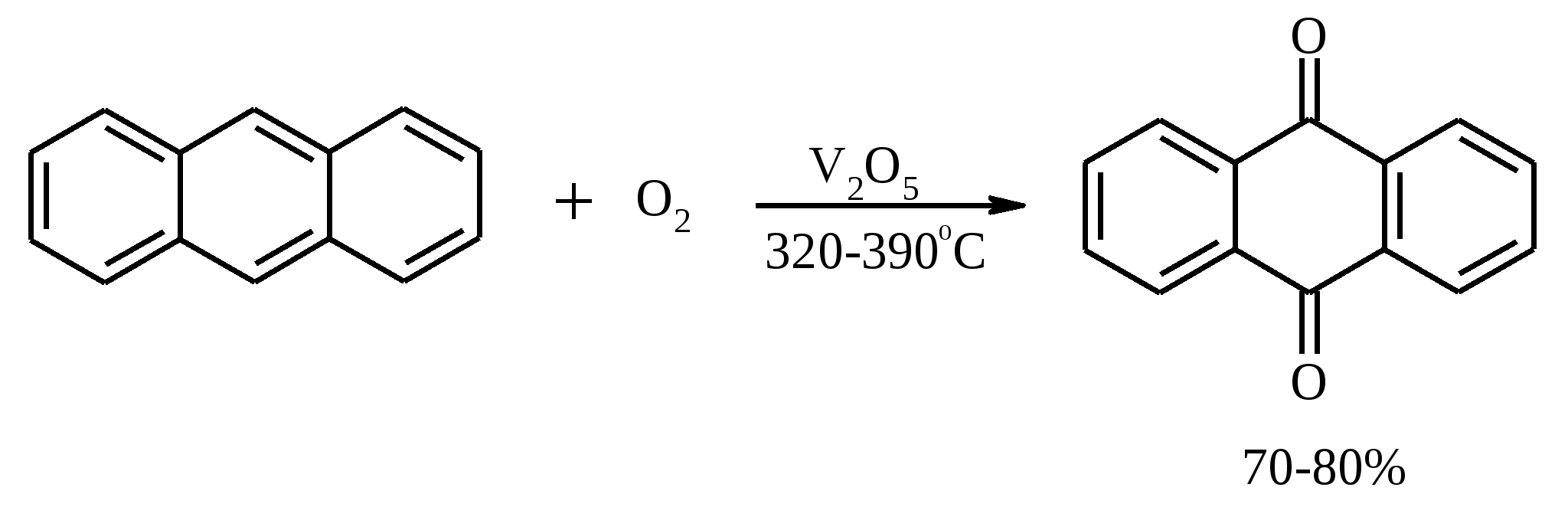 5.3. ОКИСЛИТЕЛЬНОЕ РАСЩЕПЛЕНИЕ АРЕНОВ В промышленности окислением бензола и нафталина кислородом воздуха в присутствии V2O5 получают соответственно малеиновый и фталевый ангидриды:  При взаимодействии бензола и алкилбензолов с озоном образуются триозониды, которые далее подвергают окислительному или воcстановительному расщеплению:  Препаративное значение имеет также окисление нафталина KMnO4, приводящее к о-формилбензойной кислоте.  В замещенных нафталинах действие окислителя направляется на кольцо с большей электронной плотностью.  5.4. ОКИСЛЕНИЕ БОКОВЫХ ЦЕПЕЙ В АРОМАТИЧЕСКИХ СОЕДИНЕНИЯХ Окисление алкиларенов происходит в первую очередь по бензильному атому углерода, что объясняется легкостью образования соответствующего бензильного радикала. 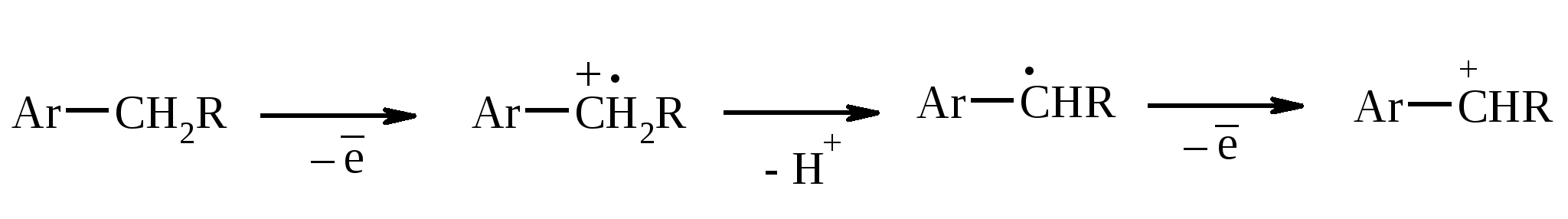 Для окисления боковых цепей в алкилбензолах в карбоксильную группу применяют водный раствор KMnO4 при нагревании, смесь Na2Cr2O7 и H2SO4.  Следует особо отметить, что в этих условиях любая алкильная группа, содержащая атомы водорода в положении по отношению к бензольному кольцу, окисляется до карбоксильной. Если алкильная группа не содержит атомов водорода в положении по отношению к бензольному кольцу, такая трет-алкильная боковая группа не окисляется под действием Na2Cr2O7 или KMnO4 в кислой или нейтральной среде. Так, например, трет-бутилбензол окисляется в очень жестких условиях перманганатом калия до триметилуксусной кислоты, т. е. окисляется само бензольное кольцо:  Однако водная азотная кислота окисляет трет-алкильные группы до карбоксильных. Дихромат натрия и перманганат калия нерастворимы в ароматических углеводородах, поэтому окисление идет в гетерогенных условиях, что часто резко снижает выход продуктов окисления. Этого недостатка лишен метод межфазного переноса реагентов. Твердый перманганат калия частично растворяется в бензоле в присутствии 18-краун-6-полиэфира вплоть до концентрации 0.06 М. Такой раствор носит название "пурпурный (малиновый) бензол" и широко используется для окисления алкилбензолов: 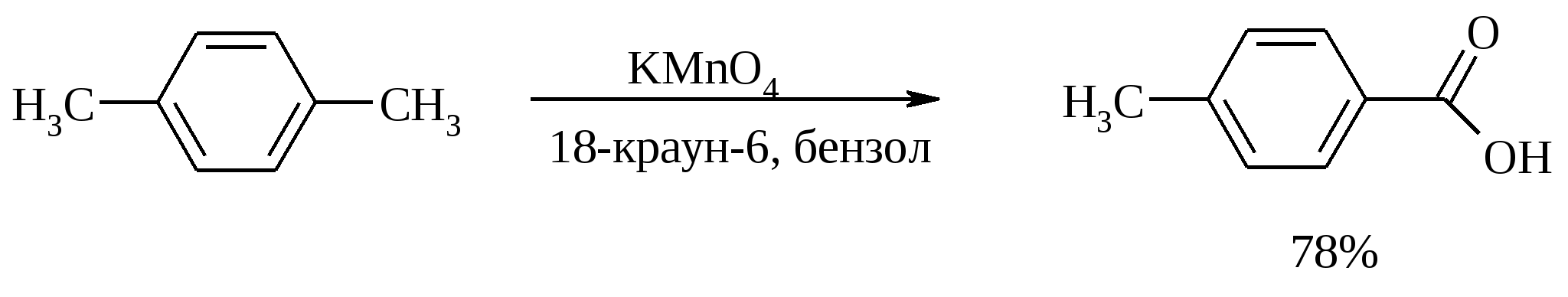 При использовании же в качестве катализатора межфазного переноса бромида тетрабутиламмония практически весь (95%) перманганат-ион находится в органической фазе. При синтезе аминобензойных кислот из алкиланилинов, содержащих первичную аминогруппу, используют ацильную защиту:  Алкильную группу в алкилнафталинах можно окислить до карбоксильной, не затронув при этом нафталиновые ядра, если использовать в качестве окислителя нейтральный водный раствор дихромата натрия и проводить реакцию при высоких температурах в автоклаве:  Для окисления метилбензолов в альдегиды используют смесь хромового и уксусного ангидридов. При этом образующийся альдегид превращается в ацилаль, который далее не окисляется. Омылением этого производного серной кислотой получают сам альдегид. Орто-замещенные бензальдегиды получаются таким путем с низкими выходами.  Другой способ превращения метилзамещенных бензолов в бензальдегиды состоит в их обработке хлористым хромилом в CCl4 или CS2 (реакция Этара). Вначале окисляемое вещество образует комплекс с двумя молекулами CrO2Cl2, который выпадает в осадок. При обработке комплекса водой образуется альдегид.  Данный метод дает возможность окислять только одну метильную группу в присутствии других:  Окисление метиленового звена в алкилбензолах с образованием кетонов можно провести под действием ряда окислителей (разб. HNO3, SeO2, Na2Cr2O7 и др.). Особенно легко окисляются диарилметаны: 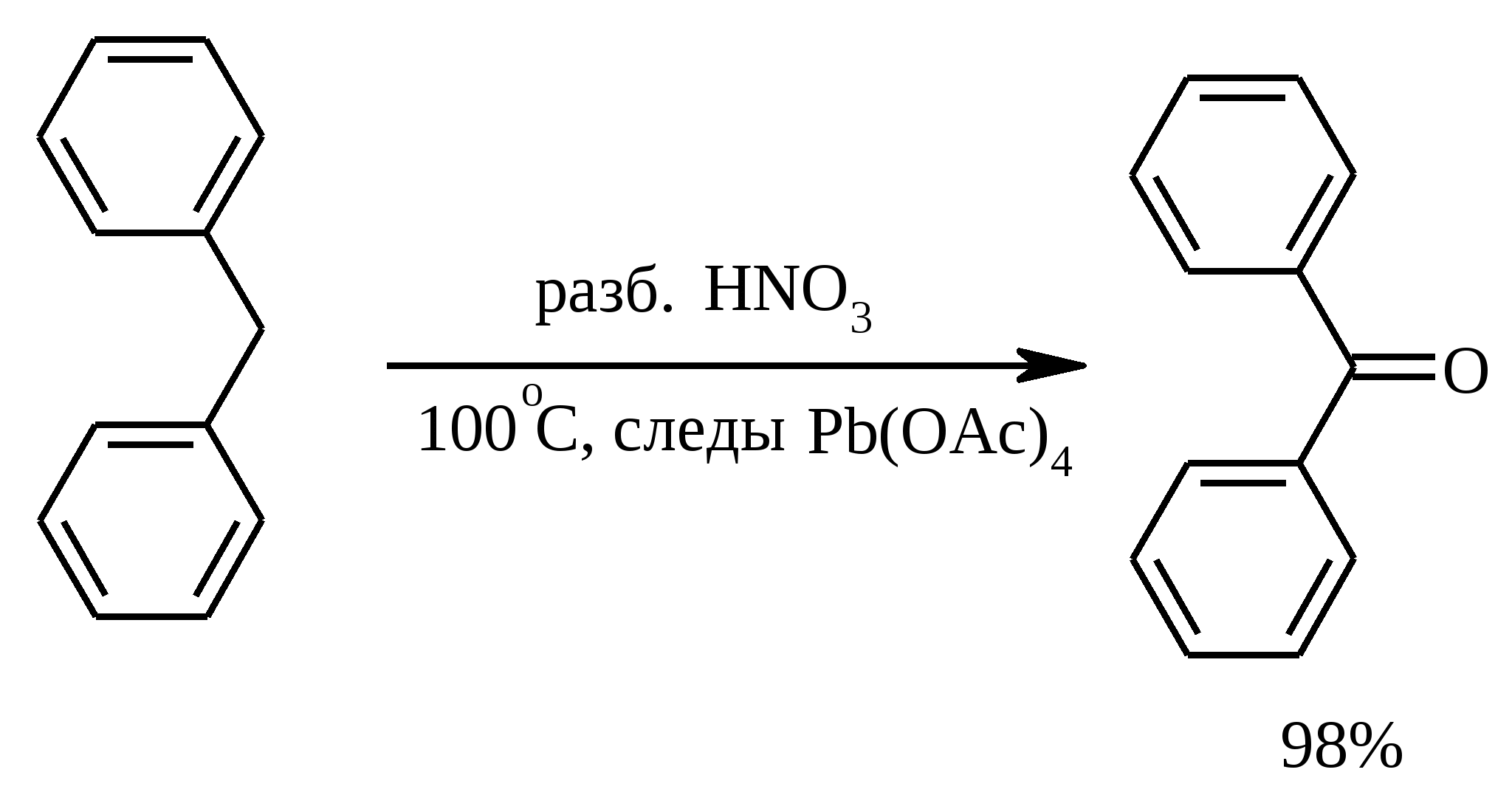 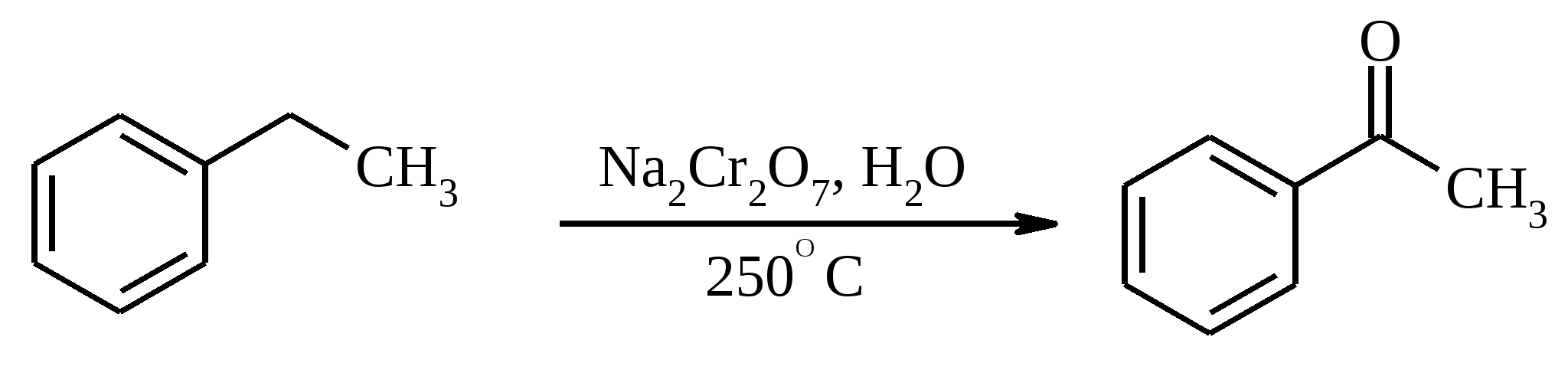 Окисление жирноароматических соединений можно осуществлять таким образом, чтобы окислению кислородом воздуха подвергался карбанион, который образуется при депротонировании исходной СН-кислоты в инертной апротонной среде (ТГФ, диметоксиэтане). Жирноароматических соединений с pKa ниже 33-35 можно окислить в системе КОН - 18-краун-6 - ТГФ до ароматических кислот, кетонов и триарилкарбинолов: 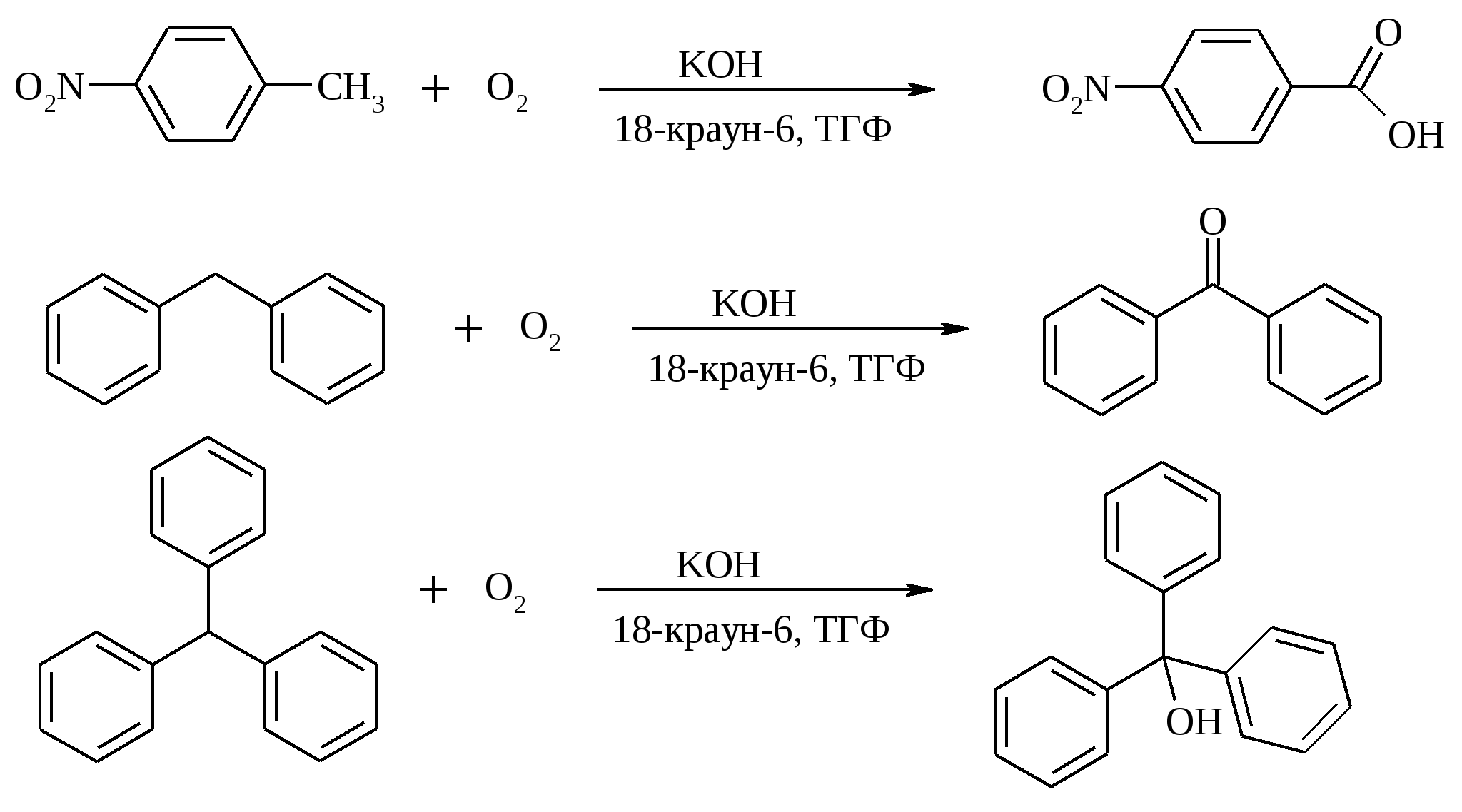 Окисление кумола в гидропероксид с последующим разложением его серной кислотой приводит к образованию ацетона и фенола:  Аналогично из индана и тетралина можно получить соответствующие кетоны:  Важнейшее промышленное значение имеют реакции прямого окисления о- и n-ксилолов кислородом воздуха до фталевой и терефталевой кислот соответственно в присутствии ацетата кобальта (III) в уксуснокислом растворе: 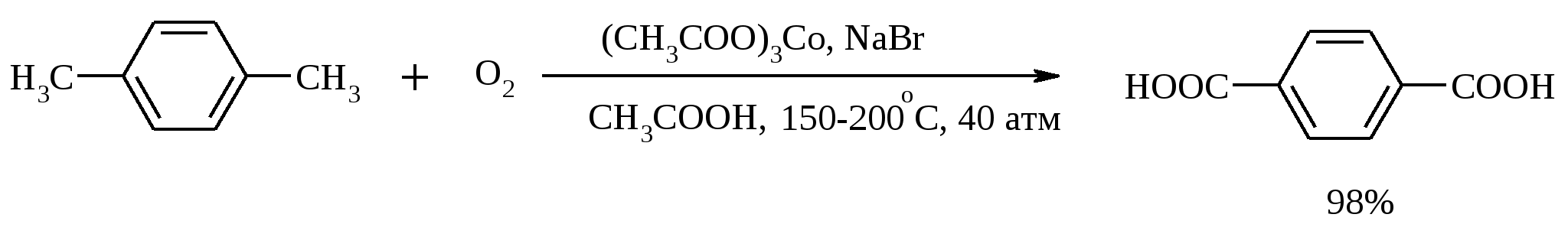 Введение ацетоксигруппы в бензильное положение алкилбензолов обычно осуществляют с помощью тетраацетата свинца. Реакцию проводят кипячением смеси реагентов в бензоле или ледяной уксусной кислоте. Процесс протекает по свободнорадикальному механизму:  Соответствующие спирты получают последующим омылением ацетатов. 5.5. ОКИСЛИТЕЛЬНОЕ СОЧЕТАНИЕ ФЕНОЛОВ Под действием одноэлектронных окислителей (гексацианоферрата (III) калия K3[Fe(CN)6], PbO2, FeCl3, Ag2O, соли Фреми, пероксодисульфата калия K2S2O8 и др.) фенолы окисляются в производные дигидроксидифенила или гидроксидифенилового эфира. 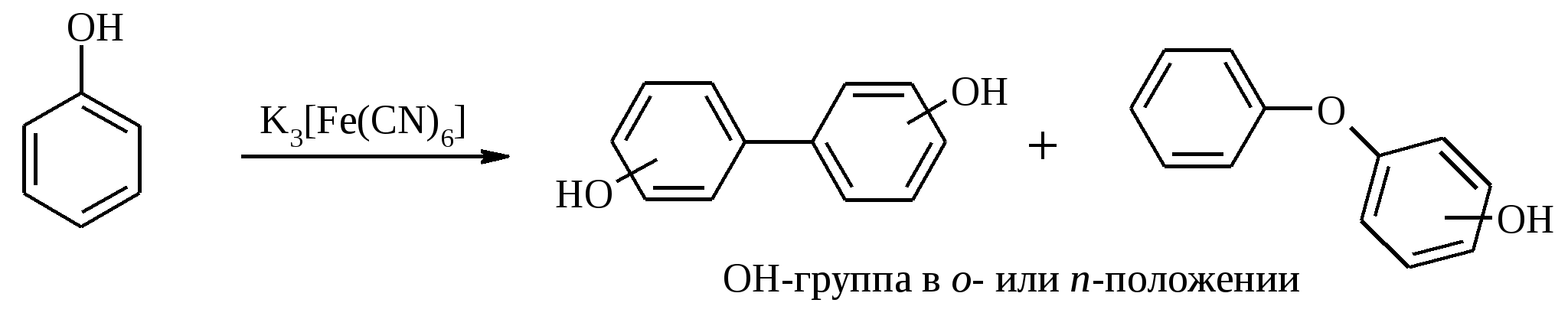 При этом сначала образуются феноксильные радикалы, которые далее подвергаются димеризации в результате образования новых связей С–С между орто-орто, орто-пара и пара-пара-положениями исходных радикалов, а также новых С–О связей между атомом кислорода одного радикала и орто-положением другой радикальной частицы. Всего, таким образом, образуется потенциально не менее пяти различных типов димеров, которые находятся в равновесии с исходным феноксильным радикалом. Далее димеры обычно изомеризуются в производные дигидроксидифенила или гидроксидифенилового эфира. 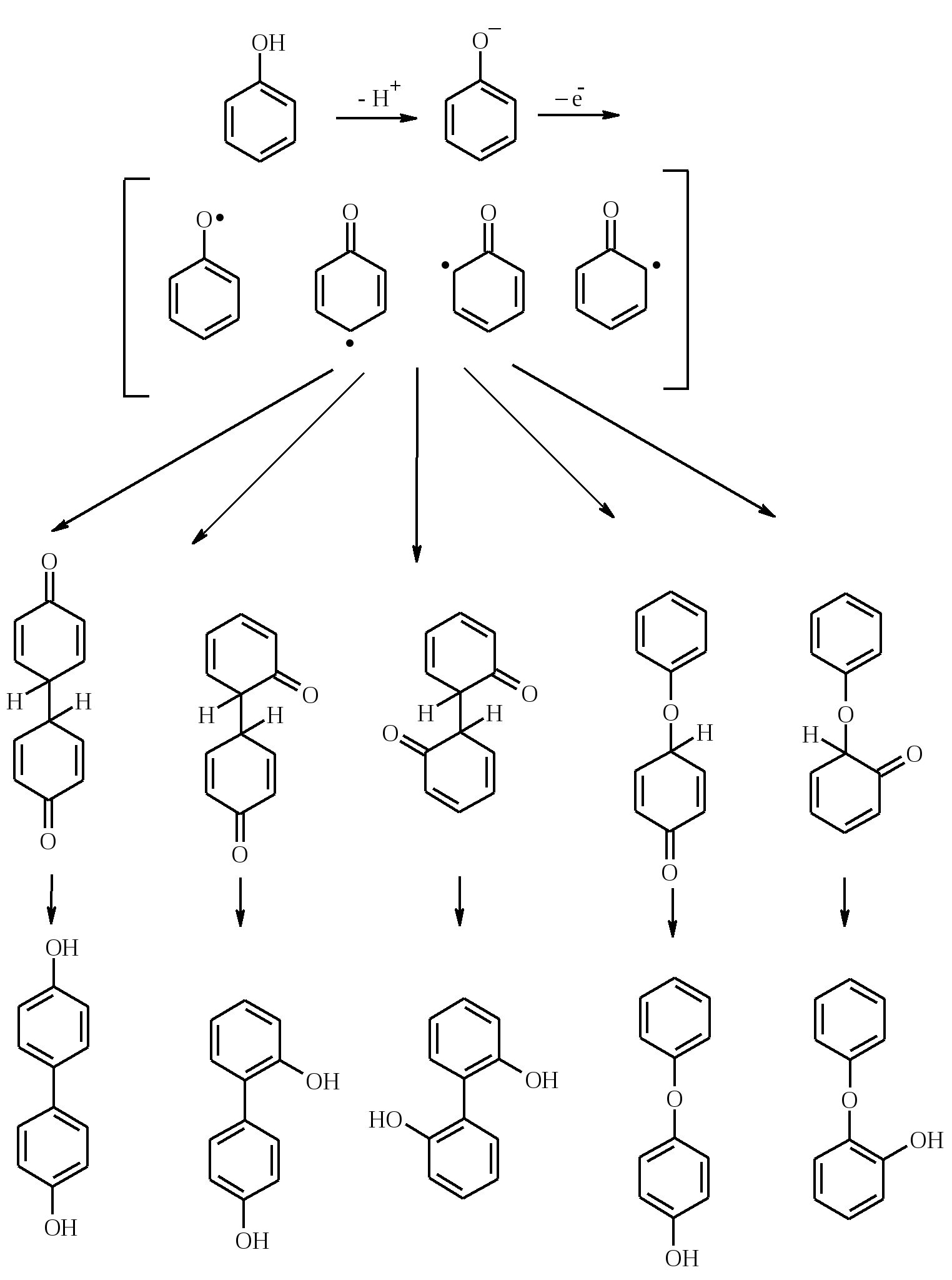 Выходы индивидуальных продуктов при окислительном сочетании фенолов сильно зависят от условий проведения реакции и природы исходных реагентов. Данный процесс имеет большое биологическое значение при биосинтезе лигнина и ряда алкалоидов. 5.6. ОКИСЛЕНИЕ ОДНОАТОМНЫХ ФЕНОЛОВ В ДВУХАТОМНЫЕ Фенолы окисляются в n-дифенолы обработкой щелочным раствором пероксодисульфата калия (реакция Элбса). Реакция протекает через промежуточное образование гидроксифенилсульфата калия, который затем в кислой среде гидролизуется до дифенола: 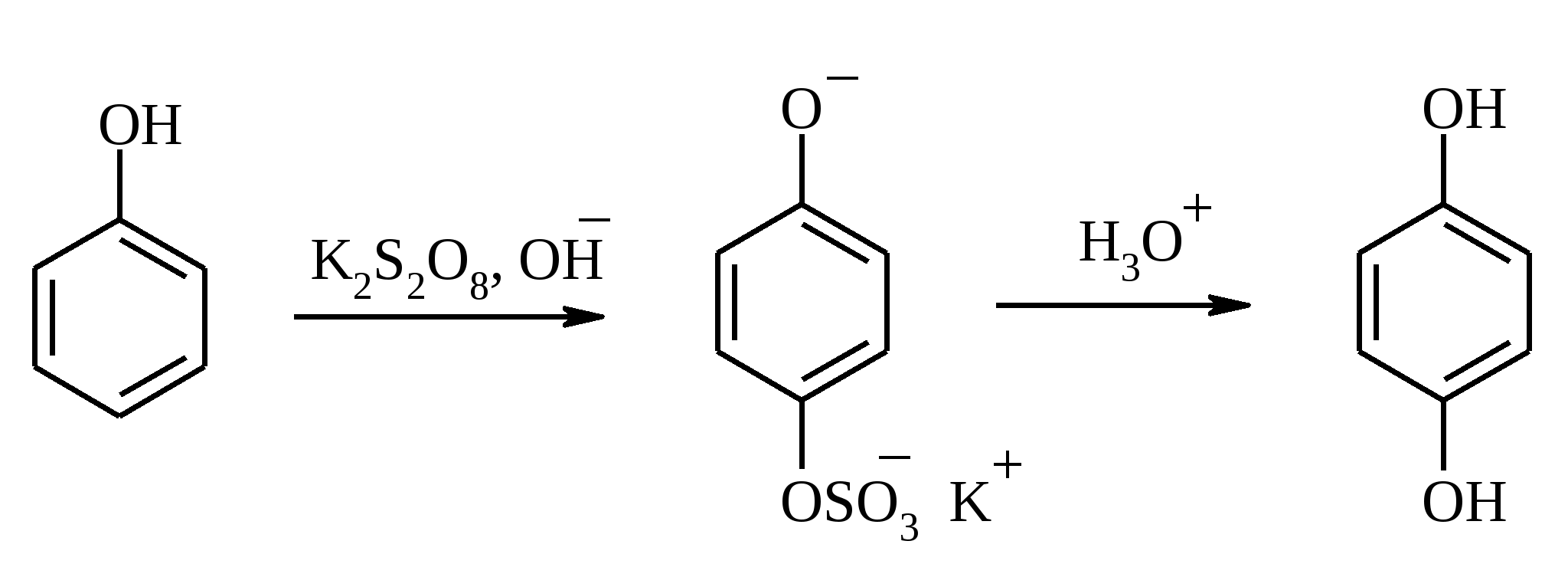 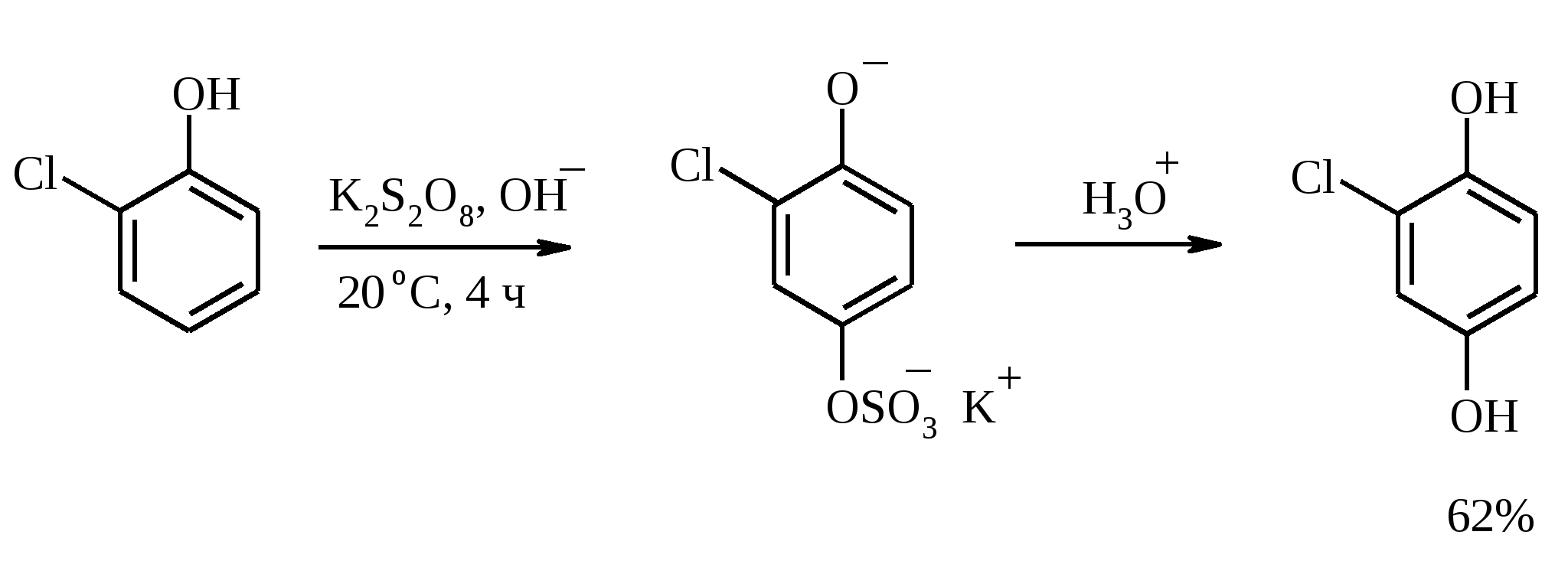 Если пара-положение в исходном феноле уже занято, то реакция протекает по орто-положению, однако с меньшим выходом. 6. ОКИСЛЕНИЕ ГАЛОГЕНПРОИЗВОДНЫХ УГЛЕВОДОРОДОВ Первичные алкилгалогениды (хлориды, бромиды, иодиды) легко окисляются в альдегиды диметилсульфоксидом (реакция Корнблюма):  Бензилгалогениды можно окислить в альдегиды, вводя их в реакцию с избытком гексаметилентетрамина (уротропина) с последующим гидролизом промежуточно образующейся четвертичной соли (реакция Соммле):  Разновидностью этой реакции можно считать получение ароматических альдегидов из четвертичных солей, образующихся из бензилгалогенидов и пиридина. Эта соль при конденсации с n-нитрозодиметиланилином, катализируемой основанием, дает интермедиат, гидролиз которого в кислой среде приводит к альдегиду:  Бензилгалогениды можно окислить в ароматические альдегиды и с помощью солей 2-нитропропана. Ароматические галогенметильные производные алкилируют амбидентный анион 2-нитропропана по атому кислорода:  Этот метод является общим способом получения ароматических альдегидов, содержащих самые разнообразные заместители в бензольном кольце. Исключение составляют лишь n-нитробензильные производные, алкилирующие анион 2-нитропропана по атому углерода. |
