Окисление. Федеральное агентство по образованию
 Скачать 1.34 Mb. Скачать 1.34 Mb.
|
|
Иодная кислота и ее соли HIO4·2H2O представляет собой бесцветные сильно гигроскопичные кристаллы, хорошо растворимые в воде, растворимые в этаноле и мало растворимые в диэтиловом эфире. Выше температуры плавления (122ºС) кислота разлагается. Водный раствор на воздухе желтеет и сильно пахнет озоном. Окисление обычно ведут в водных растворах или в растворе метанола, диоксана или уксусной кислоты. Иодную кислоту, а также ее соли периодат калия KIO4 и натрия NaIO4 применяют в основном для окисления 1,2-диолов в соответствующие карбонильные соединения. Диоксид селена SeO2 представляет собой белое кристаллической вещество; на воздухе, соприкасаясь с пылью, окрашивается в красноватый цвет вследствие восстановления до металлического селена, гигроскопичен, выше 300ºС возгоняется. Диоксид селена обладает избирательностью окислительного действия. SeO2 растворим в органических растворителях и окисление проводят обычно в водном спирте или водном диоксане. SeO2 = Se + 2 [O] Окисление сопровождается выделением из реакционной массы красноватого осадка селена. Диоксид селена избирательно окисляет активированные метильные и метиленовые группы, находящиеся по соседству с карбонильной группой или двойной связью. Пероксид водорода Пероксид водорода – бесцветная жидкость, cмешивается с водой, этанолом и диэтиловым эфиром. 30%-ный раствор H2O2 называется пергидролем. Высококонцентрированный препарат может реагировать с органическими веществами со взрывом. При хранении разлагается на кислород и воду. Стойкость пероксида водорода возрастает с разбавлением. Для окисления применяют водные растворы различной концентрации (от 3 до 90%) в нейтральной, кислой или щелочной средах. H2O2 = H2O + [O] Действием этого реагента на α,β-непредельные карбонильные соединения в щелочной среде получают соответствующие эпоксиальдегиды и кетоны, окислением карбоновых кислот в кислой среде синтезируют надкислоты. 30%-ный раствор H2O2 в уксусной кислоте окисляет алкены в 1,2-диолы. Оксид серебра Оксид серебра (I) получают из нитрата серебра и раствора гидроксида натрия, выделившийся осадок часто затем растворяют в избытке аммиака и получают аммиачный комплекс [Ag(NH3)2]OH, растворимый в воде (реактив Толленса). Аммиачный раствор оксида серебра нельзя долго хранить, так как при стоянии образуется взрывчатый нитрид серебра Ag3N. Окисление протекает по схеме: Ag2O = 2 Ag + [O] Раствор, приготовленный из 12 г AgNO3, 20 г NaOH и 52 мл 25%-ного аммиака, соответствует 0.564 г активного кислорода. Оксид серебра применяют для превращения в соответствующие карбоновые кислоты альдегидов, содержащих помимо карбонильных другие чувствительные к окислению группировки, а также для получения хинонов из многоатомных фенолов. Диоксид свинца Диоксид свинца PbO2 получают непосредственно перед применением действием хлорной извести на нитрат или ацетат свинца (II): Pb(NO3)2 + CaOCl2 + H2O = PbO2 + 2 HNO3 + CaCl2 Окисление проводят в слабокислой среде. Ароматические амины и двухатомные фенолы окисляются диоксидом свинца в соответствующие хиноны. Чаще всего реагент используют для окисления в бензиловые спирты ди- и триарилметанов. Диоксид марганца Диоксид марганца MnO2 представляет собой порошок черного цвета нерастворимый в воде. Используется в основном для селективного окисления аллиловых и пропаргиловых спиртов в альдегиды и кетоны в нейтральной среде, а также в реакциях дегидрирования и окисления азотсодержащих соединений. Тетраоксиды рутения и осмия Тетраоксид осмия OsO4 – порошок от белого до бледно-желтого цвета с т. пл. 40.6ºС; т. кип. 131.2ºС. Возгоняется уже при комнатной температуре, растворим в воде (7.47 г в 100 мл при 25ºС), ССl4 (250 г в 100 г растворителя при 20ºС). В присутствии органических соединений чернеет вследствие восстановления до OsO2. RuO4 представляет собой золотисто-желтые призмы с т. пл. 25.4ºС, заметно возгоняется при комнатной температуре. Умеренно растворим в воде (2.03 г в 100 мл при 20ºС), очень хорошо растворим в CCl4. Более сильный окислитель, чем OsO4. Выше 100ºС взрывается. Как и тетраоксид осмия обладает большой токсичностью и высокой стоимостью. Данные окислители применяются для окисления алкенов в α-гликоли в мягких условиях. Нитрат аммония-церия (IV) (NH4)2[Ce(NO3)6] представляет собой оранжево-красные кристаллы, хорошо растворимые в воде (58.5% при 25ºС) и этаноле. Используется для окисления замещенных толуолов в бензальдегиды. Диметилсульфоксид (ДМСО) Диметилсульфоксид (CH3)2SO – бесцветная гигроскопичная жидкость с т. пл. 18.5ºС и т. кип. 189ºС. При кипячении при атмосферном давлении постепенно диспропорционирует на диметилсульфид и диметилсульфон, поэтому перегоняют его в вакууме. ДМСО (в комбинации с различными электрофильными агентами) широко используется для окисления спиртов, алкилгалогенидов, оксиранов и др. Диоксираны Наиболее часто используются диметилдиоксиран и метил(трифторметил)-диоксиран. 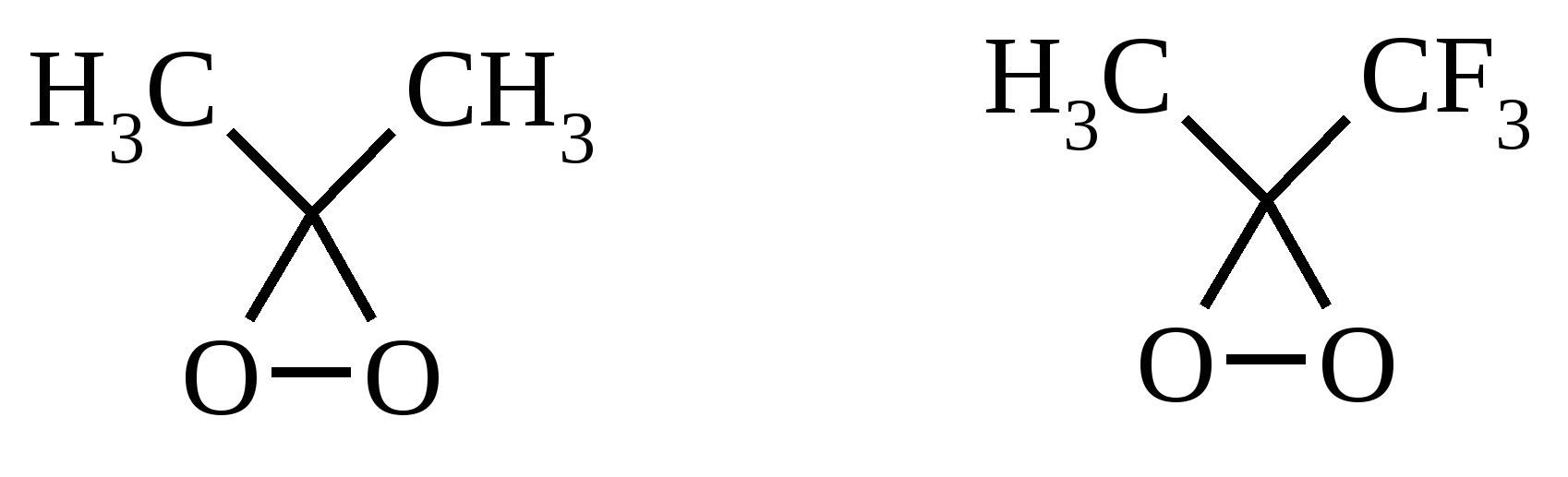 Диоксираны чаще всего получают insitu из соответствующих кетонов и KHSO5 (или K2SO4·KHSO4·2KHSO5 (оксона)) в слабощелочной среде: 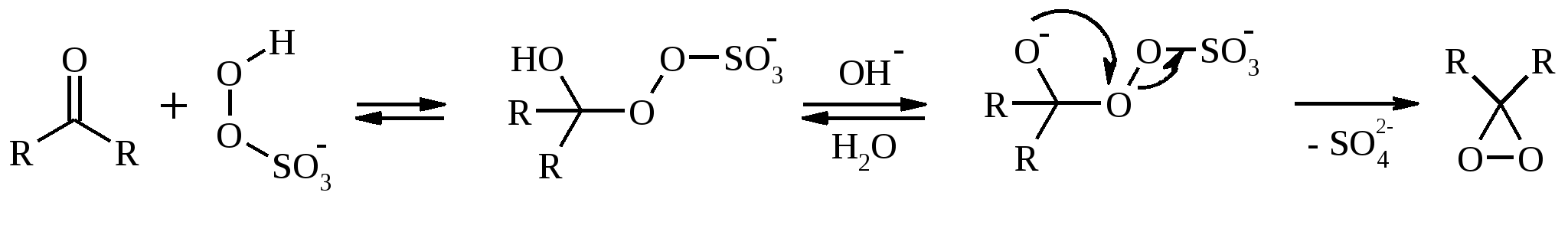 Диоксираны отличаются высокой реакционной способностью, сочетающейся с хорошей селективностью, и используются для окисления неактивированных С–Н-связей в алканах, при получении эпоксидов из алкенов, для окисления аминов, оксимов, сульфидов, сульфоксидов и др. Помимо вышеперечисленных окислителей в органическом синтезе используется и ряд других соединений: молекулярная сера, селен, хлоранил (2,3,5,6-тетрахлор-1,4-бензохинон), 2,3-дихлор-5,6-дициано-1,4-бензохинон (в реакциях дегидрирования), пероксид никеля NiO2, пероксид калия K2O2, пербораты, галогены, N-бромсукцинимид (NBS), соли ртути (II), меди (II) и железа (III), ацетат и нитрат таллия (III), висмутат натрия NaBiO3, Mn(CH3COO)3, Ag2CO3 на целите и др. 2. ОКИСЛЕНИЕ АЛКАНОВ И ЦИКЛОАЛКАНОВ Окисление алканов и циклоалканов протекает по радикальному механизму. Окисление проводят молекулярным кислородом в присутствии различных катализаторов (соли Mn, Co, Cr, Fe, V2O5 и др.). Первичными продуктами окисления являются гидропероксиды ROOH. Взаимодействие кислорода с молекулой алкана происходит по всем возможным направлениям, но преимущественно затрагивается третичный атом углерода. Окисление протекает по схеме: 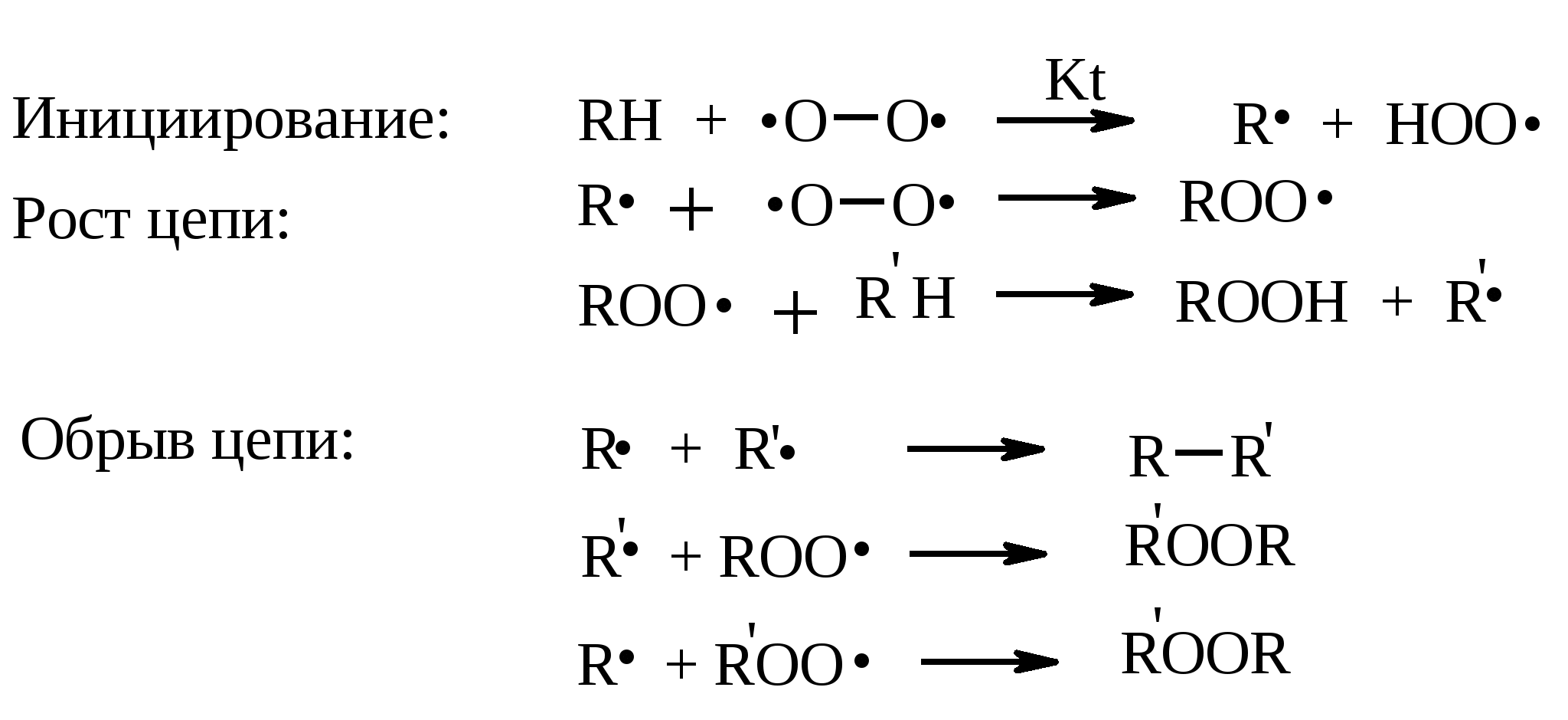 В условиях проведения процесса окисления гидропероксиды обычно подвергаются разложению, причем первоначально происходит разрыв наиболее слабой связи O–O. Разложение третичных гидропероксидов сопровождается отщеплением одного из радикалов и образованием кетонов: 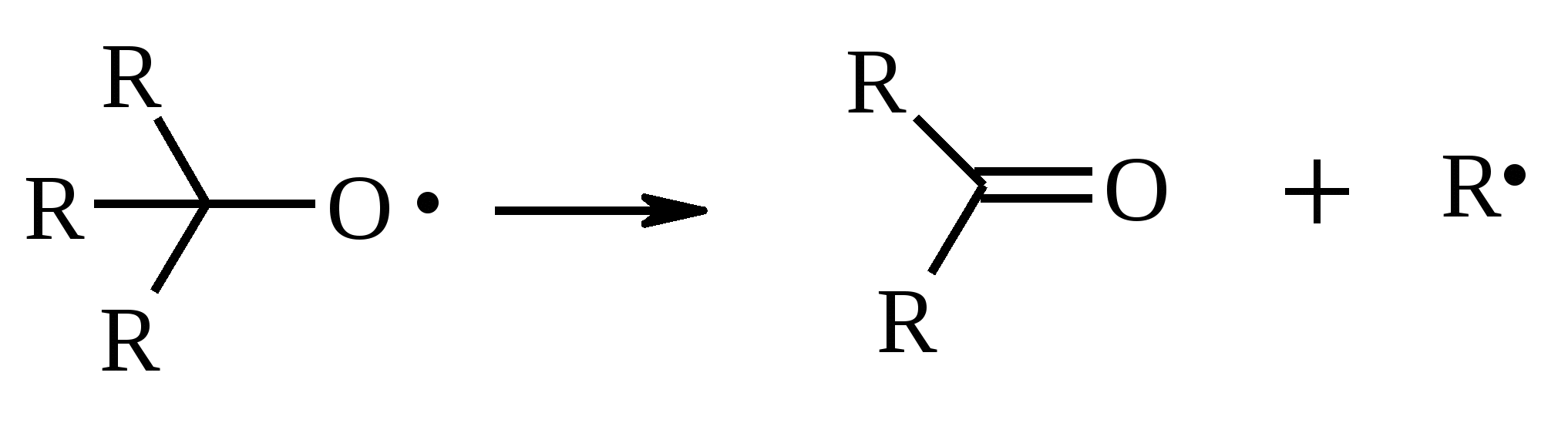 Разложение вторичных гидропероксидов зависит от температурных условий. При низкой температуре образуется смесь альдегида и кетона: 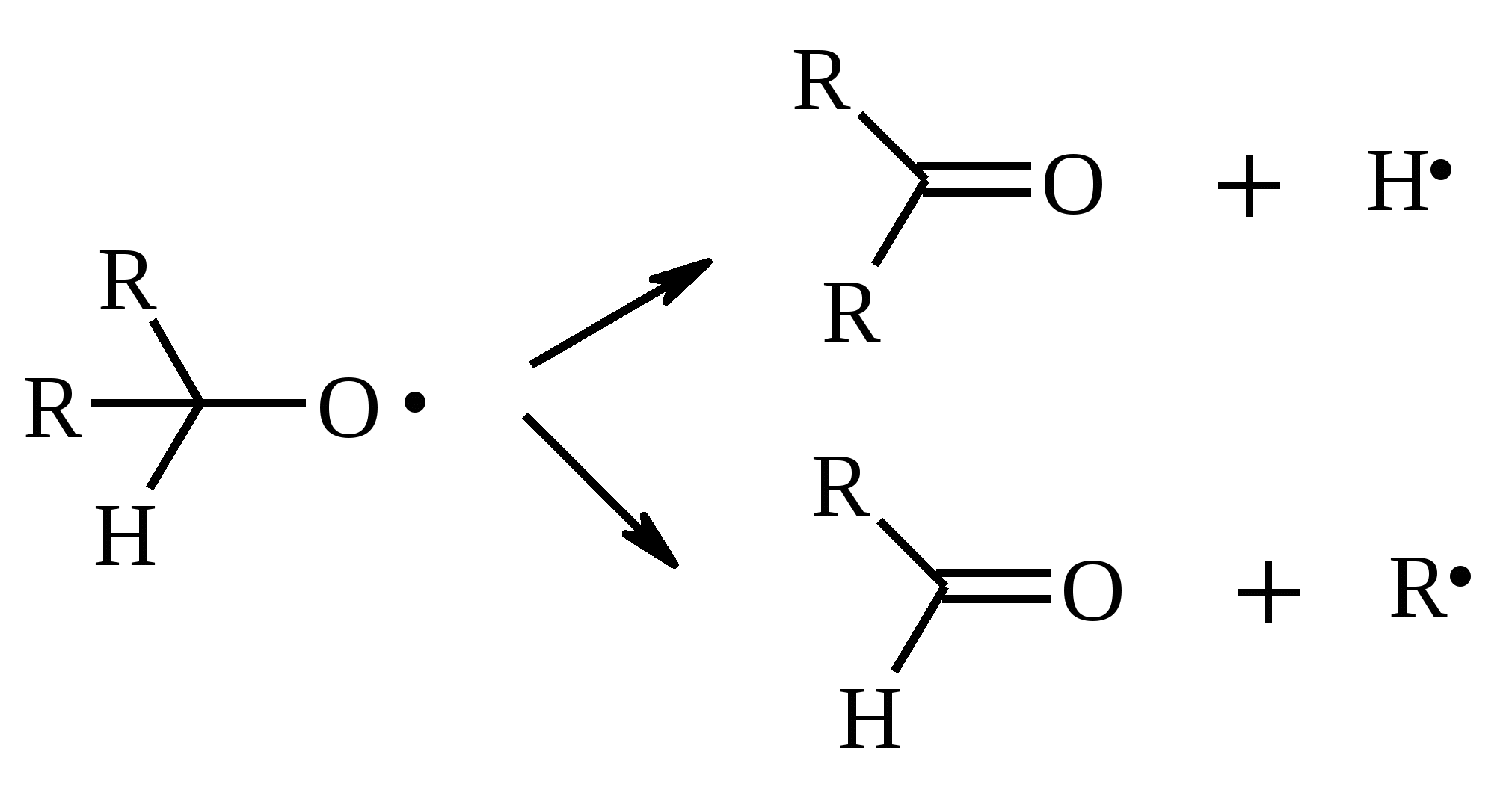 при высокой температуре основными продуктами являются альдегиды: 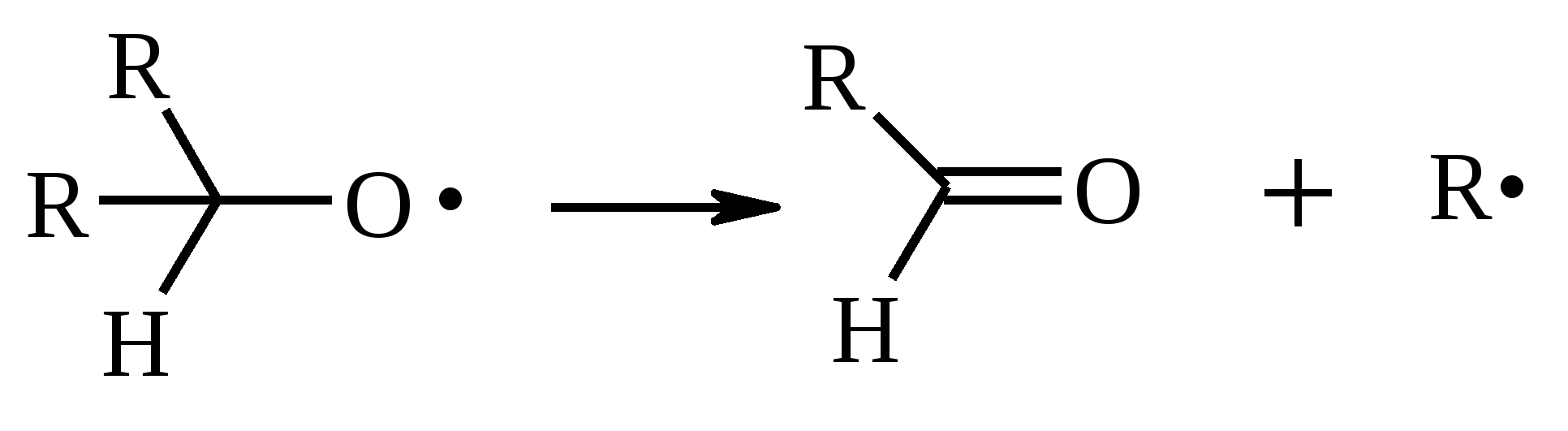 Первичные гидропероксиды дают при разложении смесь альдегидов: 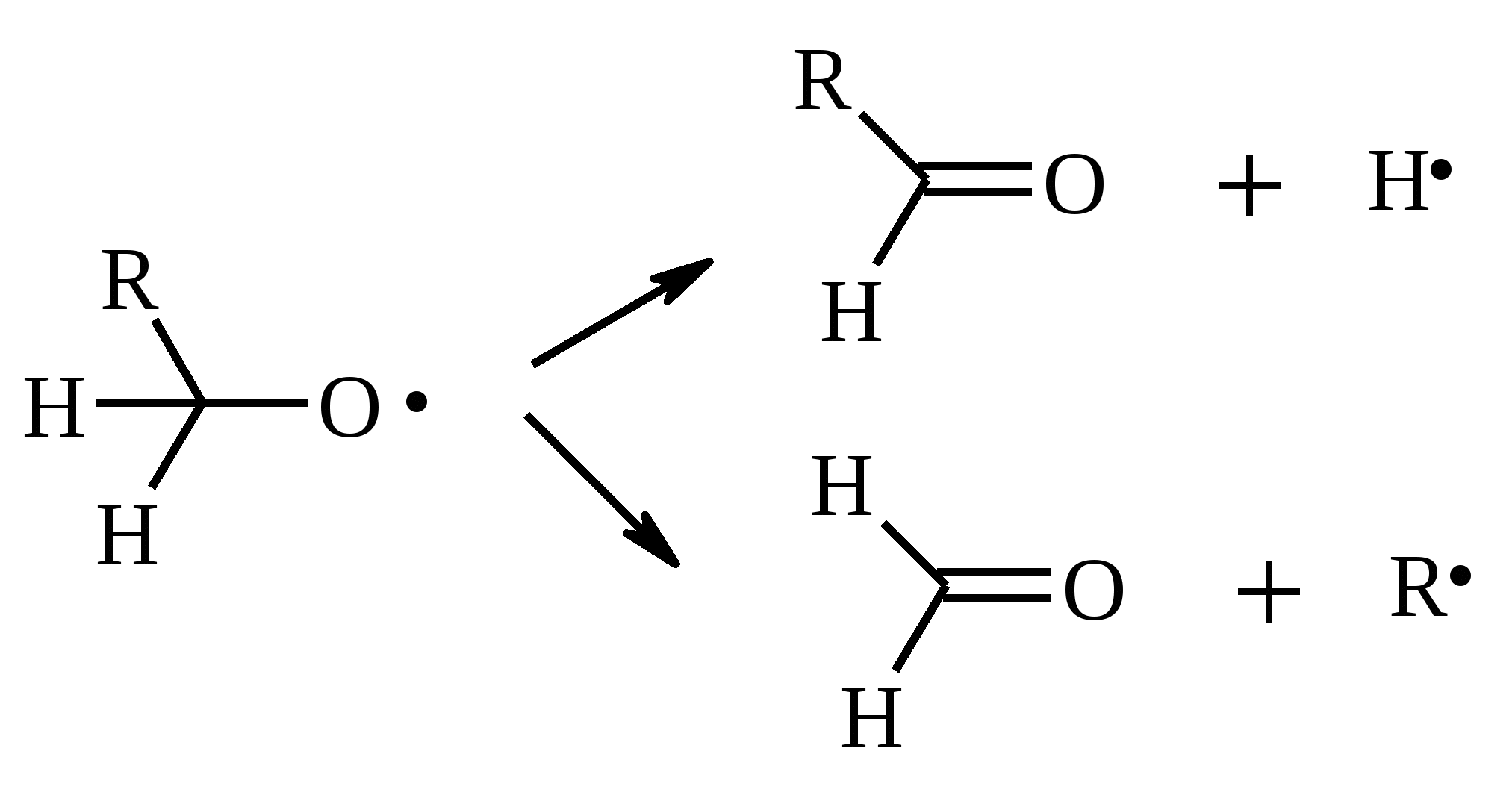 Кроме карбонильных соединений при разложении гидропероксидов образуются и спирты в результате отрыва атома водорода от молекулы алкана алкоксидным радикалом: Образующиеся карбонильные соединения и спирты могут далее окисляться до карбоновых кислот. Природные газы и низкокипящие фракции нефти при окислении под большим давлением (10-20 МПа) в присутствии металлических катализаторов и температуре 390-400°С дают метанол в качестве главного продукта реакции: CH4 + O2 → CH3OH Бутан окисляют в уксусную кислоту кислородом воздуха в присутствии ацетата кобальта (II), выход уксусной кислоты составляет 50%: 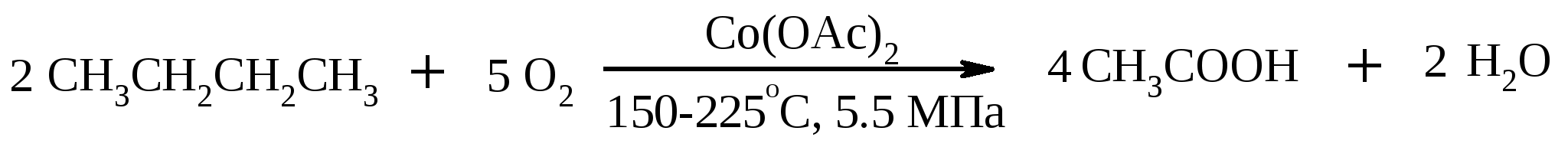 В промышленности также используют и окисление высших алканов кислородом воздуха при 100-150С в присутствии ацетата марганца как катализатора. Окисление происходит при продувании тока воздуха через расплавленный парафин, содержащий соль марганца. В результате разрыва углерод-углеродной связи образуется сложная смесь кислот с нормальной цепью:  Кислоты отделяют от непрореагировавшего парафина растворением в водной щелочи с последующей нейтрализацией минеральной кислотой. Циклоалканы окисляются в основном подобно алканам. Так, например, превращение циклогексана в циклогексилгидропероксид под действием кислорода в присутствии солей кобальта происходит по радикальному механизму, где роль инициатора цепного процесса выполняет кислород:  Образующийся из гидропероксида под действием соли кобальта (II) алкоксильный радикал далее превращается в циклогексанол:  или циклогексанон:  Возможны, однако, и другие реакции с участием алкоксильного радикала, например -распад, сопровождающийся раскрытием шестичленного цикла:  Циклогексанол и циклогексанон могут также подвергаться дальнейшему окислению с раскрытием цикла и образованием, в частности, адипиновой кислоты. С помощью диоксиранов алканы и циклоалканы могут быть селективно окислены по третичному атому углерода с образованием спиртов: 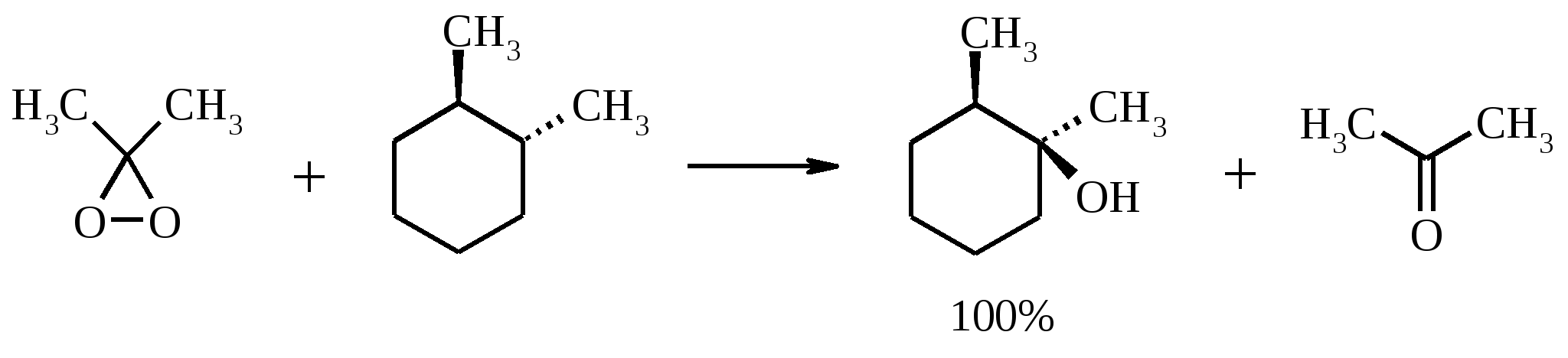 Первичные и вторичные неактивированные С–Н-связи алканов также могут подвергаться окислению по действием диоксирана в присутствии трифторуксусного ангидрида. 3. ОКИСЛЕНИЕ АЛКЕНОВ 3.1. СИНТЕЗ ЭПОКСИДОВ Под действием перкислот (перуксусной, пермуравьиной, м-хлорпербензойной, пертрифторуксусной и др.) алкены окисляются в α-окиси, или оксираны (реакция Прилежаева). Электронодонорные заместители при двойной связи облегчают протекание реакции. Процесс окисления протекает стереоспецифично, и α-окись сохраняет ту же конфигурацию, что и исходный алкен. 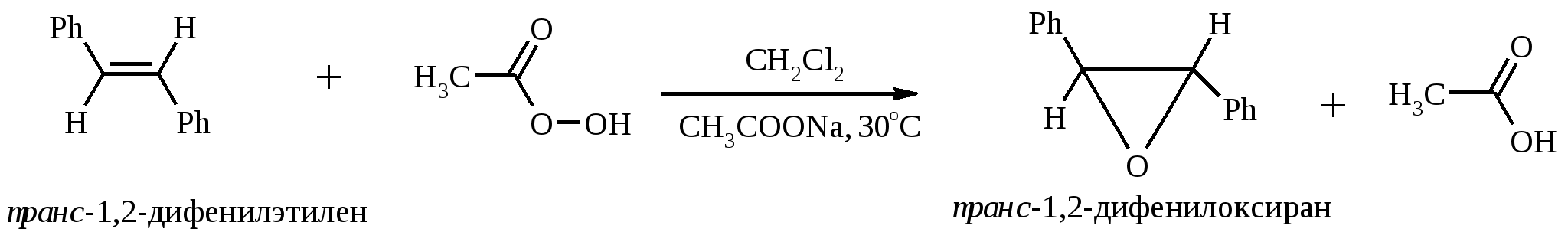 Процесс носит синхронный, согласованный характер и протекает по схеме: 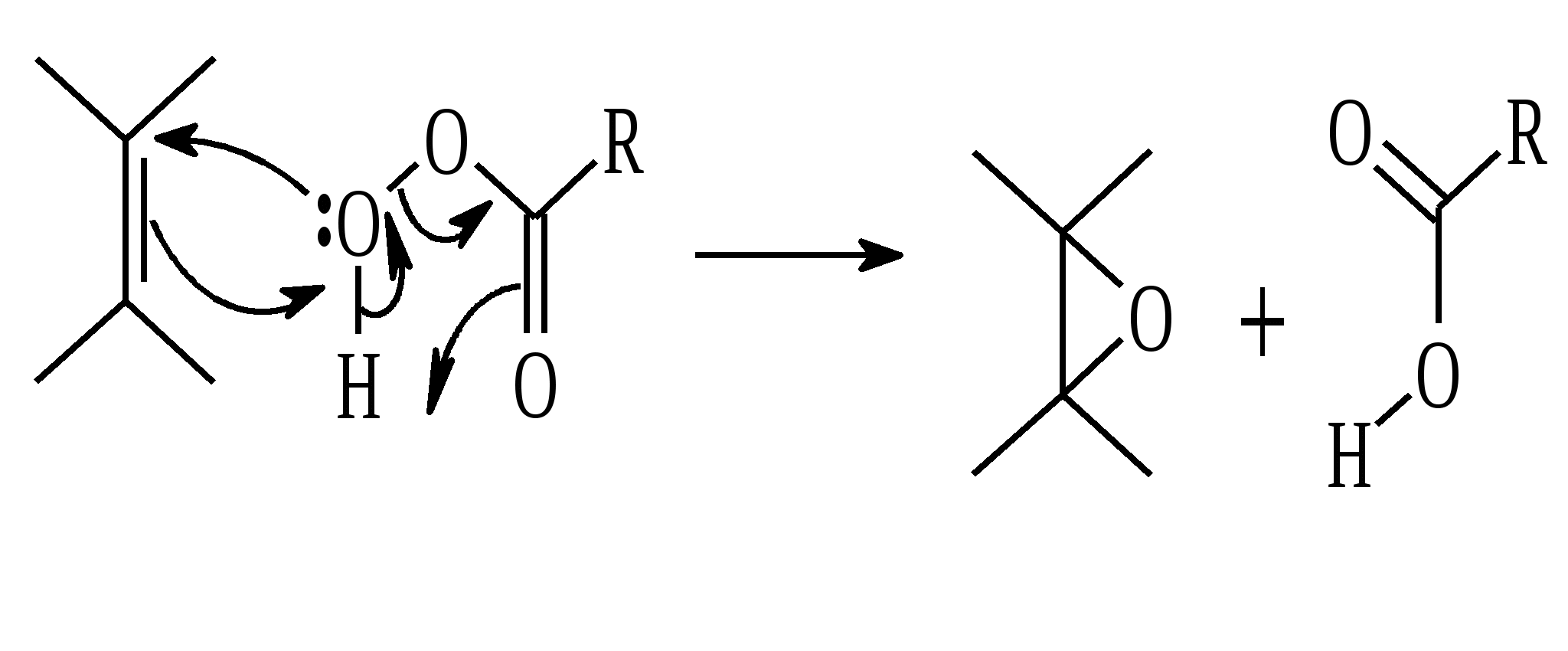 Альтернативный метод эпоксидирования заключается во взаимодействии алкена с нитрилом и 90%-ным пероксидом водорода:  Окись этилена получают прямым окислением этилена кислородом воздуха в присутствии серебра, нанесенного на оксид алюминия или карбид кремния: 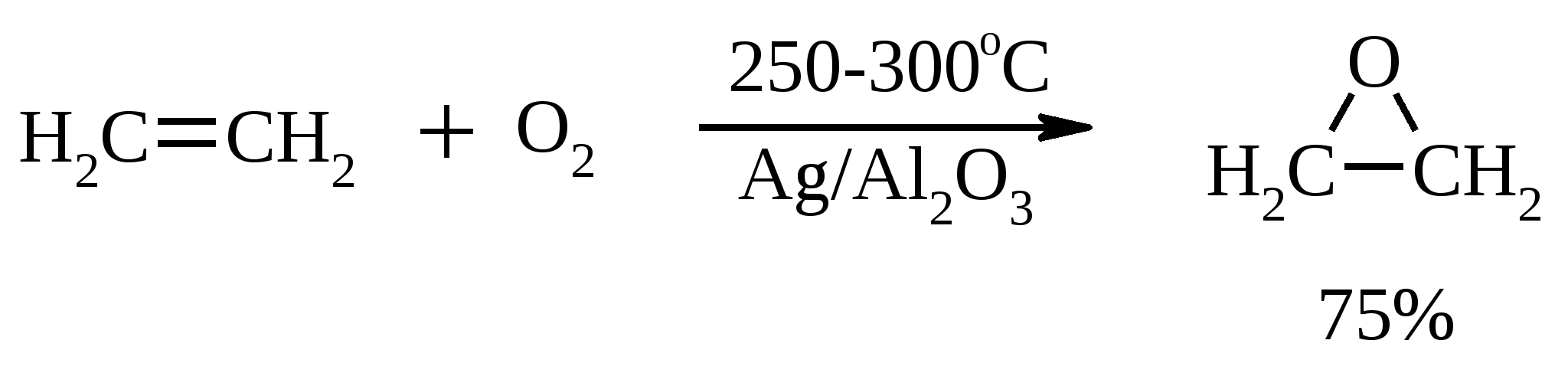 Окись этилена легко отделяется от этилена при растворении в воде с последующей перегонкой. Все попытки получения окиси пропилена прямым окислением пропилена кислородом на серебряном катализаторе были безуспешны, поскольку окислению подвергались С-Н-связи метильной группы в аллильном положении к двойной связи. В результате был разработан альтернативный промышленный метод синтеза окиси пропилена, известный под названием халкон-процесса. В халкон-процессе пропилен окисляется до его оксида под действием трет-бутилгидропероксида. Необходимый гидропероксид образуется в результате окисления изобутана в жидкой фазе кислородом при 120-150ºС и давлении 3 МПа. Далее он реагирует с пропиленом в жидкой фазе при 120-140ºС и давлении 3.5 МПа в присутствии солей молибдена как катализатора. 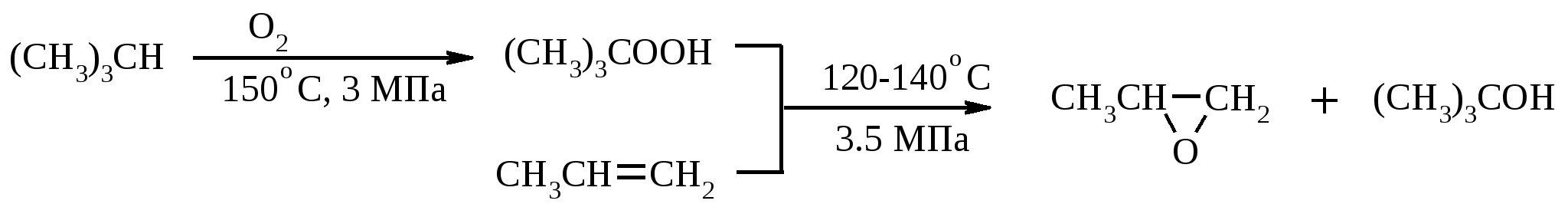 Выход окиси пропилена в расчете на пропилен составляет 90%. Эпоксиды могут быть получены с высоким выходом при действии на алкены диоксиранов:  3.2. ВАКЕР-ПРОЦЕСС В Вакер-процессе этилен окисляют в водном растворе хлористоводородной кислоты, содержащем хлориды палладия (II) и меди (II). Протекающие при этом реакции описываются следующими уравнениями:  или суммарно: 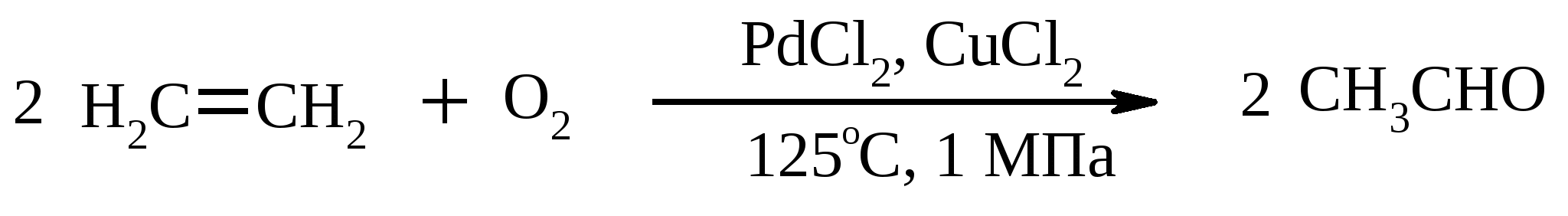 Таким образом, в процессе окисления расходуется только кислород. Помимо этилена многие другие монозамещенные и 1,2-дизамещенные алкены окисляются в альдегиды и кетоны хлоридом палладия. В случае 1,1-дизамещенных алкенов обычно получаются неудовлетворительные результаты. Если вместо воды в Вакер-процессе использовать уксусную кислоту, то образуется винилацетат:  Смесь этилена и уксусной кислоты окисляется в газовой фазе в присутствии палладиевого катализатора при 200ºС и давлении 10 атм, выход винилацетата достигает 90-95%. 3.3. СИНТЕЗ ВИЦИНАЛЬНЫХ ДИОЛОВ При взаимодействии алкенов в слабощелочной среде с разбавленным раствором KMnO4 в водных органических растворителях (ацетоне, этаноле и др.) при 0-10ºС образуются вицинальные диолы с выходами 30-75% (реакция Вагнера).  Первоначально образуется циклический эфир марганцевой кислоты, который немедленно гидролизуется до диола:  Эффективным гидроксилирующим агентом является тетраоксид осмия OsO4. При действии на алкены эквимолярного количества OsO4 в абсолютном эфире, пиридине или бензоле при комнатной температуре медленно образуется продукт присоединения, который при гидролизе водным раствором NaHSO3 или сероводородом дает с высокими выходами 1,2-диолы.  Тетраоксид осмия может использоваться и как катализатор в реакции окисления. Это позволяет работать лишь с незначительными его количествами, что важно вследствие высокой токсичности и стоимости данного реагента. Окисление проводят 30%-ным водным раствором пероксида водорода в трет-бутаноле при 0ºС.  Все гликоли, полученные окислением OsO4 или KMnO4, имеют цис-конфигурацию. Следует отметить, что высшие оксиды других переходных металлов (V2O5, WO3, MoO3 и др.) катализируют анти-гидроксилирование алкенов. Продукты антигидроксилирования алкенов можно также получить гидролизом соответствующих эпоксидов, либо в одном процессе совместить стадии образования и расщепления эпоксида, если алкен обрабатывать водным 30-70%-ным пероксидом водорода в муравьиной или трифторуксусной кислоте:  Кроме того, продукты транс-присоединения к двойной связи можно получить при обработке алкена иодом и бензоатом или ацетатом серебра в безводном бензоле или CCl4 (реакция Прево). Первоначально происходит образование йодэфира, в котором иод далее замещается бензоат-ионом.  Последующий гидролиз дибензоата гликоля приводит к 1,2-диолу. 3.4. ОКИСЛЕНИЕ С РАСЩЕПЛЕНИЕМ УГЛЕРОДНОГО СКЕЛЕТА ПО ДВОЙНОЙ СВЯЗИ Озонирование Озонолиз алкенов и последующее расщепление промежуточно образующегося озонида приводит к образованию карбонильных соединений: 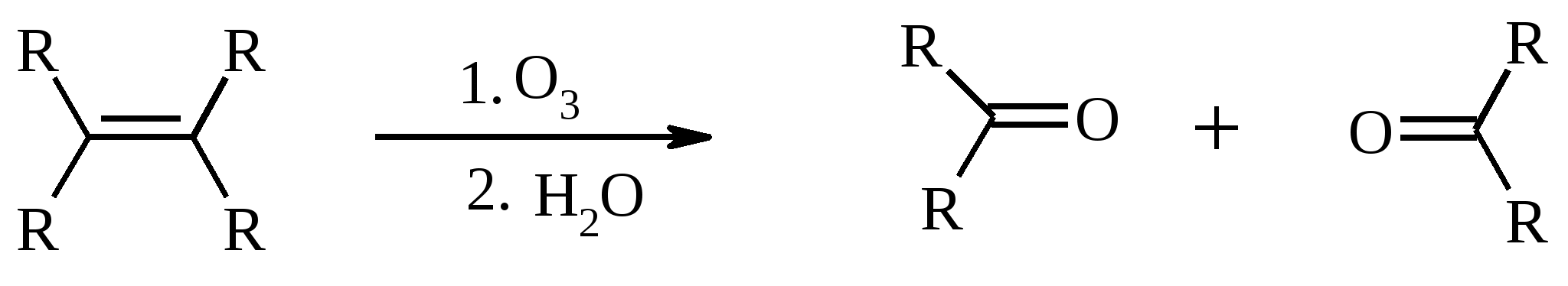 При взаимодействии озона (в виде 3-8%-ного раствора в воздухе) с алкенами в инертном растворителе (этилацетате, уксусной кислоте, дихлорметане) сначала происходит электрофильное присоединение озона и образуется неустойчивый мольозонид (1,2,3-триоксолан), самопроизвольно перегруппировывающийся в более устойчивый изоозонид (1,2,4-триоксолан):  Полиены более устойчивы к действию озона, сопряженные диены реагируют с озоном, как правило, по одной двойной связи. Озониды являются неустойчивыми взрывчатыми веществами, поэтому их обычно не выделяют, а подвергают окислительному или восстановительному расщеплению. Восстановительное расщепление осуществляется с помощью цинка и уксусной кислоты, водородом в присутствии Pd или Pt, трифенилфосфином, Na2SO3, диметилсульфидом и др. При этом продуктами реакции являются альдегиды и кетоны.   Если в качестве восстановителя при расщеплении озонида использовать NaBH4, то конечными продуктами будут первичные или вторичные спирты:  Окислительное расщепление протекает под действием пероксида водорода или надкислот. В результате в зависимости от строения исходного алкена образуется либо смесь двух кетонов, либо двух карбоновых кислот, либо карбоновой кислоты и кетона.  Расщепление углеродного скелета молекулы по месту двойных связей может осуществляться и под действием других окислителей: HNO3, KMnO4, K2Cr2O7 + H2SO4, CrO3 + AcOH.  Один из современных препаративных методов окислительной деструкции алкенов был предложен в 1955 г. Р. Лемье. В основе этого метода лежит гидроксилирование алкенов с помощью KMnO4 с последующим расщеплением вицинального гликоля периодатом натрия NaIO4 при pH 7-8. Продуктами расщепления являются кетоны и карбоновые кислоты, так как альдегиды в этих условиях окисляются до карбоновых кислот. Диоксид марганца и манганат калия вновь окисляются периодатом до перманганата, что позволяет использовать только каталитические количества KMnO4. 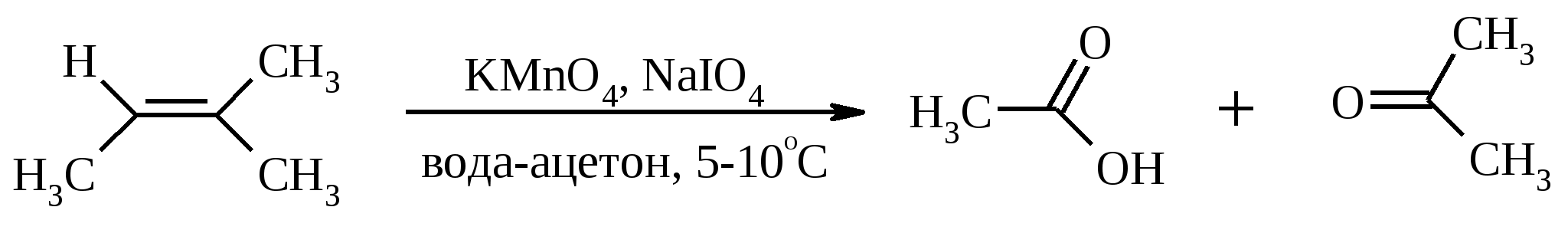 В другой разновидности этого метода вместо KMnO4 используют каталитические количества OsO4 или RuO4 и NaIO4, что позволяет остановить окисление на стадии альдегида. Тетраоксид осмия присоединяется к двойной связи с образованием осмата, который окисляется NaIO4 до карбонильных соединений с регенерацией тетраоксида осмия:  |
