Окисление. Федеральное агентство по образованию
 Скачать 1.34 Mb. Скачать 1.34 Mb.
|
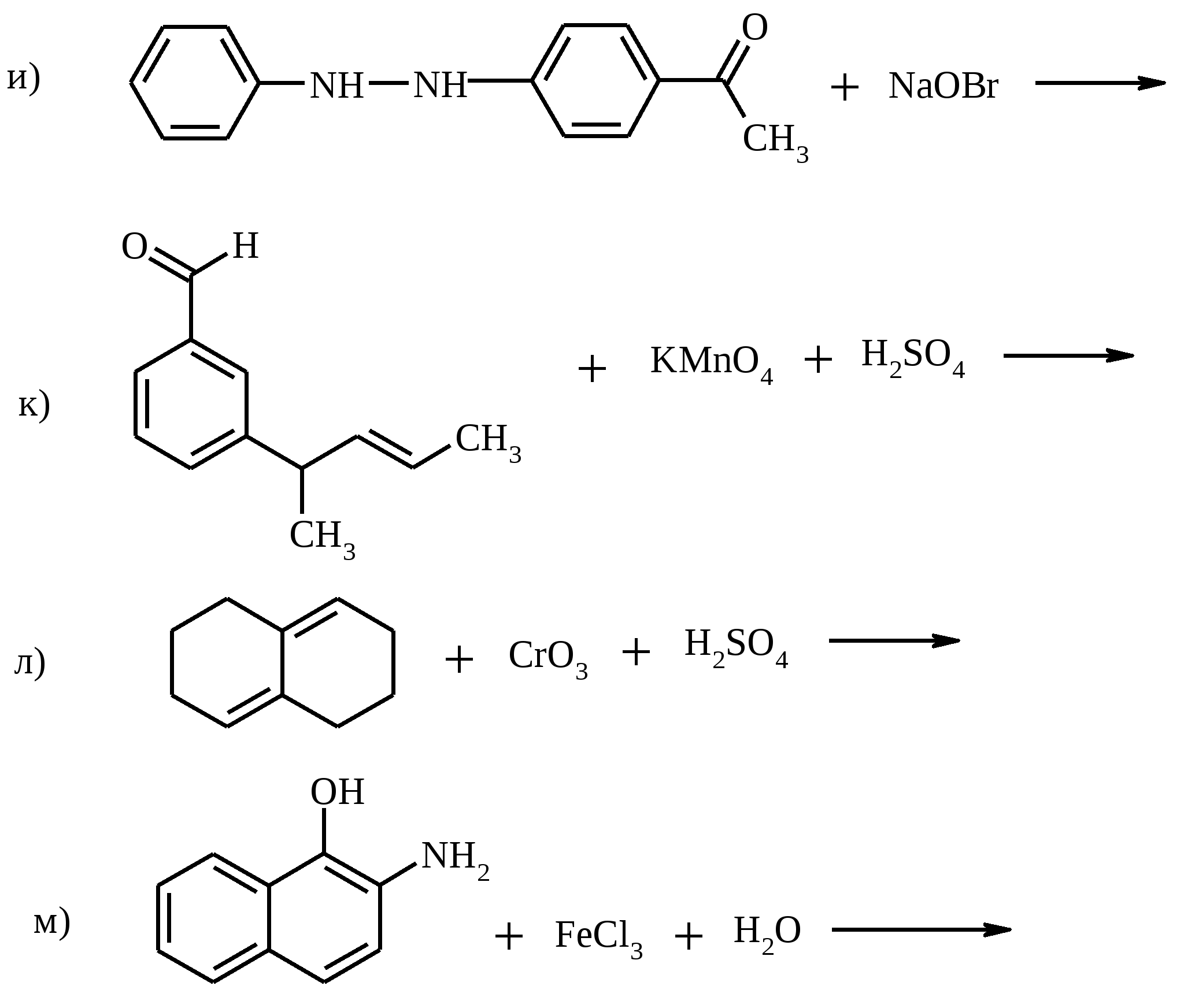
17.6. БЕНЗИЛ 
Нагреванием на кипящей водяной бане готовят раствор 18 г (0.072 моль) CuSO4•5H2O в 17 мл пиридина и 14 мл H2O, добавляют 7.5 г (0.035 моль) бензоина и смесь перемешивают 2 ч при нагревании на паровой бане. Реакционная смесь становится темно-зеленой, а образующийся бензил отделяется в виде жидкости (верхняя фаза). Реакционную смесь охлаждают, отфильтровывают затвердевший бензил, промывают его водой и сушат на воздухе. Продукт перекристаллизовывают из CCl4. Выход 6.4 г (85%). Бензил – желтое кристаллическое вещество с т. пл. 94ºС, т. кип. 346-348°С (с разл.), 183°С/10 мм рт. ст. Растворимость: (г в 100 г растворителя): в воде – 0.033 (100°С), этаноле – 4.89 (25°С), 89.6 (66°С), бензоле – 59 (25°С). 17.7. (±)2,2’-ДИГИДРОКСИ-1,1’-БИНАФТИЛ 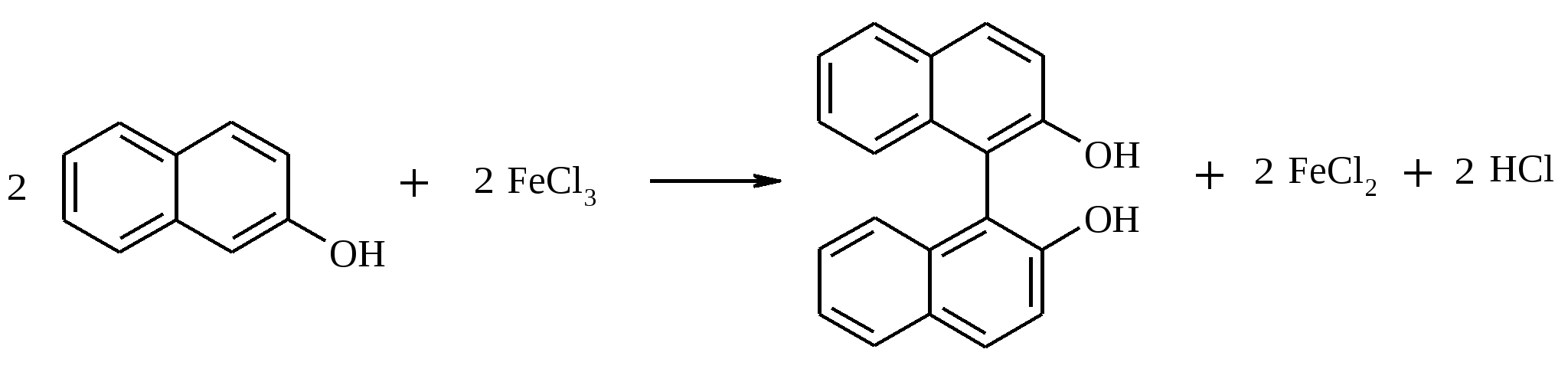
К кипящему раствору 2.0 г (13.9 ммоль) β-нафтола в 250 мл воды при перемешивании медленно прикапывают раствор 3.79 г (14.0 ммоль) гексагидрата хлорида железа (III) в 25 мл воды. При этом образуется белый осадок бинафтола. Затем в этом же растворе растворяют еще 2.0 г (13.9 ммоль) β-нафтола и снова прикапывают раствор 3.79 г (14.0 ммоль) FeCl3·6H2O в 25 мл воды. Реакционную смесь перемешивают 30 мин при 100ºС, осадок бинафтола отфильтровывают и кипятят его в 250 мл воды для удаления непрореагировавшего β-нафтола. После фильтрования продукт перекристаллизовывают из водного этанола или из толуола. Выход 3.5 г (87%). (±)2,2′-Дигидрокси-1,1′-бинафтил – бесцветные иглы с т. пл. 215ºС. 17.8. ЩАВЕЛЕВАЯ КИСЛОТА 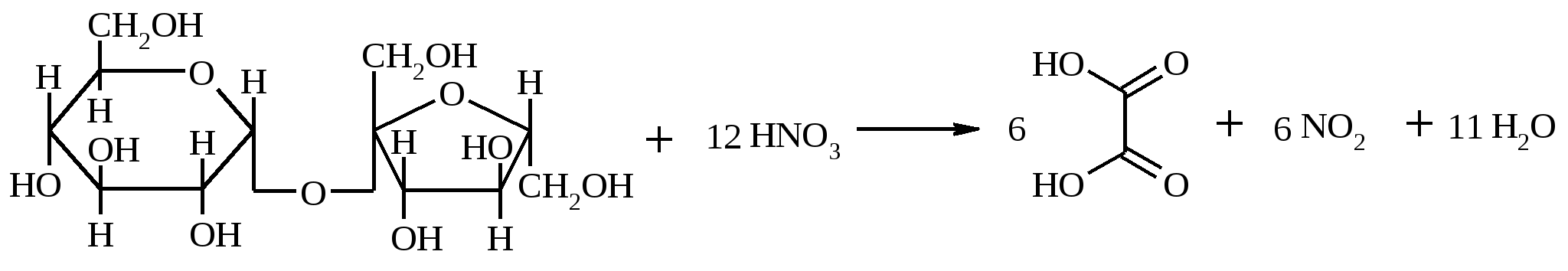
Внимание! Во время реакции выделяются ядовитые оксиды азота, работать в вытяжном шкафу. В конической колбе нагревают 5 г (14.6 ммоль) растертого в порошок сахара с 29 мл концентрированной азотной кислоты (d 1.38). Как только начнется выделение бурых паров NO2, нагревание прекращают. Реакция окисления самопроизвольно протекает еще некоторое время. Затем, когда выделение бурых паров заканчивается, жидкость выливают в фарфоровую чашку и упаривают на водяной бане до небольшого объема. При охлаждении из раствора выкристаллизовывается щавелевая кислота. Ее отфильтровывают и перекристаллизовывают из воды. Выход 2 г, считая на безводную кислоту (25%). Щавелевая кислота – бесцветное вещество, кристаллизующееся с двумя молекулами воды, т. пл. дигидрата 101.5ºС. Растворимость дигидрата (г в 100 мл растворителя): вода – 9.5 (15°С), 120 (90°С), этанол – 23.7 (15°С), диэтиловый эфир – 1.37 (20°С); не растворим в хлороформе, бензоле, петролейном эфире. Безводная щавелевая кислота плавится в запаянном капилляре при 189.5ºС с разложением, возгоняется при 125°С. Растворимость (г в 100 мл растворителя): вода – 6.6, этанол – 33.7, диэтиловый эфир – 16.9. 17.9. п-ТОЛУИЛОВАЯ КИСЛОТА 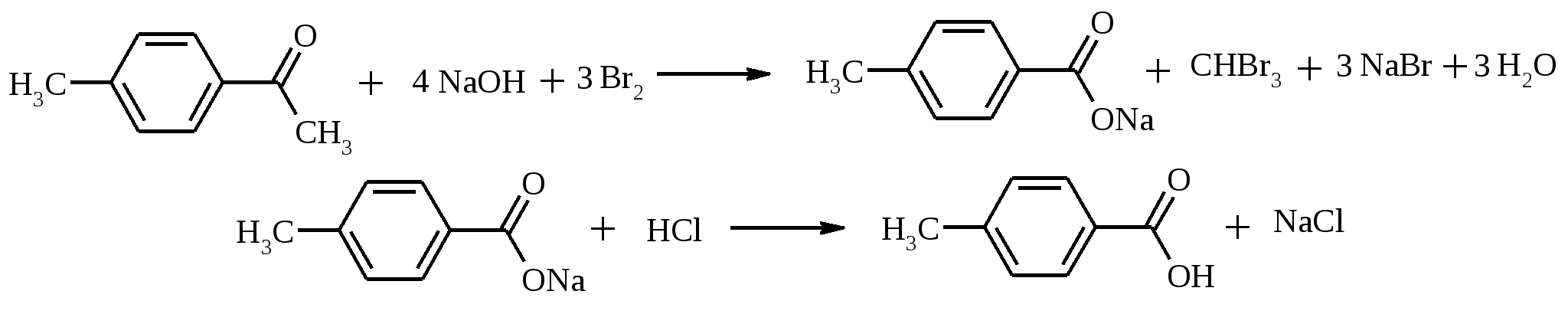
Готовят раствор гипобромита натрия, смешивая 5 г (0.125 моль) твердого гидроксида натрия, 28 мл воды, 25 г толченого льда и 4 мл (12.4 г, 77.6 ммоль) брома. Приготовленный раствор переносят в круглодонную колбу емкостью 100 мл и вносят туда 1.1 г (8.2 ммоль) n-метилацетофенона. Колбу снабжают обратным холодильником (можно воздушным) и помещают в водяную баню, нагретую до 50оС. Реакционную массу выдерживают при этой температуре, непрерывно встряхивая, в течение 30 мин. Затем содержимое колбы выливают в стакан и подкисляют конц. соляной кислотой до кислой реакции среды. Выпавшую в осадок n-толуиловую кислоту отфильтровывают, промывают на фильтре небольшими порциями холодной воды и высушивают на воздухе. Выход около 1 г (90%). n-Толуиловая кислота – бесцветное кристаллическое вещество с т. пл. 178-178.5ºС, хорошо растворима в этаноле, хлороформе, диэтиловом эфире, ацетоне, плохо – в воде. 17.10. ИЗОМАСЛЯНЫЙ АЛЬДЕГИД 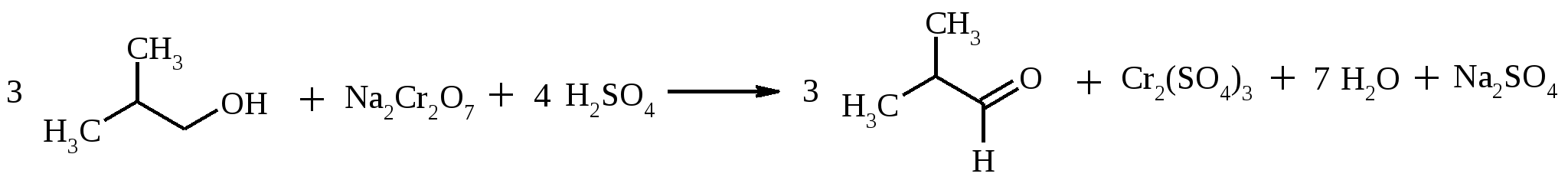
В трехгорлую колбу, снабженную механической мешалкой с глицериновым затвором, капельной воронкой, насадкой Вюрца, к которой присоединен прямой холодильник Либиха с алонжем и приемником, помещают 40 мл (32 г, 0.42 моль) изобутилового спирта, нагревают до кипения и при интенсивном перемешивании в течение 30-40 минут по каплям приливают окислительную смесь, приготовленную из 36.8 г (0.12 моль) двухводного дихромата натрия, 28 мл (51.5 г, 0.53 моль) концентрированной серной кислоты и 250 мл воды. Приемник охлаждают смесью снега с солью, так как отгоняющийся в процессе реакции изомасляный альдегид очень летуч. После прибавления всей окислительной смеси реакционную массу нагревают еще 20 мин. Дистиллят, собравшийся в приемнике, перегоняют, собирая фракцию от 59 до 69ºС. Эту фракцию перегоняют еще раз, собирают альдегид с т. кип. 61.5-62.5°С. Выход около 19 г (61%). Изомасляный альдегид – бесцветная жидкость с характерным запахом, т. пл. -66ºС, т. кип. 64.2-64.6ºС, d420 0.7938, nD20 1.3730. Смешивается с органическими растворителями, растворимость в воде 10% при 20˚С. Образует азеотропную смесь с водой (т. кип. 60.5ºС, 5% воды по массе). 17.11. ПИРОСЛИЗЕВАЯ КИСЛОТА 
В трехгорлой колбе с мешалкой и термометром растворяют 15 г (0.375 моль) твердого гидроксида натрия в 50 мл воды. Охлаждают раствор до 0ºС смесью льда и соли и добавляют по каплям при перемешивании 5.6 мл (17.4 г, 0.109 моль) брома (температура реакционной смеси не должна превышать +5ºС). К полученному раствору гипобромита в течение 1 ч добавляют по каплям 9.6 г (8.3 мл, 0.1 моль) свежеперегнанного фурфурола, поддерживая температуру ниже +5ºС. Продолжают перемешивание 2 ч при той же температуре и осторожно подкисляют реакционную массу предварительно охлажденной до 0ºС концентрированной соляной кислотой до кислой реакции среды. Отфильтровывают выпавший осадок, промывают его холодной подкисленной HCl водой и высушивают сначала на воздухе, а затем в вакуум-эксикаторе над прокаленным хлористым кальцием. Выход 8 г (65%). Пирослизевая (фуран-2-карбоновая кислота) – бесцветное кристаллическое вещество с т. пл. 126-128ºС, возгоняется. 17.12. АНТРАХИНОН 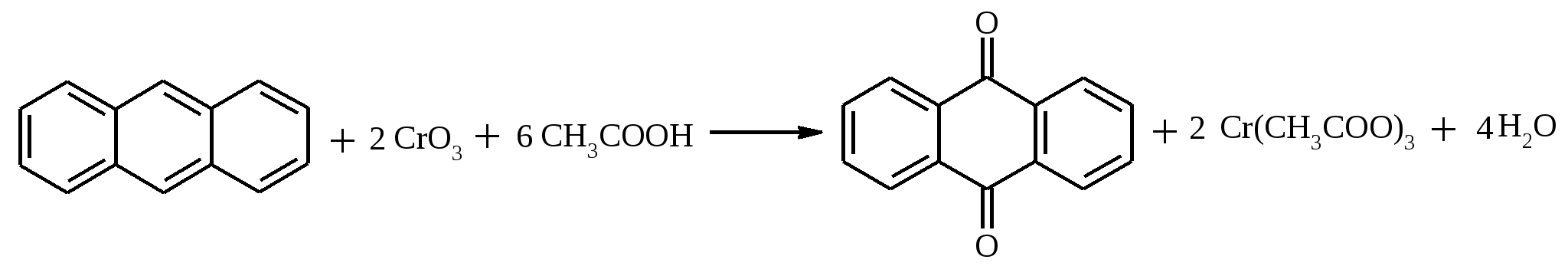
В круглодонной колбе, снабженной двурогим форштосом с обратным холодильником и капельной воронкой, растворяют при кипячении 1.25 г (7 ммоль) тонко растертого антрацена в 55 мл ледяной уксусной кислоты. В течение 1 ч при постоянном кипячении прибавляют из капельной воронки раствор 5 г (50 ммоль) хромового ангидрида в 5 мл воды и 20 мл ледяной уксусной кислоты. После охлаждения реакционную смесь разбавляют 140 мл воды. Через 1 ч отфильтровывают выпавший антрахинон, промывают его водой, разбавленным раствором соды, снова водой и сушат на воздухе. Полученный сырой антрахинон перекристаллизовывают из ледяной уксусной кислоты. Выход 1 г (70%). Антрахинон – светло-желтые кристаллы с т. пл. 287ºС. Растворимость: в этаноле – 5% (18ºС), 22.5% (78ºС), толуоле – 1.92% (15ºС), 25.6% (100ºС), воде – 0.006% (50ºС). 17.13. ОКТАНАЛЬ 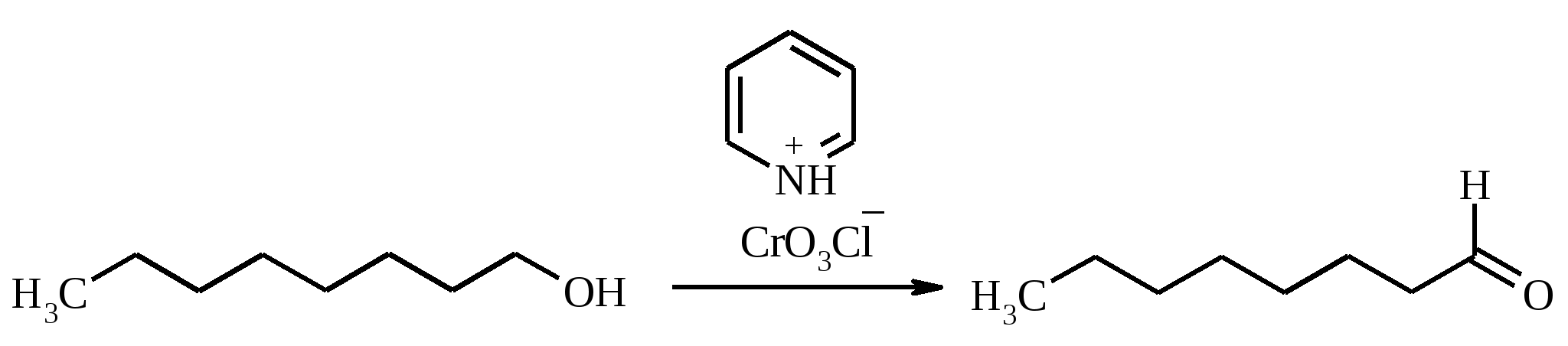
К суспензии 32.3 г (0.15 моль) хлорхромата пиридиния в 200 мл безводного дихлорметана при тщательном перемешивании в один прием прибавляют 13 г (0.1 моль) октанола-1, растворенного в 20 мл дихлорметана. Смесь перемешивают при комнатной температуре 1.5 ч. Затем к смеси прибавляют 200 мл безводного диэтилового эфира, эфирный раствор декантируют, черный осадок промывают эфиром (3 раза по 50 мл). Объединенные эфирные фазы фильтруют через 20 г силикагеля. Растворитель отгоняют на водяной бане, а остаток фракционируют под вакуумом водоструйного насоса на колонке Вигре длиной 20 см, собирая фракцию 63-64ºС/12 мм рт. ст. Выход 10.7 г (84%). Октаналь – бесцветная жидкость с резким запахом, при сильном разбавлении приобретает апельсиновый запах, т. пл. -27ºС, т. кип. 173ºС, 81ºС/32 мм рт. ст., d420 0.8211, nD20 1.4217. Растворим в большинстве органических растворителей, не растворим в воде. 17.14. ТЕРЕФТАЛЕВАЯ КИСЛОТА 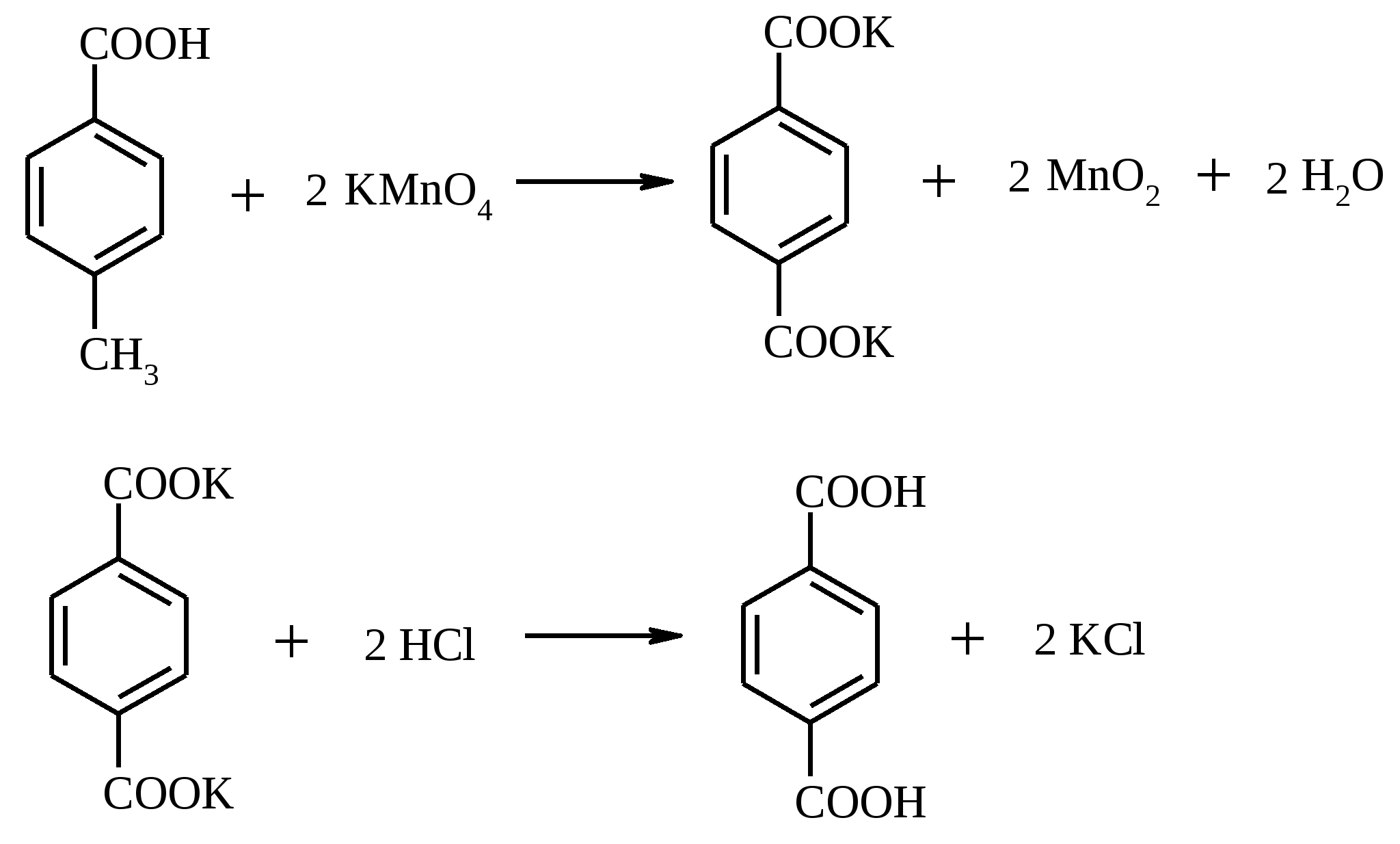
В круглодонной колбе, снабженной двурогим форштосом с капельной воронкой и обратным холодильником, растворяют 1 г (7.4 ммоль) n-толуиловой кислоты в разбавленном растворе гидроксида калия и при кипячении постепенно прибавляют из капельной воронки раствор 2.4 г (15.2 ммоль) KMnO4 в 50 мл воды. Смесь кипятят 3 ч. Если малиновый цвет раствора KMnO4 не исчезнет после продолжительного кипячения, то к нему по каплям добавляют этанол. Осадок MnO2 отфильтровывают, дважды промывают его на фильтре горячей водой (по 5 мл). Объединенные фильтраты нагревают в конической колбе почти до кипения и терефталевую кислоту осаждают из раствора, прибавляя конц. соляную кислоту до кислой реакции среды. Терефталевую кислоту отфильтровывают, промывают на фильтре водой и высушивают. Выход около 1.1 г (90%). Терефталевая кислота – бесцветное кристаллическое вещество, при температуре выше 300ºС возгоняется, т. пл. 427ºС (в запаянном капилляре). Растворимость при 25ºС (г в 100 г растворителя): в воде – 0.0019, CH3COOH – 0.035, CH3OH – 0.1, ДМФА – 6.7, ДМСО – 20.0, H2SO4 – 2.0. 17.15. ДЕГИДРОДИВАНИЛИН 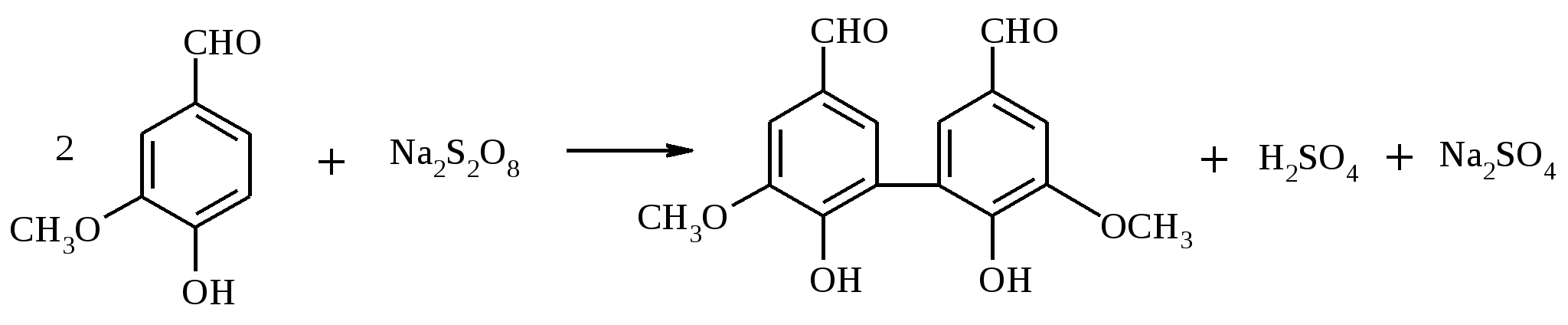
В круглодонной колбе на 500 мл, снабженной механической мешалкой, растворяют при нагревании 3 г (19.7 ммоль) ванилина в 200 мл воды, раствор охлаждают до комнатной температуры и при энергичном перемешивании прибавляют сначала 0.1 г FeSO4·7H2O, потом 2.5 г (10.5 ммоль) Na2S2O8. Через 30 мин выпавший осадок отфильтровывают и еще влажным растворяют в 20 мл 5%-ного раствора гидроксида натрия. Из полученного раствора (при необходимости фильтруют) подкислением соляной кислотой высаживают дегидродиванилин. Выход 2.9 г (97%). Дегидродиванилин (2,2’-дигидрокси-3,3’-диметокси-5,5’-диформилдифенил) – бесцветные кристаллы, плохо растворимые в воде и большинстве органических растворителей, т. пл. 305ºС (в запаянном капилляре 315°С). 17.16. БЕНЗАЛЬДЕГИД 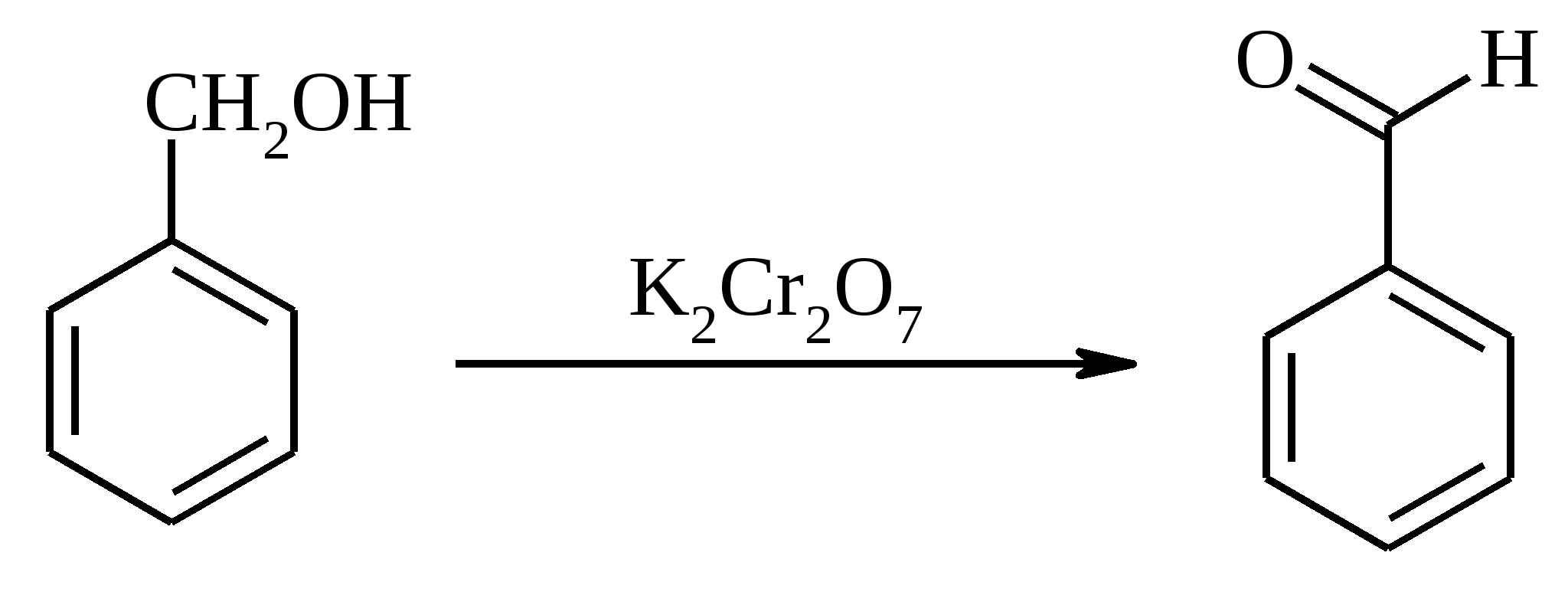
В трехгорлую колбу, снабженную обратным холодильником, капельной воронкой и термометром, помещают 10.8 г (0.1 моль) бензилового спирта, 100 мл бензола (либо толуола) и 20 мл воды. При перемешивании в течение 30 мин при 70-75ºС прибавляют раствор 29.4 г (0.1 моль) дихромата калия в 100 мл воды. Смесь перемешивают при 70-75ºС еще в течение 8 ч. Органическую фазу отделяют, водную экстрагируют бензолом (3 раза по 20 мл). Бензольные растворы объединяют, промывают последовательно водой, насыщенным раствором гидрокарбоната натрия, снова водой и экстракт сушат сульфатом магния. Смесь разгоняют с дефлегматором, фракция с т. кип. 176-180ºС представляет собой бензальдегид, выход 9.1 г (86%). Бензальдегид – бесцветная жидкость с запахом горького миндаля, т. пл. -26ºС, т. кип. 179ºС, d420 1.046, nD20 1.5460. Растворим в спирте, плохо – в воде (0.3%), на воздухе быстро окисляется в бензойную кислоту. 17.17. ТРИМЕТИЛУКСУСНАЯ КИСЛОТА 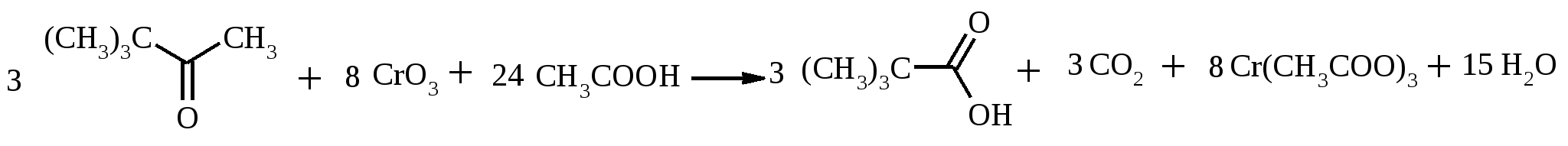
Раствор 29 г (0.29 моль) пинаколина в 15 мл ледяной уксусной кислоты помещают в трехгорлую колбу емкостью 500 мл, снабженную механической мешалкой, обратным холодильником и термометром. Затем нагревают содержимое колбы до 100°С (при 50-80ºС окисление вообще не идет) и по каплям прибавляют через обратный холодильник в течение 30 мин заранее приготовленный раствор CrO3 в водной уксусной кислоте (20 г (0.2 моль) CrO3 растворяют в 10 мл воды и, когда растворение закончится, добавляют 25 мл ледяной уксусной кислоты). Реакционную смесь разбавляют 200 мл воды, нейтрализуют концентрированным раствором NaOH и подвергают перегонке с водяным паром. Полученную кислоту отделяют в делительной воронке, сушат над безводным CaCl2 и перегоняют в вакууме, собирая фракцию с т. кип. 75-78ºС при 20 мм рт. ст. Выход около 23 г (75%). Триметилуксусная (пивалиновая) кислота – бесцветное кристаллическое вещество, т. пл. 35.5ºС, т. кип. 164ºС. Растворима в воде, спирте, диэтиловом эфире. 17.18.n-НИТРОАЦЕТОФЕНОН 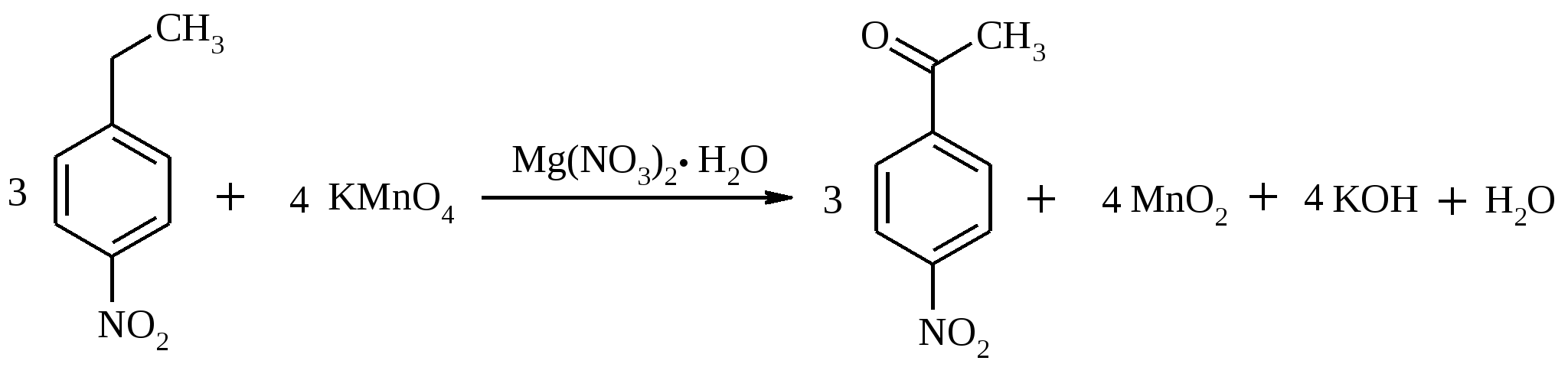
В круглодонную трехгорлую колбу емкостью 500 мл, снабженную мешалкой, термометром и обратным холодильником, помещают раствор 50 г (0.194 моль) гексагидрата нитрата магния в 200 мл воды и 15.1 г (0.1 моль) n-нитроэтилбензола. Смесь подогревают до температуры 60ºС и, при энергичном перемешивании, небольшими порциями добавляют к ней 25 г (0.16 моль) хорошо измельченного перманганата калия, прибавляя каждую следующую порцию только после обесцвечивания раствора. По окончании добавления перманганата смесь перемешивают при температуре 60ºС еще в течение 2 ч, затем повышают температуру до 90ºС и быстро фильтруют горячей через воронку Бюхнера. Осадок диоксида марганца тщательно промывают небольшим количеством кипящей воды. Из фильтрата выделяется масло, которое при охлаждении затвердевает. Выделившиеся кристаллы отфильтровывают и сушат на воздухе. Выход 7 г (42%). n-Нитроацетофенон – светло-желтое кристаллическое вещество с т. пл. 78-80ºС, т. кип. 138ºС при 1.5 мм рт. ст. 17.19. ЦИКЛОГЕКСАНОН 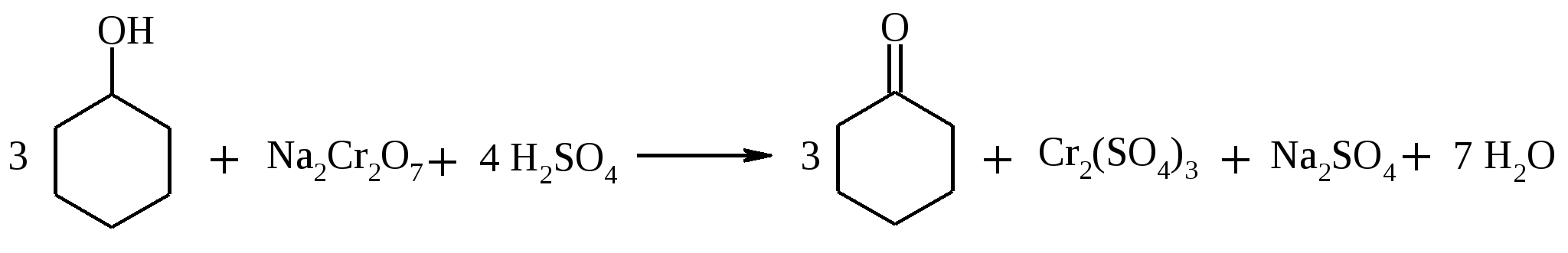
В трехголую колбу вместимостью 500 мл, снабженную мешалкой, капельной воронкой и термометром, помещают 12.5 г (0.125 моль, 13.3 мл) циклогексанола и 15 мл диэтилового эфира. Содержимое колбы охлаждают до 0-5ºС в бане со льдом. Отдельно в стеклянном стакане растворяют 11.5 г (0.039 моль) дихромата натрия (в виде дигидрата) в 125 мл воды. К полученному раствору осторожно приливают 10 мл (18.4 г, 0.188 моль) концентрированной серной кислоты. Окислительную смесь охлаждают до 4ºС, переносят в капельную воронку и постепенно при перемешивании прибавляют к раствору циклогексанола. Температуру реакционной смеси поддерживают в интервале 3-5ºС. После прибавления всего количества окислителя перемешивание продолжают в течение 3 ч при комнатной температуре. Затем смесь переносят в делительную воронку и экстрагируют диэтиловым эфиром 2 раза по 25 мл. Эфирные вытяжки объединяют, встряхивают с небольшим количеством безводного карбоната калия, фильтруют через слой карбоната калия и сушат сульфатом натрия. Высушенный раствор переносят в колбу Вюрца и отгоняют эфир на водяной бане. Затем на воздушной бане с воздушным холодильником перегоняют циклогексанон, собирая фракцию с т. кип. 153-156ºС. Циклогексанон – бесцветная маслянистая жидкость с резким запахом, т. кип. 156ºС, d420 0.9478, nD20 1.4507; растворим в этаноле, диэтиловом эфире, мало растворим в воде. 17.20. 1-АЗА-8,9-БЕНЗЦИКЛОНОНЕНДИОН-2,7 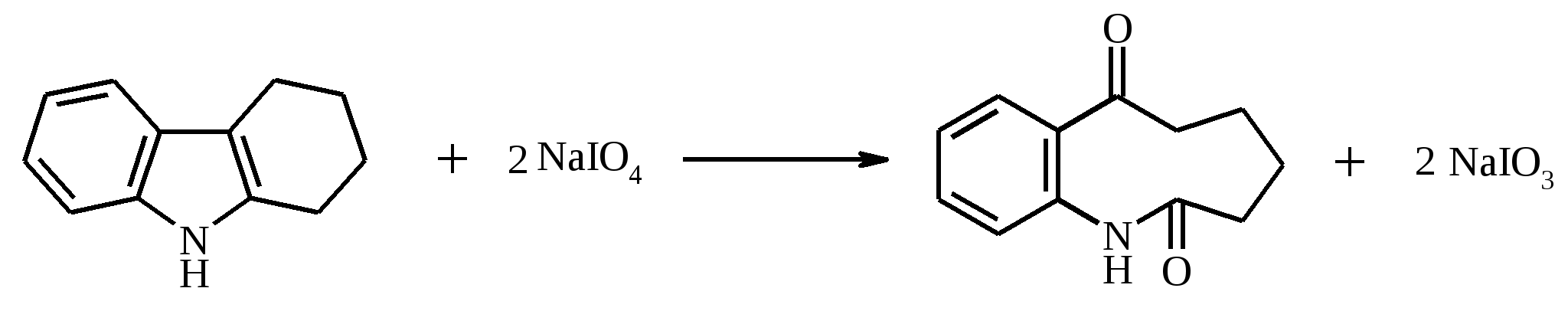
Раствор 2.52 г (14.7 ммоль) тетрагидрокарбазола в 75 мл этанола добавляется к раствору 6.92 г (3.23 ммоль) метапериодата натрия в 35 мл воды. При этом раствор становится теплым и начинает выпадать иодат натрия в виде бесцветных игл. Через 2.5 ч водный раствор экстрагируют хлористым метиленом, экстракт сушат безводным Na2SO4, растворитель отгоняют на водяной бане. Остаток перекристаллизовывают из этилацетата. Выход 2.38 г (80%). 1-Аза-8,9-бензциклононендион-2,7 – бесцветное кристаллическое вещество, т. пл. 156-157ºС. 17.21. БЕНЗИМИДАЗОЛ-2-СУЛЬФОКИСЛОТА 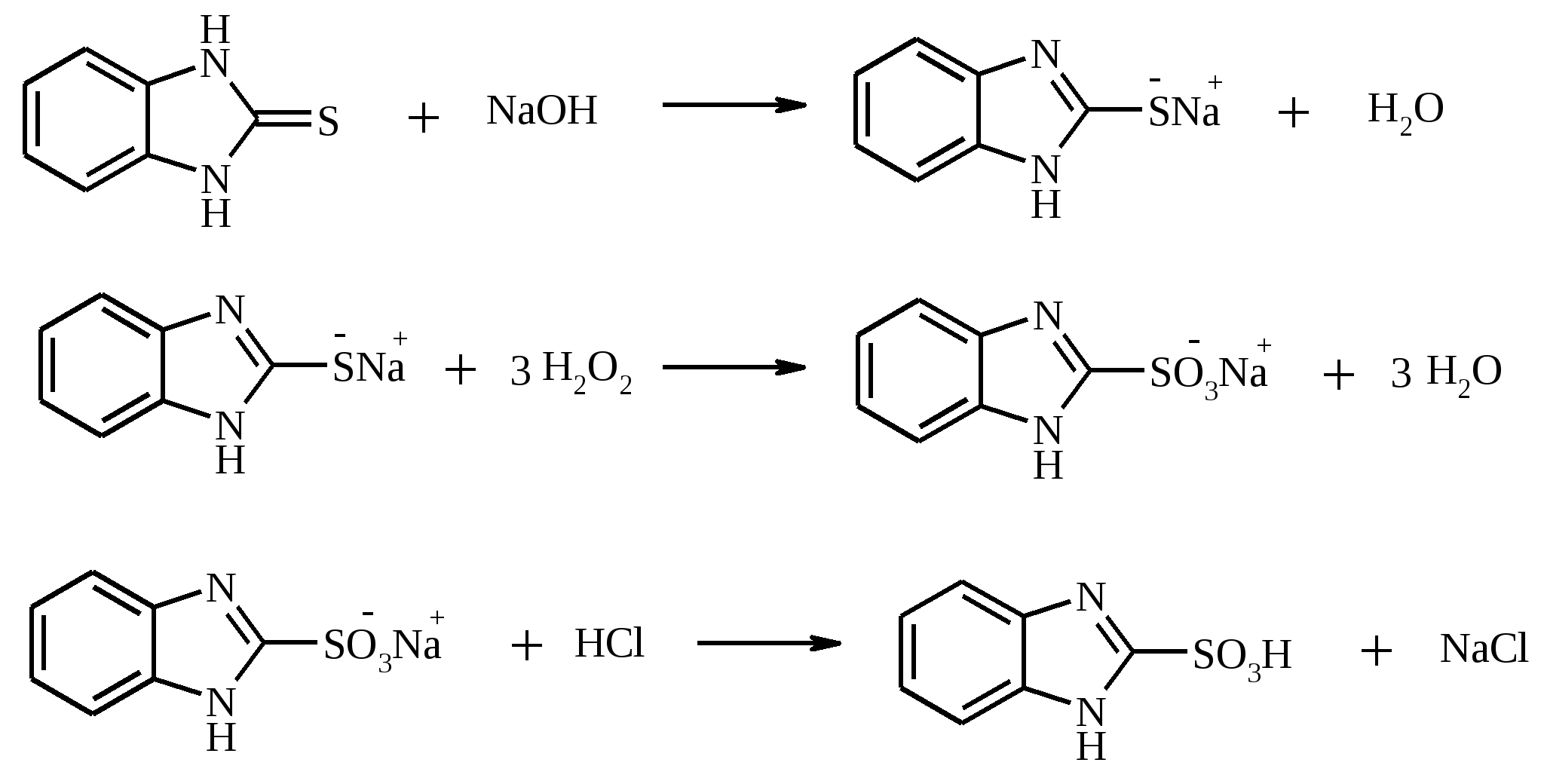
В трехгорлой колбе, снабженной мешалкой, термометром и капельной воронкой (Не допускать герметичности прибора!), растворяют 7.5 г (0.05 моль) 2-меркаптобензимидазола в растворе 4 г (0.1 моль) NaOH в 200 мл воды. Полученный раствор охлаждают до 20ºС и прибавляют к нему по каплям при энергичном перемешивании и охлаждении ледяной водой 30 мл 30%-ного раствора H2O2 с такой скоростью, чтобы температура реакционной массы не поднималась выше 37-40ºС. Первые 10-15 мл пероксида водорода необходимо добавлять особенно осторожно, так как вследствие сильного разогревания возможен выброс реакционной массы. По окончании прибавления H2O2 смесь перемешивают при комнатной температуре еще 4 ч, а затем оставляют на ночь. Далее раствор при необходимости фильтруют и подкисляют конц. HCl до pH 1-2. Белоснежный осадок бензимидазол-2-сульфокислоты отфильтровывают из охлажденного раствора, тщательно промывают ледяной водой, ацетоном и высушивают при 100-120ºС. Выход около 7 г (70%), т. пл. 365-368ºС. 18. ВОПРОСЫ И УПРАЖНЕНИЯ ДЛЯ САМОКОНТРОЛЯ
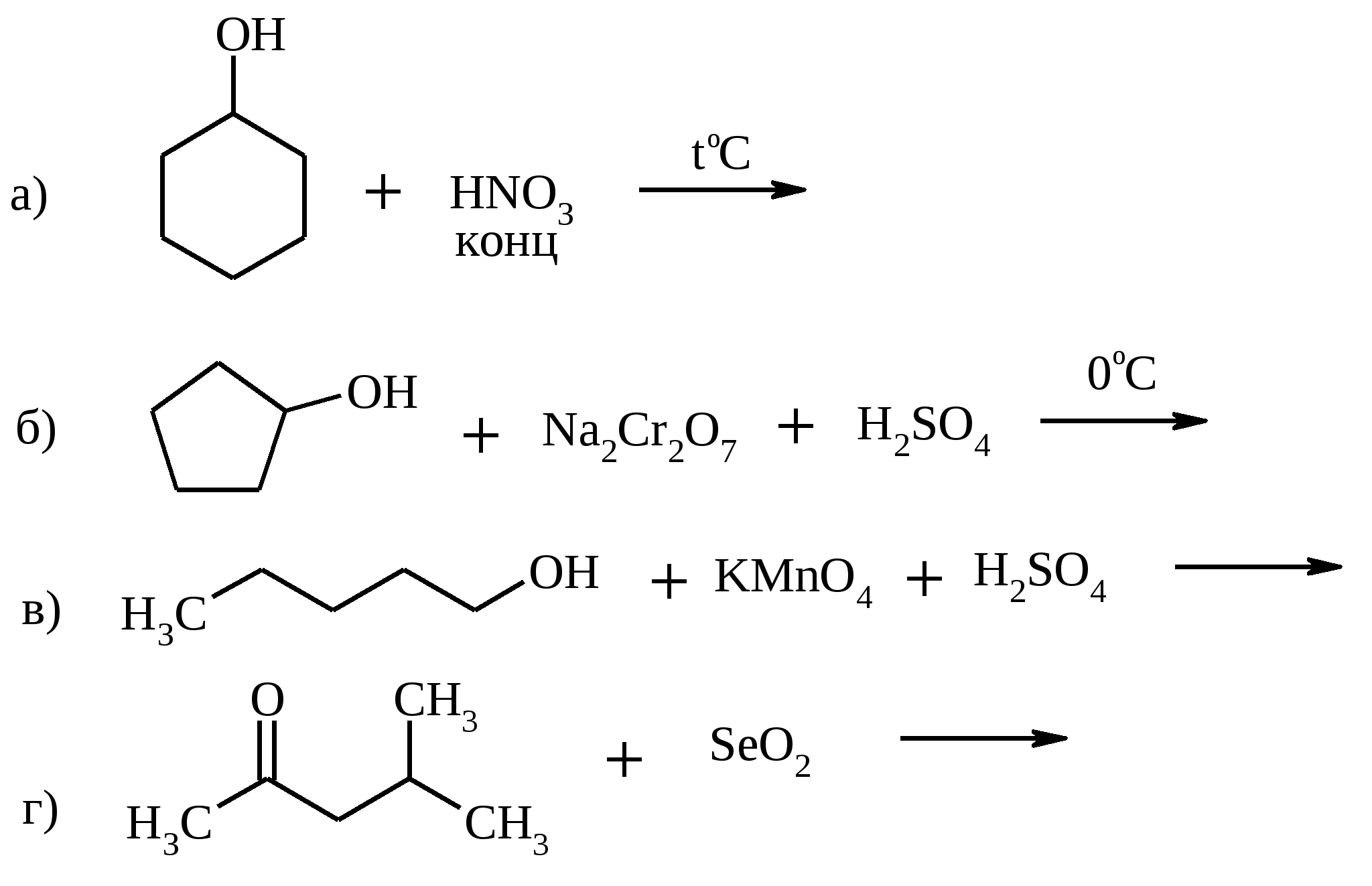 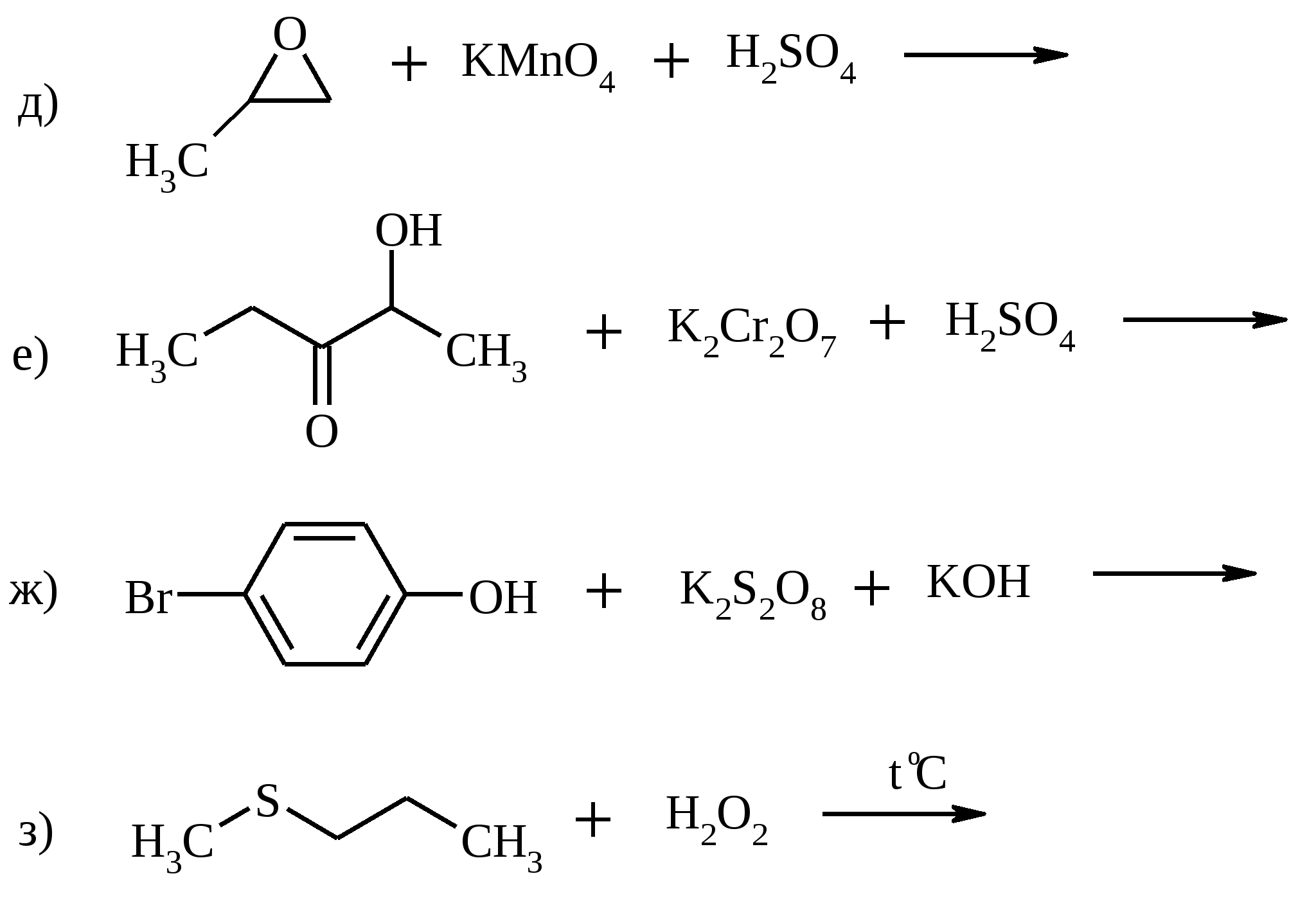 

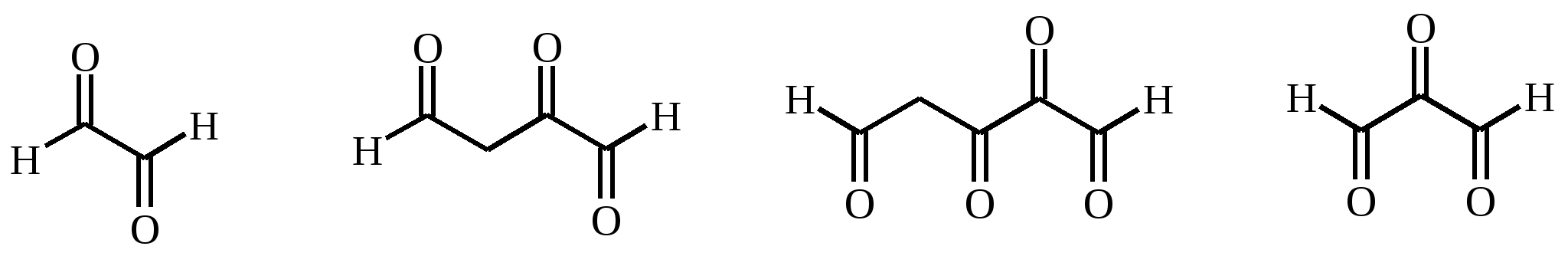 Установите строение углеводорода.
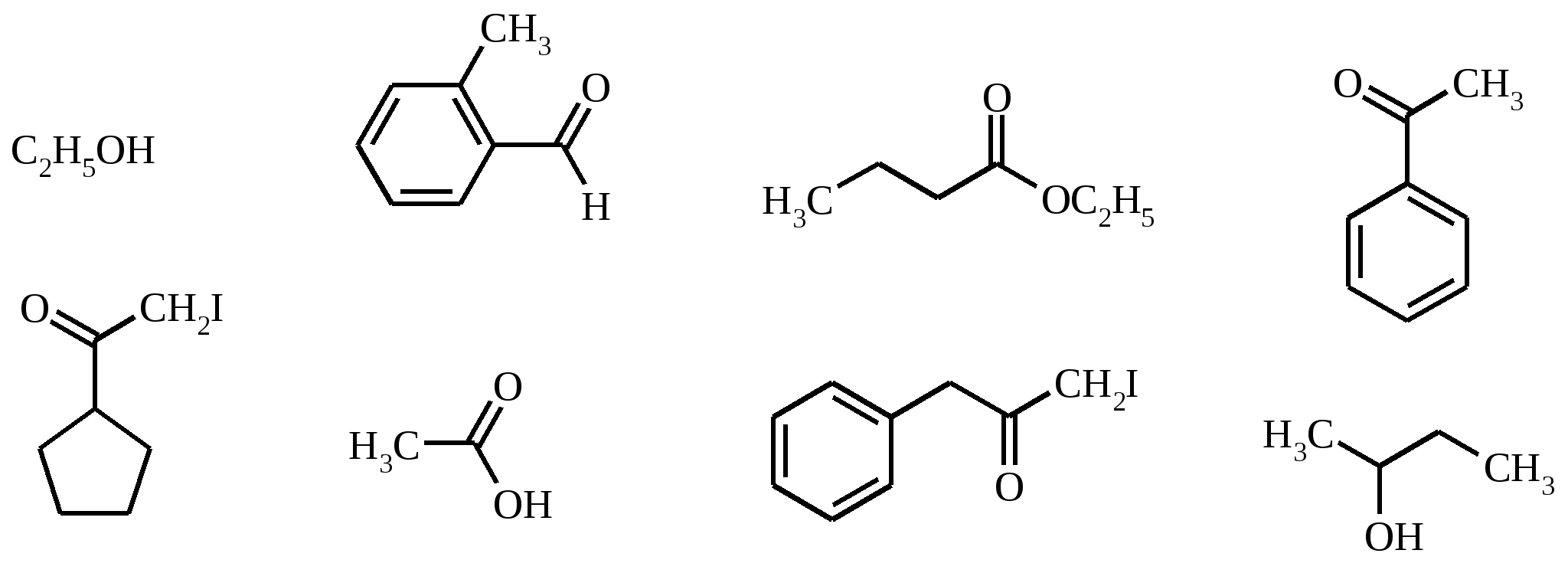 8. Какие продукты образуются при действии аммиачного раствора оксида серебра на бутилформиат?
 БИБЛИОГРАФИЧЕСКИЙ СПИСОК
Учебное издание ОСЯНИН Виталий Александрович КЛИМОЧКИН Юрий Николаевич ВОССТАНОВЛЕНИЕРедактор С. И. К о с т е р и н а Технический редактор В. Ф. Е л и с е е в а Оригинал-макет Е. Э. Парсаданян Подп. в печать 02.05.06 Формат 60х84 1/16. Бумага офсетная. Печать офсетная. Усл.п.л. 4,88. Усл.кр.-отт. 4,88. Уч.-изд.л. 4,79 Тираж 100 экз. С.-115 _____________________________________________________________________________________________ Государственное образовательное учреждение высшего профессионального образования «Самарский государственный технический университет» 443100. г. Самара, ул. Молодогвардейская, 244. Главный корпус Отпечатано в типографии Самарского государственноготехнического университета443100. г. Самара, ул. Молодогвардейская, 244. Корпус №8 |
