Физиология как наука
 Скачать 0.79 Mb. Скачать 0.79 Mb.
|
Клинико-физиологическая оценка содержания гемоглобинаСодержание гемоглобина: у мужчин 13-16 мг% (130-160 г/л), у женщин - 12-14 мг% (120-140 г/л). Гиперхромемия - увеличение содержания гемоглобина. Гипохромемия - снижение содержания гемоглобина/анемия Цветовой показательЦветовой показатель (ЦП) - отражает относительное насыщение эритроцитов гемоглобином. Найденное количество гемоглобина отнесенное к количеству эритроцитов, разделить на отношение количество гемоглобина в норме отнесенное к количеству эритроцитов в норме. В норме ЦП составляет от 0,8 до 1,0 - эти эритроциты называют нормохромными. Если ЦП больше 1,0, то это состояние называют гиперхромией , а а эритроциты гиперхромными, а если ЦП меньше 0,8 - гипохромией, а эритроциты - гипохромными. Свойства эритроцитов Гемолиз - это разрушение оболочки эритроцита и выход его содержимого в плазму. Факторы, вызывающие гемолиз: 1. Физические - сильное нагревание, замораживание, встряхивание ампул с кровью. 2. Химические - кислоты, щелочи- коагулируют белки мембраны, эфир, хлороформ, бензол. нитриты, анилин, сапонины- жирорастворители, действуют на фосфолипиды мембраны. 3. Физико-химические - прежде всего изменение осмотического давления. 4. Биологические – старение эритроцитов, нарушение обмена белков и/или жиров, приводящие к нарушению структуры мембран, иммунный гемолиз/групповая несовместимость крови, аутоантитела к эритроцитам/, яды змей, токсины микробов (гемолитический стрептококк). Эти факторы снижают резистентность /устойчивость/ оболочки эритроцитов к разрушению. Виды гемолизаВнутриклеточный гемолиз- стареющие эритроциты разрушаются в ретикулоэндотелиальной ткани селезенки, печени, фагоцитируются макрофагами. Внутрисосудистый гемолиз- эритроциты способны гемолизироваться /разрушаться/, находясь в циркулирующей крови. Небольшая часть разрушается так даже в норме. Различные факторы включают один из……или оба вида гемолиза. Для оценки устойчивости мембран эритроцитов проводят определение in vitro: Осмотическая резистентность эритроцитовУменьшение осмотического давления крови приводит в начале к набуханию, а затем к разрушению эритроцитов - осмотический гемолиз. Мерой осмотической резистентности эритроцитов (ОРЭ) является концентрация NaCI. Отмечают концентрацию NaCI, предшествующую началу гемолиза - min ОРЭ и концентрацию, предшествующую окончанию гемолиза - max ОРЭ. В норме min ОРЭ составляет от 0,46 до 0,48% NaCI ,а max ОРЭ - от 0,32 до 0,34% NaCI. Нередко определяют кислотную резистентность эритроцитов. В основе также лежит принцип разведения. Скорость оседания эритроцитов Если предохранить кровь от свертывания, то при ее стоянии эритроциты оседают. Факторы, влияющие на величину скорости оседания эритроцитов (СОЭ): 1. Белки плазмы крови - при увеличении в плазме крови концентрации белков, особенно грубодисперсных, СОЭ увеличивается. 2. Количество эритроцитов - увеличение количества эритроцитов и приводит к замедлению СОЭ. Возможно физиологическое увеличение СОЭ (при беременности, тяжелой мышечной работе) и патологическое - как правило при патологиях воспалительного характера. В норме СОЭ составляет: у мужчин - нижняя граница 4 мм/час, верхняя - 12 мм/час; у женщин - нижняя граница - 4 мм/час, верхняя - 16 мм /час. 47. Понятие о системах групп крови… В настоящее время установлено, что каждая клетка человеческого организ ма, в том числе и эритроцит, содержит на своей поверхности набор специфиче ских белков - Антигенов, закрепленных генетически, которые и обеспечивают её видовую и индивидуальную специфичность. Кроме антигенов существует и второй класс белков - антитела к антиге нам, которые циркулируют в плазме крови и при взаимодействии с определен ным антигеном, расположенным на мембране клетки, способны вызывать реакцию агглютинации, образуя т.н. агглютинационные пары. На данный момент на поверхности эритроцита обнаружено более 300 раз лич ных антигенов, ряд из которых объединен в более чем 20 систем, по которым кровь подразделяется на определенные группы (АВО, Rh-Hr, Кел-Челлано, М, N, S, Даффи, Льюис, Диего, Лютеран и т.д.). Т.о., принадлежность человека к той или иной группе крови по различным системам обусловлена генетически, является индивидуальной особенностью и не изменяется в течение всей жизни. Наиболее важной и практически значимой является система АВО. В основу деления людей на группы крови по этой системе положено нали чие или отсутствие на поверхности эритроцитов белков-антигенов (агглютиногенов) А и В. Антигенам А и В соответствуют антитела, обозначаемые буквами греческого алфавита и , названные агглютининами. Агглютиноген А и агглютинин , агглютиноген В и агглютинин - образуют т.н. агглютинационные пары. В норме в крови у человека таких комби на ций не встречается, т.е. при отсутствии агглютиногена А в его плазме крови находится агглютинин и наоборот. Исходя из этих положений и образуются 4 возможные комбинации антигенов и антител, т.е. система АВО включает в себя 4 группы крови:
Классификация по системе АВО: 1. I (0) группа - в эритроцитах не содержатся агглютиногены А и В, в плазме крови имеются агглютинины и . 2. II (A) группа - в эритроцитах у людей с этой группой крови имеется агглютиноген А, а в плазме крови - агглютинин . 3. III (B) группа - в эритроцитах у людей с этой группой крови имеется агглютиноген В, а в плазме крови - агглютинин . 4. IV (АВ) группа - у людей в этой группой крови в эритроцитах имеются агглютиногены А и В, при этом в плазме крови агглютинины отсутствуют. Агглютиногены А и В неоднородны по своей структуре, т.е. можно выделить подгрупповые факторы, например А1, А2........, В1, В2......., и т.д. Система АВО впервые описана в 1901 году австрийским ученым Ландштей нером. Лишь через 30 лет после этого открытия он был удостоен Нобелевской премии. Антитела и являются врожденными. Наиболее интенсивно соответствующие агглютинины вырабатываются в возрасте 8-10 лет. Антитела и по своей природе являются соответственно иммуногло бу ли нами М и G, т.е. представляют собой крупномолекулярные белки, не способные проникать через сосудистую стенку, в частности, через фетоплацен тарный барьер во время беременности, что делает невозможным развитие ситуаций, подобных Резус-конфликту, о котором речь пойдет ниже. Система резус (Rh-Hr) Эта следующая по значимости система крови была открыта в 1940 году всё тем же Ландштейнером совместно с Винером впервые у макак (Makakus rhezus). Впоследствии оказалось, что и у 85% людей в эритроцитах содержится белок, названный резус-фактором (Rh-фактор). Людей, на эритроцитах которых есть Rh-фактор, называют резус-положительными, а у которых он отсутствует - резус-отрицательными. Наследуется Rh-фактор как доминантный признак, т.е. будет проявляться фенотипически и в гетерозиготном состоянии. В настоящее время установлено, что Резус-фактор наследуется с помощью 3-х антигенов: C, D и Е, однако из них только на D-антиген вырабатываются антитела. Таким образом, резус-положительными называются люди, имеющие на поверхности своих эритроцитов D-антиген. Существуют отдельные народы (н-р: эвены) со 100% Резус-положительным населением. Среди европеоидов 85% резус-положительных Особенностью данной системы и отличием от системы АВО является то, что против Rh-фактора нет врожденных антител, однако они могут быть выработаны в следующих ситуациях: 1. Если Rh-положительную кровь перелить Rh-отрицательному пациенту. 2. При беременности Rh-отрицательной женщины Rh-положительным плодом. Для иммунизации достаточно 0,25 мл Rh(+) крови. Rh-антитела, в отличие от агглютининов и , являются не полными, следовательно, их молекулярный вес позволяет им проникать через плацентарный барьер из материнского крово тока в кровоток плода, что, при достаточной концентрации антител может привести к развитию резус-конфликта. Резус-конфликт может развиться: 1. При повторном переливании Rh-положительной крови Rh-отрицательному пациенту (очень редкая ситуация, страдает реципиент). 2. При повторной беременности Rh-отрицательной женщины Rh-положительным плодом. Эту ситуацию называют резус-конфликтом матери и плода (встречается гораздо чаще, страдает плод: варианты - от гемолитической желтухи новорожденных до внутриутробной гибели плода). В настоящее время, чтобы избежать Резус-конфликта, таким матерям из группы риска при абортах и родах вводят концентрированные анти-D-антитела, которые агглютинируют Rh(+) эритроциты плода в кровотоке матери и не дают её организму выработать собственные анти-D-антитела. Правила переливания крови: Если можно не переливать, то не переливать ! (т.е. по возможности переливать не цельную кровь, а кровезаменители либо отдельные фракции или компоненты крови, в зависимости от конкретных показаний). 1. Определение групп крови донора и реципиента по системе АВО. Методы определения групп крови: а. Определение групп крови по стандартным сывороткам. б. Определение групп крови по стандартным эритроцитам. в. Перекрестный метод (и по стандартным сывороткам, и по эритроцитам). г. Определение групп крови по моноклональным антителам (к антигенам по системе АВО). 2. Определение резус-принадлежности. 3. Проведение пробы на индивидуальную совместимость (смешивают по одной капле кровь донора и реципиента) - контроль совместимости по другим системам крови (нельзя постоянно переливать кровь от одного донора - м.б. иммунизация по другим системам крови). 4. Проведение пробы на биологическую совместимость (переливают по 10-15 мл крови и выжидают 20 минут, затем повторяют процедуру, т.к. возможно появление клиники гемотрансфузионного шока). Клиника гемотрансфузионного шока: 1. Реакция агглютинации - агглютинаты блокируют зону микроциркуляции - ишемия тканей - боли в пояснице, одышка, акроцианоз, рефлекторный кашель. 2. Гемолиз - значительное повышение вязкости крови, выход тканевых тромбопластинов (обломки мембран эритроцитов). 3. ДВС-синдром. Для того, чтобы произошла агглютинация, необходимы следующие условия: 1. Наличие агглютинационной пары. 2. Достаточная концентрация агглютининов. Так, если небольшое количество крови I группы (до 500 мл) ввести в кровеносное русло человеку со II группой, то произойдет разведение агглютининов, они станут неактивными и реакция агглютинации не произойдет. В настоящее время в плановом порядкепереливается только одногруппная кровь! Однако, в полевых условиях, при экстремальных ситуациях необходимо помнить о втором условии агглютинации. Это позволяет однократно, в объеме до 500 мл использовать для переливания кровь I группы в качестве универсаль ной по жизненным показаниям (см. схему совместимости групп крови) . Таким образом, люди с I группой крови являются "универсальными донорами", а с IV - "универсальными реципиентами". Методы переливания крови: 1. Прямое (по экстренным показаниям, через шприц с тройником и зажимом). 2. Струйное (по экстренным показаниям, донорская стабилизированная кровь). 3. Капельное (по плановым показаниям, донорская стабилизированная кровь). 48. Понятие о гемостазе… Система гемостаза - совокупность процессов, направленных, с одной стороны, на предупреждение и остановку кровотечения, а с другой - на сохране ние жидкого состояния циркулирующей крови. Задача - поддержание адекватного состояния жидкостных характеристик крови. Процессы находятся в динамическом равновесии. Нарушение его будет проявляться: свертываемости тромбозы, ДВС-синдром. противосвертывающей активности - гемофилии, кровоточивость. Эволюционно более сильна противосвертывающая система, т.к. физиоло гические функции кровь может выполнять только в жидком состоянии. свертывание может увеличиваться лишь локально, затем образовав ший ся сгусток будет удален. Однако при нарушении имеющегося равновесия возможно развитие ДВС. Виды гемостаза: 1. Сосудисто-тромбоцитарный (в 90 % случаев повреждаются мелкие сосуды диаметром до 100 мкм). 2. Плазменный (собственно свертывание крови или гемокоагуляция, обеспечивает остановку кровотечения из более крупных сосудов). 1. Сосудистый компонент: - спазм сосуда при травме (за счет болевой реакции; механического раздражения сосуда; действия БАВ(серотонина, адреналина). - уменьшается просвет сосуда и за счет вворачивания интимы, при этом обнажаются волокна коллагена, что имеет важное значение для активации тромбоцитарного гемостаза. Уже только эти компоненты значительно уменьшают кровотечение, а иногда и могут его остановить. 2. Тромбоцитарный гемостаз: Тромбоциты Как лекоциты выполняют в основном защитную функцию, так тромбоци ты прежде всего участвуют в свертывании крови. Тромбоциты - "кровянные пластнки", безъядерные клетки крови, имеют двояковыпуклую форму. Размер - 0,5 - 4 мкм (самые мелкие клетки крови). В норме в 1 мм3 крови - 200.000 - 400.000 штук тромбоцитов. - тромбоцитоз. - тромбоцитопения, М.б. и при нормальном содержании тромбоцитов в крови наблюдаться патология со стороны функций тромбоцитов - при тромбоцитопатиях. Продолжительность жизни - 8-12 дней. Образуются в красном костном мозге из мегакариоцитов (тромбоцитопоэз). Функции тромбоцитов: 1. Ангиотрофическая - ежедневно поглощается 35.000 тромбоцитов из 1 мм3 крови за сутки ( 15 % всех циркулирующих тромбоцитов). После глубокой тромбоцитопении через 30 минут 85-90% всех тромбоци тов оказывается в эндотелии. Т.о. сам эндотелий не может поглощать вещества из плазмы (тромбоциты смыкаются с эндотелием и изливают в них свое содержимое). Исходя из этого, при тромбоцитопениях наблюдается дистрофия эндоте лия (пропускает эритроциты (диапедез), петехии (синяки, точечные кровоизлияния). 2. Участие в регенерации сосудистой стенки (стимулируют размножение эндотелиальных и гладкомышечных клеток, синтез волокон коллагена). 3. Способность поддерживать спазм поврежденных сосудов (высвобождают серотонин, катехоламины, тромбомодулин, тромбоксан). 4. Участие тромбоцитарных факторов в процессах свертывания крови и фибринолиза. 5. Адгезивно-агрегационная функция (образование первичной тромбоци тарной пробки). 1. Адгезия (прилипание активированных тромбоцитов к чужеродной поверхности). Наиболее важные стимуляторы адгезии - волокна коллагена ("+" заряженные группировки), а также кофактор адгезии - ф. Виллебранда. 2. Агрегация - слияние тромбоцитов в однородную массу, формирование гомогенного тромбоцитарного тромба за счет переплетения псевдоподий. 3. Реакция высвобождения (дегрануляция индукторов агрегации и веществ, поддерживающих спазм сосудов (АДФ, серотонин, тромбин, адреналин, тромбо ксан А2(мощный стимулятор агрегации и ангиоспазма)), а также тромбоцитар ных факторов свертывания (их 16, обозначаются арабскими цифрами). 4. Ретракция сгустка - (т.к. тромбоцит в псевдоподиях содержит белки, подобные актину и миозину. При взаимодействии с Са+2 - происходит сокраще ние, в результате чего сгусток уменьшается в объеме, уплотняется. При этом ближе стягиваются и поврежденные ткани, что способствует скорейшей регенерации тканей). 49. Процесс свертывания крови… Гемокоагуляция (собственно свертывание крови) Основные положения теории свертывания крови (А.А. Шмидт, 1895 год, Тартуский университет (Эстония)): 1. Процесс свертывания крови - стадийный. 2. Очередная стадия завершается образованием активного фермента (т.е. свертывание - процесс ферментативный). 3. Продукт предыдущей стадии является активатором (ферментом) для последующей стадии (т.е. свертывание - процесс каскадный). В современной теории свертывания крови различают 3 фазы свертывания: 1 фаза - образование протромбиназного комплекса; 2 фаза - образование тромбина; 3 фаза - образование фибрина. Международный комитет по номенклатуре факторов свертывания крови обозначил плазменные факторы римскими цифрами в порядке хронологического открытия, всего их по количеству тринадцать (I-XIII, IIа - активированный фактор). Факторы V и VI - проакцелерин и акцелерин представляют неактивную и активную форму одного и того же фактора, поэтому термин "фактор VI " не применяют. Ряд факторов свертывания имеет названия по фамилии больных, у которых был впервые обнаружен их дефицит. Кроме того, в плазменном гемостазе участвуют тромбоцитарные факторы (их обозначают арабскими цифрами, 1-16). Различают внутренний и внешний пути активации плазменного гемостаза. Внутренний путь начинается с активации XII фактора (фактор Хагемана, фактор контактной активации). Активация наступает после его контакта с чужеродной поверхностью (отрицательно заряженные группировки коллагена, поврежденные клетки эндотелия, протеазы (трипсин, калликреин), адреналин). В чистом виде внутренний механизм свертывания крови может иметь место при сосудистых стазах или в пробирке (рассмотреть схему свертывания). Внешний путь активации плазменного гемостаза начинается с появления в кровотоке III фактора свертывания (тканевый тромбопластин, представляет собой фосфолипидные фрагменты мембран разрушенных клеток). Под его воз дей ствием активируется VII фактор свертывания, непосредственно воздействую щий на X фактор протромбиназного комплекса. Этот путь свертывания крови - значительно более быстрый (14-17 секунд против 5-10 минут при активации по внутреннему пути). 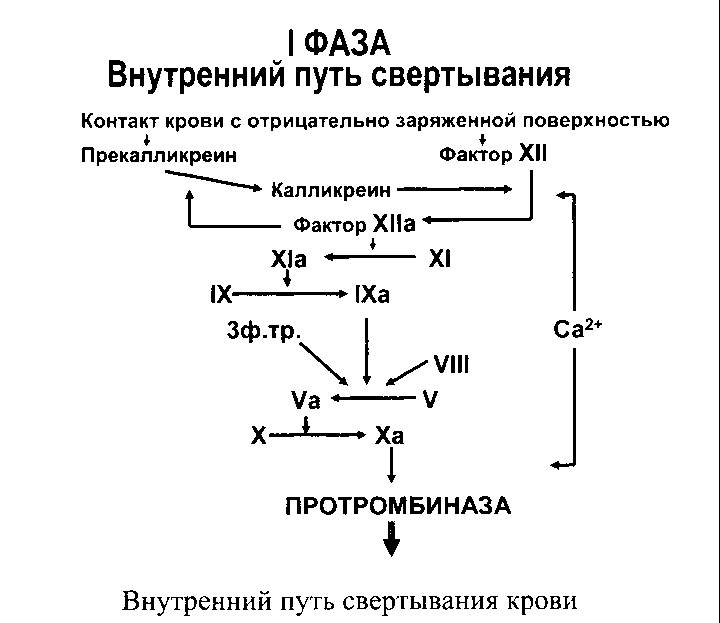 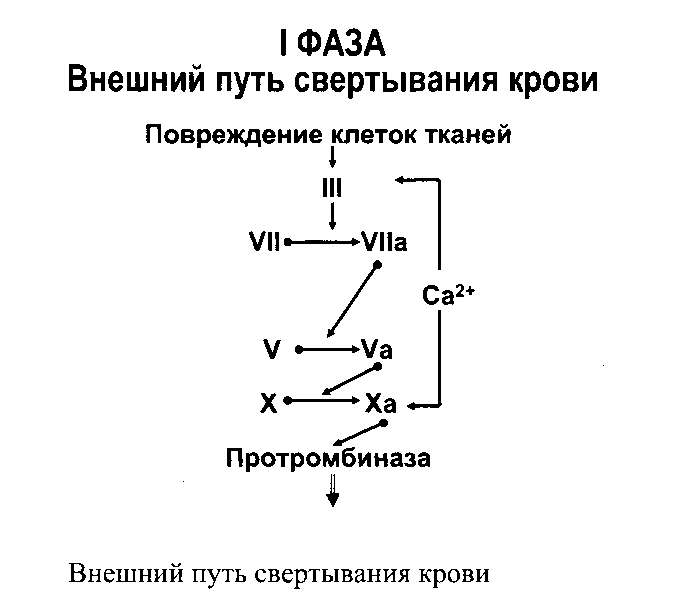 Возможна патология активации свертывания по внутреннему пути - гемофилии (А - дефицит VIII ф. (встречается чаще всего), В - дефицит IX ф. и С - дефицит XI ф.). При этом внешний путь активации у таких больных не страдает. 50. Противосвертывающие факторы… Противосвертывающая система обеспечивает поддержание крови в жидком состоянии. Механизмы, обеспечивающие жидкое состояние крови: 1. В норме сосудистая стенка препятствует свертыванию крови: - т.к. у эндотелия - контактная инертность (предотвращает активацию XII фактора); - синтезирует простациклин, (антиагрегант и вазодилятатор); - имеет на мембране эндотелия гликопротеин тромбомодулин, связываю щий тромбин (не свертывает кровь, но активирует антикоагулянты- протеины С и S). - имеет одноименный электрический заряд с форменными элементами крови; - адсорбирует активные факторы свертывания, особенно тромбин; 2. Большая скорость течения крови; 3. Наличие антикоагулянтов. Антикоагулянты - это вещества, препятствующие свертыванию крови. Имеющиеся в организме антикоагулянты можно разделить на две группы: 1. Предсуществующие (первичные) - антитромбин III , 2 - макроглобулин (антитромбин IV), гепарин, протеины "С" и "S". а). Антитромбин III - обеспечивает 75% всей антикоагулянтной активности плазмы. Основной плазменный кофактор гепарина, ингибирует активность тромбина, фф. VIIa, IXa, Xa, XIIa. б). Гепарин - сульфатированный полисахарид. Образует комплекс с антитромбином III, превращая его в антикоагулянт немедленного действия, что в 1000 раз усиливает его эффекты. в). Протеины "С" и "S" - синтезируются в печени при участии витамина К. Протеин "С" инактивирует ф. Va, VIIIa. Протеин "S" снижает способность тромбина активировать ф. Va, VIIIa. г). 2 - макроглобулин - 10-25% антикоагулянтной активности плазмы. 2. Образующиеся в процессе свертывания крови и фибринолиза (вторичные) антикоагулянты: а). Нити фибрина - (антитромбин I) адсорбируют на себе до 85-90% тромбина крови. Это помогает сконцентрировать тромбин в формирующемся сгустке и предотвратить его распространение по току крови (препятствует ДВС). б). ПДФ - продукты деградации фибрина, нарушают полимеризацию ФМ, ингибируют фибринолиз и агрегацию тромбоцитов. Фибринолиз Главная функция фибринолиза - реканализация (восстановление просвета) закупоренного тромбом сосуда. Основу тромба составляет фибрин. Расщепление фибрина осуществляется протеолитическим ферментом - плазмином. Система фибринолиза, как и система свертывания крови, имеет внутренний и внешний механизмы активации. Внутренний механизм - за счет ферментов самой крови (XIIа, калликреин). Внешний механизм - за счет тканевых активаторов, которые вырабатываются: - внутренними органами (почки, печень, легкие - н-р: урокиназа); - форменными элементами крови (лейкоциты); - микроорганизмами (золотистый стрептококк, стафиллококк - н-р: стрептокиназа). Конечным итогом деятельности фибринолитической системы является рас щепление фибрина до пептидов (ПДФ) и аминокислот. Процесс фибринолиза заканчивается в норме через 4-5 дней. Столько же длится регенерация повре ж ден ного сосуда. Т.е. эти два процесса в ходе эволюции были синхронизи рованы. 51. Физиологические свойства сердечной мышцы… Физиологические свойства сердечной мышцы: Возбудимость, проводимость, сократимость, автоматия. Автоматия - способность органа приходить в состояние возбуждения под действием импульсов, возникающих в самом органе. Автоматией обладают клетки проводящей системы сердца. Проводящая система сердца образована атипичными кардиомиоцитами, которые имеют, по сравнению с другими кардиомиоцитами, меньше сократительных белков, митохондрий, т.е. основная функция данных клеток - не сокращение, а генера ция импульсов и проведение возбуждения. Скопления атипичных кардиомиоцитов в сердце: синоатриальный узел, атриовентрикулярный узел, пучок Гиса, ножки пучка Гиса, волокна Пуркинье. Все эти образования атипичной мускулатуры обладают автоматией. Однако способность к автоматии у разных часте проводящей системы сердца различна (эксперимент с питательной средой и выращиванием культуры атипичных клеток, взятых из различных участков сердца): частота их сокращений сначала была различна (80, 40, 10, 1 импульс в минуту). Однако, по мере образования межклеточных морфологических контактов все клетки стали сокращаться в одном ритме, причем с частотой, характерной для самых активных клеток. Способность клеток к автоматии: синоатриальный узел - 80 в мин., атриовентри ку лярный узел - 30 - 40 в мин., пучок Гиса - 10 в мин., волокна Пуркинье - 0,5-1 в мин. Это явление уменьшения автоматии по мере удаления от синоатриального узла (от основания к верхушке) называется убывающим градиентом автоматии. Синоатриальный узел получил название водителя ритма(пейсмейкер) первого порядка, т.к. задает ритм всему сердцу и угнетает автоматию других образо ваний. Водителем ритма(пейсмейкер) 2-го порядка называется атриовентрику ляр ный узел. Водитель ритма(пейсмейкер) третьего порядка и т.д. Опыты Гаскела и Станниуса подтверждают изложенные положения. |
