ФУНКЦИОНАЛЬНАЯ БИОХИМИЯ. Функциональная биохимия
 Скачать 2.5 Mb. Скачать 2.5 Mb.
|
|
Турбидиметрический метод определения уровня серогликоидов в сыворотке крови Принцип метода. При добавлении к сыворотке крови раствора хлорной кислоты белки выпадают в осадок, а серогликоиды остаются растворенными в реактиве, из которого могут быть выделены путем осаждения фосфорновольфрамовой кислотой. По степени помутнения раствора судят о содержании серогликоидов в исследуемом материале. Реактивы: раствор хлористого натрия, 8,5 г/л.; раствор хлорной кислоты (НОСlO4), 1,8 моль/л. Ход работы. 0,5 мл сыворотки смешивают с 4,5 мл раствора хлорида натрия (реактив I)и добавляют по каплям 2,5 мл раствора хлорной кислоты. Содержимое пробирки тщательно перемешивают стеклянной палочкой, оставляют на 10 мин при комнатной температуре, центрифугируют 15 мин при 2000—2500 об/мин на общеклинической центрифуге (типа ОПН-3). Отбирают 5,0 мл центрифугата, к которому добавляют 1,0 мл фосфорновольфрамовой кислоты и через 15 мин определяют оптическую плотность смеси при красном светофильтре ФЭКа (или другого фотометрического прибора) в кювете с толщиной слоя 10 мм. Результаты сравнивают с показателями контрольной пробы, которую готовят смешиванием 3,3 мл раствора хлорида натрия с 1,7 мл раствора хлорной кислоты и с 1,0 мл раствора фосфорновольфрамовой кислоты. Разница в их значениях (единицы абсорбции, учтенные до третьего знака после запятой) отражает содержание серогликоидов в сыворотке крови. Уровень серогликоидов в сыворотке крови практически здоровых взрослых людей составляет 0,130—0,200 усл. ед. (ед. абсорбции). Клинико-диагностическое значение. Общее содержание серогликоидов (наиболее лабильной фракции гликопротеинов) увеличивается при воспалительных и некробиотических процессах, в том числе при желтушном синдроме (особенно на почве новообразования), злокачественных опухолях, обострении хронического холецистита, деструктивной форме туберкулеза легких, ревматизме, инфаркте миокарда, инсульте (мозговом). Уровень серогликоидов снижается при нарушении протео-синтетической функции печени — инфекционном гепатите, ге-патоцеллюлярной дистрофии, а также при рассеянном склерозе. Для резкого нарушения функции печени характерно снижение содержания преалъбумина; в связи с этим фракционирование серогликоидов (методом электрофореза на агарозе, полиакрил-амидном геле) считается целесообразным для выявления воспалительного процесса у больных хроническим гепатитом и циррозом печени. Контрольные вопросы 1. Химические структурные компоненты основного вещества соединительной ткани (СТ), их соотношение.
11.Строение эластина, его биологическая функция. 12. Назовите субстраты, необходимые для синтеза углеводных компонентов основного вещества СТ. 13. Принципы построения мономеров кислых гликозаминогликанов? 14. Назвать сульфатированные гликозоаминогликаны. Каковы их строение и биологическая роль? 15. Сиаловые кислоты. Их строение и роль в формировании структур СТ. 16. Диагностическое значение определения сиаловых кислот в сыворотке крови. 17. Назовите витамины, принимающие участие в реакциях метаболизма СТ. Контрольные задачи Тесты: 1. Укажите правильный порядок этапов биосинтеза коллагена и образования коллагеновых волокон (например,3→ 4 → и т.д.): 1. Фибриллогенез. 2. Гидроксилирование пролина и лизина. 3. Образование прколлагена. 4. Гликозилирование. 5. Отщепление N- и С-концевых фрагментов. 6. Образование коллагеновых волокон. 7. Синтез пептидных цепей проколлагена. 2. Какие последствия может иметь недостаток витамина С в организме? 1. Снижение активности пролилигидроксиназы фибробластов. 2. Уменьшение прочности структуры коллагена. 3. Повышение количества оксипроина в коллагене. 4. Снижение количества оксипролина в коллагене. 5. Уменьшение скорости гликозилирования оксипролина. 6. Увеличение количества водородных связей между полипептидными цепями коллагена. 3. Выберите положения, правильно характеризующие зластин. 1. Эластин является фибрилярным белком. 2. Эластин способен к обратимому растяжению. 3. Эластин располагается в стенках крупных сосудов, обеспечивая их упругие свойства. 4. Эластин преобладает в структуре крупных сухожилий. 5. Десмозин обеспечивает сетчатую структуру эластина. 4. А. Какие из компонентов необходимы для проявления активности аминооксидазы лизина? 1. О2. 3. Витамин С. 2. Ионы меди. 4. Витамин В1 Б. Из предложенных утверждений выберите те, которые правильно характеризуют последствия недостаточности аминооксидазы лизина. 1. Нарушается синтез десмозина. 2. Увеличивается количество растворимого эластина. 3. Уменьшается прочность эластина. 4. Уменьшается прочность аорты. 5. В эластине увеличивается количество лизина и снижается количество десмозина. 5. Выберите положения, правильно характеризующие состав и строение фибронектина. 1. Является липопротеином. 2. Является гликопротеином. 3. Имеет доменную структуру. 4. Является простым белком. 5. Имеет несколько центров связывания (поливалентный белок). 6. Является металлопротеином. 6. Выберите утверждения, правильно характеризующие структуру и биологическую роль протеогликанов. 1. Составным компонентом являются гликозамингликаны. 2. Белок составляет 5-10% от массы протеогликанов. 3. Белок составляет 20-30% от массы протеогликанов. 4. Составляют основную массу межклеточного матрикса соединительной ткани. 5. Образуют гелеобразные структуры. 6. Связаны со структурными белками соединительной ткани. 7. А. Коллаген. Б. Эластин. В. Оба. Г. Ни один. 1. Является структурным компонентом межклеточного матрикса. 2. Содержит много гидрофобных аминокислот. 3. Основной компонент межклеточного матрикса. 4. Содержит много остатков Асп и Глу. 8. Какие вещества являются структурными компонентами гиалуроновой кислоты: 1. Две молекулы мальтозы; 2. Две молекулы β-глюкозы; 3. Глюкозамин; 4. Галоктозамин, глюкуронат и серная кислота; 5. Глюкуронат, глюкозоамин и серная кислота? Ситуационные задачи Задача 1. Выберите причины, которые могут привести к нарушениям синтеза и созревания коллагена: А. мутации в генах коллагена; Б. дефекты ферментов, участвующих в пострансляционных изменениях коллагена; В. гиповитаминозы (витамины С, РР, В6); Г. снижение содержания кофакторов (Fe2+, Cu2+); Д. гиперпаратиреоидизм. Задача 2. Одна из форм коллагенового заболевания – синдром Элерса-Данлоса, сопровождающийся деформацией суставов и искривлением позвоночника, обусловлен недостаточностью проколлагенпептидаз. А. Изобразите схему строения проколлагена. Б. На схеме укажите место действия проколлагенпептидаз. В. Какой из этапов посттрансляционных изменений коллагена нарушен при этом заболевании? Задача 3. При гиперпаратиреоидизме увеличивается в моче количество оксипролина и количество кальция. Объясните этот факт. Задача 4. Системная склеродермия – заболевание, при котором увеличивается синтез коллагена, развивается фиброз кожи и внутренних органов. А. По какому компоненту мочи можно судить об интенсивности обмена коллагена и как он изменяется при этом заболевании? Б. Как изменится этот показатель при лечении больного стероидными препаратами, если известно, что они, в частности, угнетают образование мРНК прокаллогена (↑, ↓, ↔)? Задача 5. При изучении свойств клеток при малигнизации (превращение в злокачественные) обнаружено, что количество фибронектина на их поверхности снижается. А. Предположите, какое из свойств злокачественных клеток может явиться следствием этого факта. Б. Опишите химическую природу фибронектина и особенности его строения. Ответы на контрольные задачи 1. 7→ 2 → 4 → 3 → 5 → 1 → 6 2. 1, 2, 4, 5 3. 1, 2, 3, 5
Ответы на ситуационные задачи 1  . А, Б, В, Г . А, Б, В, Г2     . . N C В. частичный протеолиз проколлагенпептидазами 3. Избыток паратгормона разрушает костную ткань 4. ↑ оксипро –А. Б. - ↓ 5. Адгезия уменьшается, А.- увеличивается метастазирование; Б. –доменная структура и несколько центров связывания с компонентами матрикса Рекомендуемая литература 1. Биохимия. Под ред. Е.С. Северина, ГЭОТАР –Мед., Москва, 2004 г., стр. 687-720. 2. Биохимия. Краткий курс с упражнениями и задачами под редакцией Е.С. Северина, ГЭОТАР – Мед., Москва, 2002 г., стр. 162 – 177, 387-391. 3. Николаев А.Я. Биологическая химия., Мед. инф. агенство, Москва, 1998 г., стр. 399-411
6. Ашмарина И.П., Николаева А.Я. Сборник тестов и задач по биохимии под редакцией Издательство МГУ, 1996, стр. 224-230. 7. Пустовалова Л.М. «Практикум по биохимии». Издательство «Феникс», Ростов-на-Дону, 1999 стр.429-434. БИОХИМИЯ НЕРВНОЙ ТКАНИ Структура и функции нервной ткани. Особенности ее состава и метаболизма Структурно-функциональная единица нервной ткани — нейрон — связана с помощью дендритов и аксонов с такими же клетками и клетками других типов (секреторными, мышечными), разделенными синоптическими щелями. Связь между клетками осуществляется путем передачи сигнала от тела нейрона по аксону до синапса. В синоптическую щель выделяется вещество-медиатор. Медиатор вступает в связь с рецепторами на другой стороне синоптической щели, что обеспечивает восприятие сигнала и генерацию нового сигнала в клетке-акцепторе. Функции нервной ткани 1. Обеспечение связи с окружающей средой и осуществление адаптации к изменяющимся условиям внешней среды - генерация электрического сигнала (нервного импульса). 2. Осуществление высшего уровня регуляции метаболизма - проведение нервного импульса. 3. Запоминание и хранение информации. 4. Формирование эмоций и поведения. 5. Мышление. Особенности химического состава Нервная ткань состоит из трех клеточных элементов: нейронов (нервные клетки), нейроглии (системы клеток), окружающие нервные клетки в головном и спинном мозге и глиальных макрофагов. Нейроны сосредоточены в сером веществе (60-65% от вещества головного мозга). Белое вещество ЦНС и периферические нервы состоят главным образом из элементов нейроглии и их производного – миелина. Указанные отделы мозга различаются по количеству составляющих его веществ. Химический состав от серого и белого вещества головного мозга человека (в процентах от сырой массы)
Особенности метаболизма нервной ткани
4. Метаболизм нервной ткани определяется наличием гематоэнцефалического барьера (ГЭБ), обладающего избирательной проницаемостью для различных метаболитов и способствующего накоплению некоторых веществ в нервной ткани. Например, в нервной ткани на долю глутамата и аспартата приходится примерно 70-75% от общего количества аминокислот. Функции липидов нервной ткани: - структурная: входят в состав клеточных мембран нейронов; - диэлектрическая: обеспечивают надежную электрическую изоляцию; - защитная: ганглиозиды — активные антиоксиданты — ингибиторы перекисного окисления липидов (ПОЛ). При повреждении ткани мозга ганглиозиды способствуют ее заживлению; - регуляторная: фосфатидилинозиты — предшественники БАВ (биологически активные вещества) , рецепторы гормонов. Большая часть липидов нервной ткани находится в составе плазматических и субклеточных мембран нейронов и в миелиновых оболочках. В нервной ткани содержание липидов очень высокое. Особенностью нервной ткани является использование липидов в качестве пластического (структурного) материала, в то время как в других тканях эту функцию выполняют белки. Липиды представлены цереброзидами, ганглиозидами, сфингомиелинами, плазмалогенами, фосфатидилсеринами, фосфатидилхолинами, фосфатидилинозитами, фосфатидилэтаноламинами и холестерином. Миелиновые мембраны имеют 3 слоя белка и 2 слоя липидов, в которые входят фосфатидилсерин, цереброзиды, сфингомиелины и холестерин. Причем в каждом липидном слое миелиновой оболочки 5 слоев, 2 из которых холестерин, содержание которого достигает до 30%. Доказательством пластической роли липидов является замедленный обмен ВЖК в нервной ткани по сравнению с другими тканями организма. Особенность липидного состава нервной ткани: есть фосфолипиды (ФЛ), гликолипиды (ГЛ) и холестерин (ХС), нет нейтральных жиров. Эфиры холестерина встречаются только в участках активной миелинизации. Сам холестерин синтезируется интенсивно только в развивающемся мозге. В мозге взрослого человека низка активность ОМГ-КоА-редуктазы — ключевого фермента синтеза холестерина. Содержание свободных жирных кислот в мозге очень низкое. Некоторые нейромедиаторы после взаимодействия со специфическими рецепторами изменяют свою конформацию и конформацию фосфолипазы С, катализирующей расщепление связи в фосфатидилинозите между глицерином и остатком фосфата, в результате чего образуются фосфоинозитол и диацилглицерин — регуляторы внутриклеточного метаболизма. Диацилглицерин активирует протеинкиназу С, фосфоинозитол повышает концентрацию Са2+. Ионы кальция влияют на активность внутриклеточных ферментов и участвуют в работе сократительных элементов нервных клеток: микрофиламентов, обеспечивая передвижение различных веществ в теле нервной клетки, аксоне и растущем кончике аксона. Протеинкиназа С участвует в реакциях фосфорилирования белков внутри нервных клеток. Липиды постоянно обновляются. Скорость их обновления различна, но в целом низка. Синтез цереброзидов и ганглиозидов протекает с большой скоростью в развивающемся мозге в период миелинизации. У взрослых почти все цереброзиды (до 90%) находятся в миелиновых оболочках, а ганглиозиды — в нейронах. Метаболизм и особенности энергетического обеспечения нервной ткани Основной путь получения энергии — аэробный распад глюкозы по ГБФ-пути. Глюкоза — почти единственный энергетический субстрат, поступающим в нервную ткань, который может быть использован ее клетками для образования АТФ. Проникновение глюкозы в ткань мозга не зависит от действия инсулина, который не проникает через гематоэнцефалический барьер. Влияние инсулина проявляется лишь в периферических нервах. Постоянный и непрерывный приток глюкозы и кислорода из кровеносного русла — необходимое условие энергетического обеспечения нервных клеток, так как содержание гликогена в нервной ткани ничтожно (0,1% от массы мозга) и не может обеспечить мозг энергией даже на короткое время. Глюкоза — основной источник энергии, так как через ГЭБ в нервные клетки поступает только глюкоза, которая, расщепляясь в аэробном гликолизе, образует ПВК, превращающуюся с помощью пируватдегидрогеназного комплекса в ацетил-КоА, который вступает в ЦТК, давая восстановленные эквиваленты для окислительного фосфорилирования, приводящего к образованию АТФ. В отличие от других тканей организма человека ВЖК не проникают через ГЭБ и не могут быть использованы в качестве энергетического материала. В пируватдегидрогеназный и -кетоглутаратдегидрогеназный комплексы входит витамин В1 в виде тиаминпирофосфата, поэтому недостаток витамина В1 в первую очередь сказывается на функции нервной системы, в клетках которой будет нарушено образование АТФ. Это приводит к возникновению полиневритов. При голодании, сахарном диабете нервная ткань использует кетоновые тела в качестве энергетического материала. Высокая скорость потребления глюкозы нервными клетками обеспечивается работой высокоактивной гексокиназы мозга. Здесь гексокиназа не является ключевым ферментом всех путей метаболизма глюкозы. Ключевые ферменты ГБФ-пути в нервной ткани — фосфофруктокиназа и изоцитратдегидрогеназа. Фосфофруктокиназу ингибируют фруктозо-1,6-бифосфат, АТФ и цитрат, активируют фруктозо-6-фосфат, АДФ, АМФ и неорганический фосфат. Активность изоцитрат ДГ даже при нормальном уровне утилизации глюкозы в состоянии покоя максимальна. Поэтому при повышенном энергопотреблении нет возможностей ускорения реакций цикла трикарбоновых кислот. Образование НАДФН2, используемого в основном для синтеза жирных кислот и стероидов, обеспечивается сравнительно высокой скоростью протекания ГМФ-пути распада глюкозы. Энергия АТФ в нервной ткани используется неравномерно во времени. Резкое повышение энергозатрат происходит при очень быстром переходе от сна к бодрствованию. Образование креатинфосфата способно удерживать макроэргические связи. Реакция полностью обратима, ее направление зависит от соотношения АТФ/АДФ в клетках нервной ткани. Во время сна накапливается фосфокреатин. Переход к бодрствованию приводит к резкому уменьшению концентрации АТФ — равновесие реакции сдвигается влево, т.е. образуется АТФ. Метаболизм аминокислот и белков Ткань мозга интенсивно обменивается аминокислотами с кровью. Для этого существуют специальные транспортные системы: две для незаряженных и еще несколько — для аминокислот, заряженных положительно и отрицательно. Концентрация свободных аминокислот в нервной ткани в 8 раз больше, чем в крови. Белки в головном мозге находятся в динамическом состоянии. Велика активность АсТ и АлТ, переводящих аминокислоты в кето-, для получения субстратов ЦТК. Белки серого вещества и мозжечка характеризуются высокой скоростью обновления особенно возбуждающих агентов (электрический ток, фармсредства), однако под влиянием наркоза, эти процессы затухают. До 75% от общего количества аминокислот нервной ткани составляют аспартат, глутамат, а также продукты их превращений или вещества, синтезированные с их участием (глутамин, ацетильные производные, ГАМК (гамма-аминомасляная кислота) глутатион). Функции глутамата в нервной ткани - Энергетическая: глутаминовая кислота связана большим числом реакций с промежуточными метаболитами цикла трикарбоновых кислот; - участие (вместе с аспартатом) в реакциях дезаминирования других аминокислот и временном обезвреживании аммиака; - образование из глутамата нейромедиатора ГАМК; - участие в синтезе глутатиона — одного из компонентов антиоксидантной системы организма. Глутамат с большой скоростью образуется из своего кетоаналога — -кетоглутаровой кислоты в ходе реакции трансаминирования и используется для образования глутатиона, глутамина и -аминомасляной кислоты. Ткань мозга способна синтезировать заменимые аминокислоты. Образование аммиака происходит в пуриновом цикле: путем гидролитического дезаминирования АМФ образуется ИМФ и аммиак. ИМФ, далее конденсируясь с аспарагиновой кислотой, образует аденилсукцинат, который, расщепляясь, образует вновь АМФ (и фумарат). Фумарат в ЦТК образует ОАА, который поддерживает уровень аспарагиновой кислоты, вступая в реакцию переаминирования с глутаминовой кислотой. Биохимические основы возникновения и проведения нервного импульса В норме в состоянии покоя мембрана аксона поляризована: внутри аксона ионов калия в 30 раз больше, чем ионов натрия. Концентрация анионов также различна. Катионы внутри клетки нейтрализуются в основном белками и фосфатами, которые не могут выходить наружу; внеклеточные катионы (в основном Na+) уравновешиваются Cl–, проницаемость которого выше, чем белков. Это во-первых. Во-вторых проницаемость Na+ составляет 1/20 проницаемости К+. В третьих, К+, Na+ АТФ-аза выкачивает 3 Na+ в обмен на 2 К+. При таких условиях внутренняя сторона клеточной мембраны заряжена электроотрицательно по отношению к наружной поверхности и электродвижущий трансмембранный потенциал Е=-70 мВ. При действии медиатора происходит активация аденилатциклазы мембран, под влиянием которой из АТФ образуется ц-АМФ, включающий каскадный механизм активации (фосфорилированием белков) натрий-калиевой АТФ-азы (ионного насоса). Таким образом, с участием АТФ происходит вначале открытие каналов для прохождения ионов натрия внутрь аксона, а затем открытие каналов для выхода ионов калия наружу. В этом состоянии разность потенциалов достигает +40мВ, положительный заряд внутри аксона. Это потенциал действия и, возникнув в одном участке, вследствие диффузии ионов вдоль волокна, снижает потенциал покоя и вызывает здесь тоже развитие потенциала действия. Возникает волна деполяризации — нервный импульс; затем происходит распространение волны деполяризации. Восстановление мембраны в поляризованном виде происходит также с участием ионных насосов с затратой АТФ. Следовательно, для функционирования нервной системы необходима выработка и затрата значительных количеств АТФ. Понятие о синапсах. Нейромедиаторы. Пептиды Синапс - функциональный контакт специализированных участков плазматических мембран двух возбудимых клеток. Состоит из пресинаптической мембраны, синаптической щели и постсинаптической мембраны. Мембраны клеток в месте контакта имеют утолщения в виде бляшек — нервных окончаний. Нервный импульс, достигший нервного окончания, не в состоянии преодолеть возникшее перед ним препятствие — синаптическую щель. Здесь электрический сигнал преобразуется в химический. Пресинаптическая мембрана содержит специальные канальные белки, которые реагируют на мембранный потенциал, изменяя свою конформацию, и формируют канал. В результате ионы Са2+ проходят через пресинаптическую мембрану по градиенту концентраций в нервное окончание. Градиент концентраций Са2+ создается работой Са2+ -зависимой АТФазы — кальциевым насосом. Повышение концентрации Са2+ внутри нервного окончания вызывает слияние 200-300 имеющихся там везикул, заполненных ацетилхолином, с плазматической мембраной. Далее ацетилхолин секретируется в синаптическую щель путем экзоцитоза и присоединяется к рецепторным белкам, расположенным на поверхности постсинаптической мембраны. При взаимодействии с ацетилхолином белок-рецептор изменяет свою конформацию, формируя натриевый канал. Катионная селективность канала обеспечивается тем, что ворота канала сформированы отрицательно заряженными аминокислотами. Таким образом, повышается проницаемость постсинаптической мембраны для натрия и возникает новый импульс (или сокращение мышечного волокна). Деполяризация постсинаптической мембраны вызывает диссоциацию комплекса «ацетилхолин - белок - рецептор», и ацетилхолин освобождается в синаптическую щель. Как только ацетилхолин оказывается в синаптической щели, он подвергается быстрому гидролизу под действием ацетилхолинэстеразы. Образуется промежуточный фермент-субстратный комплекс, в котором ацетилхолин связан с активным центром фермента через серин. Нейромедиаторы - вещества, характеризующиеся следующими признаками: - накапливаются в пресинаптической структуре в достаточной концентрации; - освобождаются при передаче импульса; -вызывают после связывания с постсинаптической мембраной изменение скорости метаболических процессов и возникновение электрического импульса; -имеют систему для инактивации или транспортную систему для удаления из синапса, обладающие к ним высоким сродством. Нейромедиаторы обеспечивают синаптическую передачу нервного импульса. Их синтез происходит в теле нейронов, а накопление — в особых везикулах, которые постепенно перемещаются с участием систем нейрофиламентов и нейротрубочек к кончикам аксонов. К нейромедиаторам относят аминокислоты (и их производные): таурин, норадреналин, дофамин, ГАМК, глицин, ацетилхолин, гомоцистеин, адреналин, серотонин, гистамин. Таурин. Образуется из аминокислоты цистеина. Сначала происходит окисление серы в SН-группе до остатка серной кислоты (процесс идет в несколько стадий), затем декарбоксилирование. Таурин не имеет карбоксильной группы, но содержит остаток серной кислоты. Участвует в проведении нервного импульса в процессе зрительного восприятия. Ацетилхолин. Синтезируется из холина и Ацетил-КоА. Участвует в синаптической передаче нервного импульса. Накапливаясь в синаптических пузырьках, образует комплексы с отрицательно заряженным белком везикулином. Передача возбуждения с одной клетки на другую осуществляется с помощью специального синаптического механизма. Катехоламины: норадреналин и дофамин. Синтезируются по общему механизму из тирозина. Ключевой фермент синтеза — тирозингидроксилаза, ингибируемая конечными продуктами. Норадреналин — медиатор в постганглионарных волокнах симпатической и в различных отделах ЦНС. Биосинтез катехоламинов 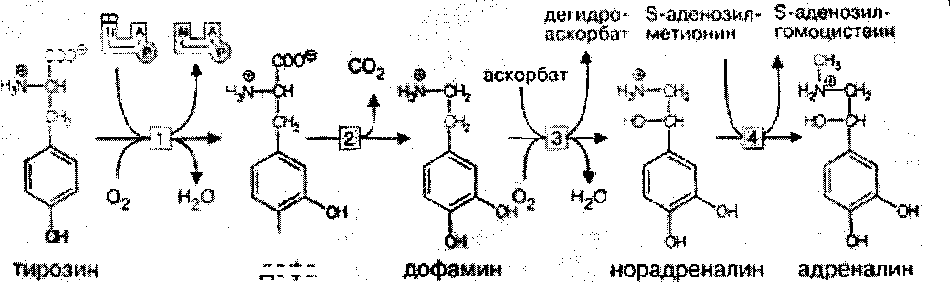 Дофамин — медиатор проводящих путей, тела нейронов которого расположены в отделе мозга, отвечающем за контроль произвольных движений. Катехоламины, как и ацетилхолин, накапливаются в синаптических пузырьках и выделяются в синаптическую щель при поступлении нервного импульса. В пресинаптической мембране имеется специальный регуляторный белок —-ахромогранин, который в ответ на повышение концентрации медиатора в синаптической щели связывает уже выделившийся медиатор и прекращает его дальнейший экзоцитоз. Фермента, разрушающего медиатор, в адренэргических синапсах нет. После передачи импульса молекулы медиатора перекачиваются специальной транспортной системой путем активного транспорта с участием АТФ обратно через пресинаптическую мембрану и включаются вновь в везикулы. В пресинаптическом нервном окончании излишек медиатора может быть инактивирован моноаминоксидазой или катехоламин-О-метилтрансферазой путем метилирования по оксигруппе. Передача сигнала в адренэргических синапсах происходит с участием аденилатциклазной системы. Связывание медиатора с постсинаптическим рецептором почти мгновенно вызывает повышение концентрации ц-АМФ, что приводит к быстрому фосфорилированию белков постсинаптической мембраны. В результате тормозится генерация нервных импульсов постсинаптической мембраной. МАО (моноаминоксидазы). ГАМК — тормозной медиатор. Повышает проницаемость постсинаптических мембран для ионов калия, вызывая изменение мембранного потенциала. Глицин — тормозной медиатор, по вызываемым эффектам подобен ГАМК. 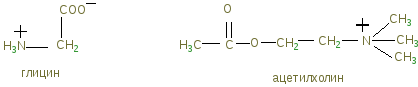 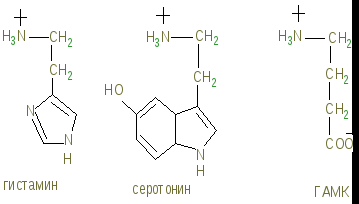 Нейромедиаторы и нейрогормоны 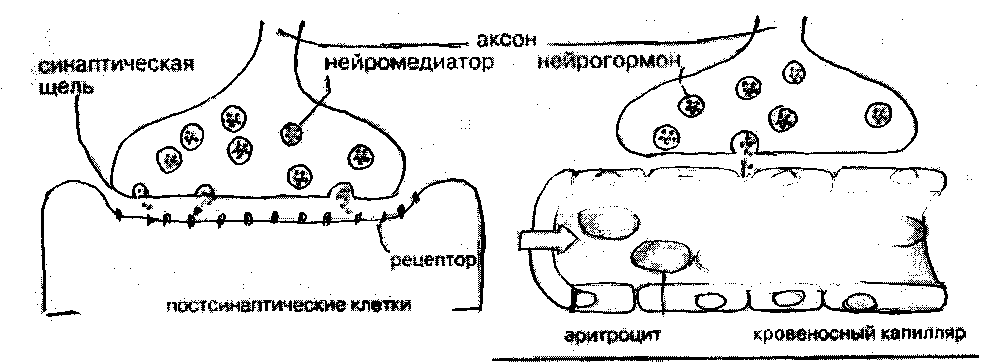 Пептиды выполняют функцию как нейромедиаторов, так и гормонов. Имеют в своем составе от 3 до нескольких десятков аминокислотных остатков. Функционируют только в высших отделах нервной системы. Классификация пептидов: - нейрогипофизарные гормоны (вазопрессин, либерины, статины) — одновременно и гормоны, и медиаторы; - гастроинтестинальные пептиды (гастрин, холецистокинин). Гастрин вызывает чувство голода, холецистокинин вызывает чувство насыщения, стимулирует сокращение желчного пузыря и функцию поджелудочной железы; - опиатоподобные пептиды (пептиды обезболивания, эндорфины). Взаимодействуют с теми же рецепторами, что и опиаты (морфин), имитируя их действие; - пептиды сна. Молекулярная природа не установлена. Введение животным вызывает сон; - пептиды памяти (скотофобин). Накапливается в мозге крыс при тренировке на избегание темноты; - пептиды — компоненты ренин-ангиотензиновой системы. Введение ангиотензина-П в центр жажды головного мозга вызывает появление этого ощущения и стимулирует секрецию антидиуретического гормона. Пептиды образуются в реакциях ограниченного протеолиза, разрушаются под действием протеиназ. Биохимические основы возникновения некоторых заболеваний нервной системы Миастения — заболевание, в основе которого лежит повышение активности холинэстеразы, в результате чего быстро расщепляется медиатор ацетилхолин и блокируется проводимость на уровне мионеврального синапса. Клинически — патологическая утомляемость мышц, парезы, слабость. Коррекция (лечение) — введение прозерина, который является конкурентным ингибитором холинэстеразы. Шизофрения — заболевание ЦНС, при котором в синапсах происходит накопление медиатора серотонина, что приводит к раздражению соответствующих участков мозга, сопровождающихся галлюцинациями и расстройствами мышления. Депрессивные состояния — заболевания ЦНС, связанные с истощением нейромедиаторов в ЦНС. Соединения, влияющие на синаптическую передачу нервного импульса
ЛАБОРАТОРНОЕ ЗАНЯТИЕ Определение активности холинэстеразы в сыворотке крови колориметрическим методом В организме человека существуют два типа холинэстераз: 1) ацетилхолинэстераза (АХЭ), которая встречается преимущественно в мозге, эритроцитах, мышцах, нервах: это субстратспецифический фермент, катализирующий гидролитическое расщепление ацетилхолина на холин и уксусную кислоту; 2) холинэстераза (ХЭ) содержится в основном в печени, поджелудочной железе и плазме крови, она обладает более широкой субстратной специфичностью, т. е. расщепляет ацетилхолин и другие эфиры холина. Активность ацетилхолинэстеразы сыворотки и тканей определяют при клинико-диагностических исследованиях. В норме ХЭ колеблется в широких пределах: 160— 340 мкмоль/(млч). Чаще всего при патологических состояниях активность ХЭ снижается. Значительное снижение активности ХЭ сыворотки крови отмечается при заболеваниях печени, гипотиреозе, бронхиальной астме, ожогах, отравлениях. Метод основан на количественном определении уксусной кислоты, образующейся из ацетил-холинхлорида в ферментативной реакции, катализируемой холинэстеразой сыворотки: 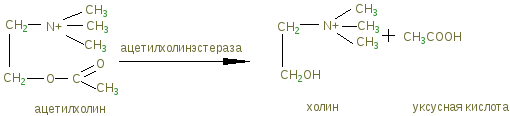 Ход работы. Готовят две пробирки для опытной и контрольной пробы. В опытную пробирку вносят 5 мл раствора вероналового буфера, содержащего индикатор феноловый красный, 0,2 мл дистиллированной воды, 0,1 мл сыворотки крови. Смесь помещают в термостат при 37°С на 5 минут. Затем в пробу добавляют 0,2 мл раствора ацетилхолин хлорида и инкубируют в термостате при 37°С в течение 30 минут. После инкубации в пробу добавляют 0,2 мл раствора прозерина для прекращения ферментативной реакции. В контрольную пробу вносят сначала 0,2 мл раствора прозерина, а затем все реактивы по порядку, как в опытной пробе. После инкубации обе пробы колориметрируют на ФЭКе с зеленым светофильтром против воды. Окраска устойчива в течение 1 часа. Находят разность между показателями ФЭКа для опытной и контрольной проб, затем по калибровочному графику определяют количество уксусной кислоты, образовавшейся в опыте. Расчет активности холинэстеразы делают по формуле: активность холинэстеразы = а 10 2 мкмоль/(мл ч), где а — содержание уксусной кислоты в пробе, мкмоль; 10 — коэффициент пересчета на 1 мл сыворотки; 2 — коэффициент пересчета на 1 ч инкубации. Контрольные вопросы 1. Какие вещества способны проникать через гематоэнцефалический барьер? Их структурные формулы. 2. Напишите структурные формулы липидов, входящих в состав нервной ткани: цереброзидов, ганглиозидов, сфингомиелинов, фосфолипидов, ХС. 3. Какие пептиды участвуют в метаболизме нервной ткани? Состав их. 4. Напишите схему образования аммиака в нервной клетке («пуриновый» цикл). Укажите соответствующие ферменты. 5. Какие аминокислоты принимают участие в обмене в клетках нервной системы? Напишите схему, подтверждающую обмен этих аминокислот. 6. Укажите биохимические основы возникновения: а) миастении; б) шизофрении; в) депрессивных состояний. 7. Каков принцип определения каталитической активности холинэстеразы в сыворотке крови? Литература 1. Пустовалова Л.М. Практикум по биохимии. Ростов-на-Дону «Еникс», 1999. 2. Николаев А.Я. Биологическая химия. Москва, МИА, 2001. 3. Биохимия. Под ред. Е.С. Северина, М., «ГЭОТАР –Медиа», 2008. 4. Березов Т.Т., Коровкин Б.Ф. Биологическя химия. М. «Медицина», 1998. Стр. 625, 644. БИОХИМИЯ МЫШЕЧНОЙ ТКАНИ Мышцы составляют более 40% массы тела. Вся деятельность организма связана в той или иной мере с работой мышц. Функция сосудов и сердца, дыхание, пищеварение, выполнение работы обусловлено деятельностью мышечной ткани. Биохимия мышц служит основой для понимания многообразных функций мышечной ткани и играет большую роль в развитии знаний по физиологии, гигиене, понимании патогенеза заболеваний, связанных с поражением мышечной ткани (инфаркт миокарда, миодистрофии, коллагеновые болезни). В биоэнергетике мышечной ткани большое значение играет метаболизм адениловых и гуаниловых нуклеотидов, содержимое которых изменяется при патологических состояниях. Цель: изучить молекулярную организацию мышечного волокна, дать представление о метаболических процессах, обеспечивающие мышцы энергией. Особенности строения мышечного волокна Мышца состоит из отдельных волокон, которые представляют собой мышечные клетки, окруженные плазматической мембраной (сарколемой). В цитоплазме находятся многочисленные ядра (100-200), митохондрии и другие обычные для клеток органеллы. В мышечной клетке имеются миофибриллы (пучки белков), располагающиеся вдоль клетки, которые построены из белковых нитей (филаментов) двух типов – толстых (миозин) и тонких (актин). Функциональной единицей миофибриллы является участок, ограниченный двумя Z-пластинками, к М-линии прикреплены миозиновые нити своей серединой, активные нити прикреплены к Z-пластинкам. Чередование толстых (А-диски) и тонких (I-диски) нитей создает поперечную полосатость мышц. 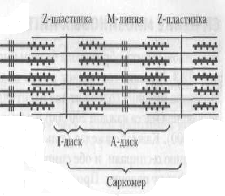 Структура мышечного волокна Химический состав поперечно-полосатых и гладких мышц а) Сократительные белки: актин, миозин; б) регуляторные белки: тропомиозин, тропонин. Сокращение – один из характерных признаков живого. Сокращение живой протоплазмы – основа многообразных движений. Функция мышц обусловлена рядом биохимических процессов, при которых в мышечных волокнах химическая энергия трансформируется в энергию, совершаемую мышцей при сокращении. Всю мускулатуру животного организма можно подразделить на две группы: поперечно-полосатые или скелетные мышцы, обеспечивающие все произвольные движения, выполнение физической работы, и гладкие – непроизвольные движения внутренних органов. Структурная единица мышцы – мышечное волокно (его длина до 10-12 см., диаметр 0,1-0,02 мм). Оболочка мышечного волокна построена из эластичных нитей – белков стромы, позволяющей клетке сокращаться и растягиваться. Сократительными элементами мышечной ткани являются миофибриллы, расположенные в форме пучков в цитоплазме мышечного волокна. Под микроскопом видна поперечная исчерченность из-за оптической неоднородности входящих в их состав белков. Скелетные мышцы теплокровных животных содержат 74-78% Н2О и 26-22% сухого вещества. Основная масса сухого вещества приходится на долю белков 18-20%. Липиды составляют 1-3%, соли 1,5-2%, углеводы 0,5-3%. Содержание белковых мышц достигает 20,9%. На основании растворимости белки можно разделить на фракции (содержание в % к общему белку мышц): миогеновая фракция - 28% группа глобулина Ŷ - 20% группа миозина - 30-50% группа актина - 10-12% группа стромы - 9,5% тропомизин - 2,5% миоглобин - 0,2-0,6% Миогеновая фракция: легко извлекается из мышц водой, представляет собой белки типа альбуминов. Ряд белков этой фракции обладает ферментативной активностью, катализируют процессы анаэробного и аэробного распада углеводов. Это – альдолаза, изомераза. Глобулин Ŷ – также обладает ферментативной активностью. Миозин представляет собой две полипептидные цепи, свернутые в двойную спираль. Конец (головка) молекулы миозина имеет глобулярное строение и связан нековалентно с четырьмя дополнительными короткими полипептидными цепями. При обработке трипсином миозин распадается на 2 фракции: легкий меромиозин и тяжелый меромиозин Н. Миозин – высокомолекулярный белок (более 440 000). Имеет участки, обладающие АТФ-азной активностью, проявляющейся в присутствии Са2+ . 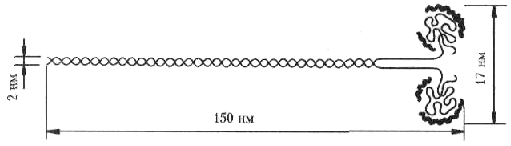 Структура миозина Легкий мирозин отличается от тяжелого по аминокислотному составу свойствами. Тяжелый миозин обладает ферментативной активностью. Он является аденозинтрифосфотазой и гидролитически расщепляет АТФ. Это можно описать: АТФ + H2O → АДФ + H3PO4 + W (энергия). Актин – белок с более низкой молекулярной массой (42000). Может быть в двух формах: глобулярной (G) или фибриллярной (F). После прибавления солей G-актин легко переходит в F-актин. F-актин является полимером G-актина. Этот переход осуществляется под влиянием ионов К+: актин глобулярный → актин фибрилярный F. Актин F легко соединяется с миозином и образует новый белок-актомиозин. F-актин состоит из двух филаментов скрученных в спираль. 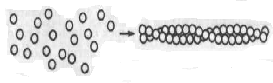 Структура актина Для актомиозина характерны следующие свойства:
Тропомиозин – состоит из двух полипептидных цепей образующих двойную спираль, располагается в бороздке на поверхности – F актина по длине соответствует 7 субъектам - G-актина. Комплекс тропонина состоит из трех субъединиц с глобулярной структурой и расположен примерно на концах Тm. Tропонин Т (TnT) обеспечивает связь с Тm. Tропонин С (TnC) образует связь с ионами Са2+ на поверхности Тm, в результате чего изменяется его конформация. Тропонин I (TnI) может предотвращать взаимодействие актина с миозином. Положение ТnI переменно и зависит от концентрации Са2+. В присутствии Са2+ изменяется конформация ТnC. Это приводит к изменению положения TnI по отношению к актину, в результате он может взаимодействовать с миозином. Т 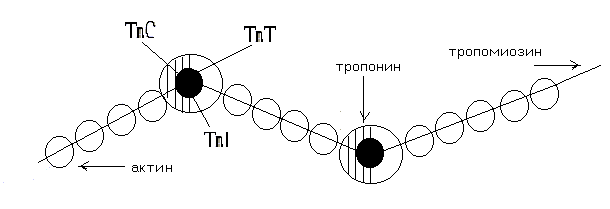 ропомиозин и тропонин 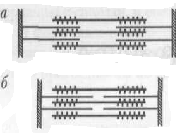 Точное пространственное расположение главных белков сократительной мышцы - необходимое условие сокращения и расслабления, а также регуляции этих процессов. Сокращение связано с образованием комплекса между актином и миозином, в котором каждая субъединица актина взаимодействует с сегментом, содержащим головку миозина (F1). Расслабление происходит при сокращении этого взаимодействия. Взаимодействие А и М регулируется T, который находится в бороздке актина. Изменение конформации Т передается на T, который погружается глубже в бороздку разрешая взаимодействие актина с головкой миозина. Состояние миофибриллы: а) покой; б) сокращение Миоглобин – сложный белок хромопротеин, по строению близок к гемоглобину, находится в красных мышцах, способен связывать и отдавать кислород, способствуя снабжению мышечных волокон кислородом. В состав белков протоплазмы входят ферменты гликолиза с высокой ферментативной активностью. Ферменты биологического окисления сосредоточены в митохондриях, где осуществляется окислительное фосфорилирование. В рибосомах, лизосомах содержатся ферменты, осуществляющие превращение белков и липидов. Оксимиоглобин отдает кислород только при значительном снижении парциального давления. Миоглобин извлекается из тканей аммиачным раствором. Соединительнотканные белки входят в состав оболочек клетки и субклеточных образований, стенок сосудов, нервов. Их содержание составляет до 20% от общего количества мышц. Это главным образом коллаген; они не извлекаются даже растворами солей. В мышце имеются аминокислоты, полипептиды, а также азотосодержащие вещества, которые легко извлекаются водой. Их называют экстрактивными веществами. К ним относятся креатин и креатинфосфат, на долю которых приходится до 60% всего небелкового азота. В покое весь креатин мышц представлен в виде креатинфосфата. Его концентрация в мышце довольно высокая (0,2-0,55%), в связи с тем, что он играет важную роль в передаче макроэргических связей внутри клетки, и обеспечивает ресинтез АТФ. Креатинфосфат (КрФ) - макроэргическое соединение, способное отдавать фосфорную группу на АДФ; реакцию катализирует креатинфосфаткиназа по схеме: АДФ + Крф → креатинфосфаткиназа АТФ – Кр (креатин)  Креатин синтезируется в почках из аргинина. 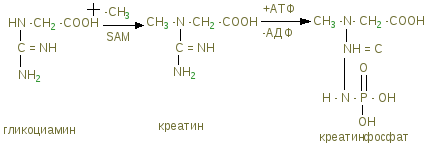 В мышцы креатин доставляется с кровью. Креатинфосфат (Крф) резерв макроэргических связей в мышце. 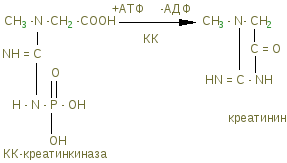 В мышцах можно обнаружить и некоторое количество креатинина, образующегося при разрушении Крф (креатинфосфата). К числу азотосодержащих экстрактивных веществ относится ансерин, карнитин, карнозин (β-аланин-гистидин). В мышцах высоко содержание адениловых нуклеотидов, которые относятся к экстрактивным веществам (до 0,4 %) АТФ, АМФ, АДФ. Углеводы представлены в основном гликогеном (0,5-0,8%). Основная масса гликогена организма сосредоточена в мышцах, хотя в печени его концентрация выше (5%). Моносахариды представлены преимущественно в виде гексозофосфатов, их концентрация не превышает концентрацию глюкозы в крови. Минеральные вещества – (зола) составляет 1-1,5% массы мышц. Наряду с К+ и Na+ в мышцах содержится Ca2+ и Мg2+, которые играют важную роль в механизме мышечного сокращения. В условиях покоя Са2+ сосредоточен преимущественно в трубочках и пузырьках саркоплазматического ретикулума. Основная масса фосфора (около 80%) мышечной ткани входит в состав макроэргических соединений (АТФ и креатинфосфат), 10% представлено в виде солей неорганического фосфата, 5% связано с гексозами и 5% входит в состав АДФ, АМФ и других нуклеотидов. Химический состав гладких мышц включает те же вещества, что и поперечно-полосатые мышцы, но в других количественных соотношениях. В них меньше актомиозина и миозина, но больше миоальбумина и нерастворимых белков стромы (коллагена). Содержание гликогена менее 0,5%, меньше и экстрактивных веществ. Содержание Са2+ в гладких мышцах ниже. Химизм мышечного сокращения Обмен веществ покоящихся мышц незначителен, при работе он повышается более чем в 100 раз. Для сокращения мышц необходимы: 1)гликоген, 2) миозин, 3) актин, 4) АТФ, 5) креатинфосфат, 6) ионы калия. Химизм мышечного сокращения в настоящее время рассматривается как результат взаимодействия между собой двух сократительных белков - актина и миозина за счет расщепления АТФ АТФ-азой миозина. Энергия, выделяющаяся при расщеплении АТФ, превращается из химической в механическую, нити актина вытягиваются между нитями миозина, саркомер укорачивается или напрягается. В условиях покоя АТФ не расщепляется, так как АТФ-азная активность миозина подавлена присутствием ионов магния. Роль магния – тормозить в условиях покоя гидролиз АТФ, при этом головки миозина получают энергию, которая обеспечивает смещение тропонина С и последующее зацепление ее за актиновую нить. Стимулом для включения сложного механизма служит нервный импульс, при его поступлении в синапс (на окончание двигательного нерва), выделяется медиатор - ацетилхолин – это создает разность потенциалов между наружной и внутренней мембраной. Вследствие этого выходит кальций из саркоплазматического ретикулума, где он находится в связи с белком кальсеквестрином, что обеспечивает увеличение его содержания в саркоплазме. Кальций действует, как антагонист магния, создает условие для проявления АТФ-азной активности миозина. АТФ расщепляется, сократительные белки взаимодействуют, мышца (саркомер) сокращается. Сокращение продолжается до тех пор, пока не поступают нервные импульсы и есть запасы АТФ. За счет энергии АТФ ионы кальция связываются саркоплазматическим ретикулумом, удаляется из саркоплазмы, их концентрация снижается. Происходит расслабление мышц. Поддержанию АТФ в должной концентрации обеспечивает высокий уровень содержания дыхательных ферментов. Увеличение кровоснабжения мышц при работе, ведет к увеличению притока кислорода, и питательных веществ. В начальный период может быть использован кислород, миоглобин, креатинфосфат, затем глюкоза, гликоген, липиды. Это обеспечивается высокой концентрацией гликогена и активностью ферментов гликолиза. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
