Патфиз ч.2. Патфиз ч. Гл. 11 Нарушения водного обмена Гл. 12 Нарушения ионного обмена
 Скачать 7.84 Mb. Скачать 7.84 Mb.
|
|
В данной главе рассмотрена патофизиология основных расстройств кислотно-щелочного равновесия (КЩР). Дополнительные сведения по патологии КЩР содержатся в статьях «Нарушения обмена жидкости и электролитов», «Ацидоз» и «Алкалоз» в приложении «Справочник терминов на компакт диске». ОСНОВНЫЕ ПОНЯТИЯ • Концентрация ионов водорода [Н+] в клетках и биологических жидкостях — один из важных факторов обеспечения гомеостаза/гомеокинеза организма. Хотя величина [Н+] во внеклеточной жидкости сравнительно мала (при pH 7,4 она составляет 40×10–9 моль/л), [H+] существенно влияет практически на все жизненно важные функции (например, на кинетику ферментативных реакций, физикохимическое и структурное состояние мембран, конформацию макромолекул, сродство Hb к кислороду, чувствительность рецепторов к БАВ, интенсивность генерации активных форм кислорода и липопероксидных процессов, возбудимость и проводимость нервных структур). • Отклонения [H+] от оптимального диапазона приводят к нарушениям метаболизма, жизнедеятельности клеток (вплоть до их гибели), тканей, органов и организма в целом. Сдвиг показателя рН в диапазоне ±0,1 обусловливает расстройства дыхания и кровообращения; ±0,3 — потерю сознания, нарушения гемодинамики и вентиляции лёгких; в диапазоне ±0,4 и более — чреват гибелью организма. • Кислотно-щелочное равновесие (КЩР) оценивают по величине рН — водородному показателю. рН — отрицательный десятичный логарифм молярной концентрации H+ в среде. • рН жидких сред организма зависит от содержания в них органических и неорганических кислот и оснований. • Кислота — вещество, которое в растворе является донором протонов. • Основание — вещество, являющееся в растворе акцептором протонов. • Сильные кислоты [HCl, H2SO4] и сильные основания [NaOH, KON, Ca(OH)2] в организме не образуются, в разбавленных растворах они полностью ионизированы. В отличие от них, слабые кислоты [уксусная — CH3COOH, угольная — H2CO3] и слабые основания [гидрокарбонат калия — KHCO3, гидрофосфат натрия — NaH2PO4] при растворении ионизируются не полностью. • В организм с пищей поступают вода, белки, жиры, углеводы, минеральные соединения, витамины. При метаболизме из них образуется большое количество эндогенных кислот: молочная, угольная, пировиноградная, ацетоуксусная, βоксимасляная, серная, соляная и др. • Эндогенные кислоты подразделяют на летучие и нелетучие. † Нелетучие кислоты не способны превращаться в газообразное вещество и не удаляются лёгкими. К основным нелетучим кислотам относятся серная (образуется при катаболизме белков и серосодержащих аминокислот метионина и цистеина), βоксимасляная, ацетоуксусная, молочная, пировиноградная (образуются при неполном окислении жиров и углеводов). Ежедневно в организме образуется около 1 мэкв нелетучих кислот на 1 кг массы тела. † Летучие кислоты. В живом организме образуется лишь одна летучая кислота — угольная — (H2CO3). Она легко расщепляется на H2O и CO2. Углекислый газ выводится из организма лёгкими. ПОКАЗАТЕЛИ ОЦЕНКИ КИСЛОТНО-ЩЕЛОЧНОГО РАВНОВЕСИЯ Показатели оценки КЩР подразделяют на основные и дополнительные (табл. 13–1). ОСНОВНЫЕ ПОКАЗАТЕЛИ Оценка КЩР и его сдвигов в клинической практике проводится с учётом нормального диапазона его основных показателей: pH, pCO2, стандартный бикарбонат плазмы крови SB (Standart Bicarbonate), буферные основания капиллярной крови BB (Buffer Base) и избыток оснований капиллярной крови BE (Base Excess). Учитывая, что [H+] крови адекватно отражает этот показатель в разных областях организма, а также простоту процедуры взятия крови для анализа, основные показатели КЩР исследуют именно в плазме крови. ДОПОЛНИТЕЛЬНЫЕ ПОКАЗАТЕЛИ С целью выяснения причины и механизма развития негазовых форм нарушений КЩР определяют ряд дополнительных показателей крови (КТ, МК) и мочи (титруемая кислотность — ТК и аммиак) Таблица 13–1. Показатели кислотно-щелочного равновесия
МЕХАНИЗМЫ УСТРАНЕНИЯ СДВИГОВ КИСЛОТНО-ЩЕЛОЧНОГО РАВНОВЕСИЯ ОРГАНИЗМА Учитывая важность поддержания [H+] в сравнительно узком диапазоне для оптимальной реализации процессов жизнедеятельности, в эволюции сформировались системные, хорошо интегрированные механизмы регуляции этого параметра в организме в норме и устранения его сдвигов при развитии патологии. В норме в организме образуются почти в 20 раз больше кислых продуктов, чем основных (щелочных). В связи с этим в нем доминируют системы, обеспечивающие нейтрализацию, экскрецию и секрецию избытка соединений с кислыми свойствами. К этим системам относятся химические буферные системы и физиологические механизмы регуляции КЩР. ХИМИЧЕСКИЕ БУФЕРНЫЕ СИСТЕМЫ Химические буферные системы представлены в основном бикарбонатным, фосфатным, белковым и гемоглобиновым буферами. Буферные системы начинают действовать сразу же при увеличении или снижении [H+], и следовательно, представляют собой первую мобильную и действенную систему компенсации сдвигов рН. Например, буферы крови способны устранить умеренные сдвиги КЩР в течение 10–40 с. Ёмкость и эффективность буферных систем крови весьма высока (табл. 13–2). Таблица 13–2. Относительная ёмкость буферов крови (%)
по Б.И. Ткаченко, 1994 Принцип действия химических буферных систем заключается в трансформации сильных кислот и сильных оснований в слабые. Эти реакции реализуются как внутри так и внеклеточно (в крови, межклеточной, спинномозговой и других жидких средах), но в наибольшем масштабе — в клетках. ГИДРОКАРБОНАТНАЯ БУФЕРНАЯ СИСТЕМА Гидрокарбонатная буферная система — основной буфер крови и межклеточной жидкости. Она составляет около половины буферной ёмкости крови и более 90% — плазмы и интерстициальной жидкости. Гидрокарбонатный буфер внеклеточной жидкости состоит из смеси угольной кислоты — H2NO3 и гидрокарбоната натрия — NaHCO3. В клетках в состав соли угольной кислоты входят калий и магний. Гидрокарбонатный буфер — система открытого типа, она ассоциирована с функцией внешнего дыхания и почек. Система внешнего дыхания поддерживает оптимальный уровень рCO2 крови (и как следствие — концентрацию H2CO3), а почки — содержание аниона HCO3–. Именно это обеспечивает функционирование системы HCO3–/H2CO3 в качестве эффективного и ёмкого буфера внеклеточной среды даже в условиях образования большого количества нелетучих кислот (табл. 13–3). Таблица 13–3. Начальные сдвиги и компенсаторные реакции при нарушениях кислотно-щелочного равновесия
Гидрокарбонатная буферная система используется как важный диагностический показатель состояния КЩР организма в целом. ФОСФАТНАЯ БУФЕРНАЯ СИСТЕМА Фосфатная буферная система играет существенную роль в регуляции КЩР внутри клеток, особенно — канальцев почек. Это обусловлено более высокой концентрацией фосфатов в клетках в сравнении с внеклеточной жидкостью (около 8% общей буферной ёмкости). Фосфатный буфер состоит из двух компонентов: щелочного — (Na2HPO4) и кислого — (NaH2PO4). Эпителий канальцев почек содержит компоненты буфера в максимальной концентрации, что обеспечивает его высокую мощность. В крови фосфатный буфер способствует поддержанию («регенерации») гидрокарбонатной буферной системы. При увеличении уровня кислот в плазме крови (содержащей и гидрокарбонатный, и фосфатный буфер) увеличивается концентрация H2CO3 и уменьшается содержание NaHCO3: H2CO3 + Na2HPO4 ⇔ NaHCO3 + NaH2PO4 В результате избыток угольной кислоты устраняется, а уровень NaHCO3 возрастает. БЕЛКОВАЯ БУФЕРНАЯ СИСТЕМА Белковая буферная система — главный внутриклеточный буфер. Он составляет примерно три четверти буферной ёмкости внутриклеточной жидкости. Компонентами белкового буфера являются слабодиссоциирующий белок с кислыми свойствами (белокCOOH) и соли сильного основания (белокCOONa). При нарастании уровня кислот они взаимодействуют с солью белка с образованием нейтральной соли и слабой кислоты. При увеличении концентрации оснований реакция их происходит с белком с кислыми свойствами. В результате вместо сильного основания образуется слабоосновная соль. ГЕМОГЛОБИНОВАЯ БУФЕРНАЯ СИСТЕМА Гемоглобиновая буферная система — наиболее ёмкий буфер крови — составляет более половины всей её буферной ёмкости. Гемоглобиновый буфер состоит из кислого компонента — оксигенированного Hb — HbO2 и основного — неоксигенированного. HbO2 примерно в 80 раз сильнее диссоциирует с отдачей в среду H+, чем Hb. Соответственно, он больше связывает катионов, главным образом K+. Основная роль гемоглобиновой буферной системы заключается в её участии в транспорте CO2 от тканей к лёгким. • В капиллярах большого круга кровообращения HbO2 отдаёт кислород. В эритроцитах CO2 взаимодействует с H2O и образуется H2CO3. Эта кислота диссоциирует на HCO3– и H+, который соединяется с Hb. Анионы HCO3– из эритроцитов выходят в плазму крови, а в эритроциты поступает эквивалентное количество анионов Cl–. Остающиеся в плазме крови ионы Na+ взаимодействуют с HCO 3– и благодаря этому восстанавливают её щелочной резерв. • В капиллярах лёгких, в условиях низкого pСО2 и высокого pО2, Hb присоединяет кислород с образованием HbO2. Карбаминовая связь разрывается, в связи с чем высвобождается CO2. При этом, HCO3– из плазмы крови поступает в эритроциты (в обмен на ионы Cl–) и взаимодействует с H+, отщепившимся от Hb в момент его оксигенации. Образующаяся H2CO3 под влиянием карбоангидразы расщепляется на CO2 и H2O. CO2 диффундирует в альвеолы и выводится из организма. КАРБОНАТЫ КОСТНОЙ ТКАНИ Карбонаты костной ткани функционируют как депо для буферных систем организма. В костях содержится большое количество солей угольной кислоты: карбонаты кальция, натрия, калия и др. При остром увеличении содержания кислот (например, при острой сердечной, дыхательной или почечной недостаточности, шоке, коме и других состояниях) кости могут обеспечивать до 30–40% буферной ёмкости. Высвобождение карбоната кальция в плазму крови способствует эффективной нейтрализации избытка H+. В условиях хронической нагрузки кислыми соединениями (например, при хронической сердечной, печёночной, почечной, дыхательной недостаточности) кости могут обеспечивать до 50% буферной ёмкости биологических жидкостей организма. ФИЗИОЛОГИЧЕСКИЕ МЕХАНИЗМЫ Наряду с мощными и быстродействующими химическими системами в организме функционируют органные механизмы компенсации и устранения сдвигов КЩР. Для их реализации и достижения необходимого эффекта требуется больше времени — от нескольких минут до нескольких часов. К наиболее эффективным физиологическим механизмам регуляции КЩР относят процессы, протекающие в лёгких, почках, печени и ЖКТ. ЛЁГКИЕ Лёгкие обеспечивают устранение или уменьшение сдвигов КЩР путём изменения объёма альвеолярной вентиляции. Это достаточно мобильный механизм — уже через 1–2 мин после изменения объёма альвеолярной вентиляции компенсируются или устраняются сдвиги КЩР. • Причиной изменения объёма дыхания является прямое или рефлекторное изменение возбудимости нейронов дыхательного центра. • Снижение рН в жидкостях организма (плазма крови, СМЖ) является специфическим рефлекторным стимулом увеличения частоты и глубины дыхательных движений. Вследствие этого лёгкие выделяют избыток CO2 (образующийся при диссоциации угольной кислоты). В результате содержание H+ (HCO3– + H+ = H2CO3 → H2O + CO2) в плазме крови и других жидкостях организма снижается. • Повышение рН в жидких средах организма снижает возбудимость инспираторных нейронов дыхательного центра. Это приводит к уменьшению альвеолярной вентиляции и выведению из организма CO2, т.е. к гиперкапнии. В связи с этим в жидких средах организма возрастает уровень угольной кислоты, диссоциирующей с образованием H+, — показатель рН снижается. Следовательно, система внешнего дыхания довольно быстро (в течение нескольких минут) способна устранить или уменьшить сдвиги рН и предотвратить развитие ацидоза или алкалоза: увеличение вентиляции лёгких в два раза повышает рН крови примерно на 0,2; снижение вентиляции на 25% может уменьшить рН на 0,30,4. ПОЧКИ К главным механизмам уменьшения или устранения сдвигов КЩР крови, реализуемых нефронами почек, относят ацидогенез, аммониогенез, секрецию фосфатов и K+,Na+обменный механизм. • Ацидогенез. Этот энергозависимый процесс, протекающий в эпителии дистальных отделов нефрона и собирательных трубочек, обеспечивает секрецию в просвет канальцев H+ в обмен на реабсорбируемый Na+ (рис. 13–1). 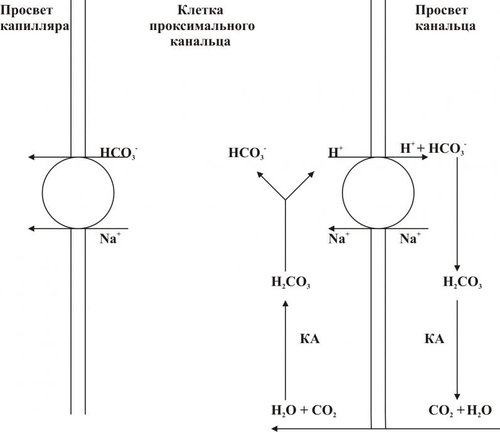 Рис. 13–1. Реабсорбция HCO3 в клетках проксимального отдела. КА — карбоангидраза. 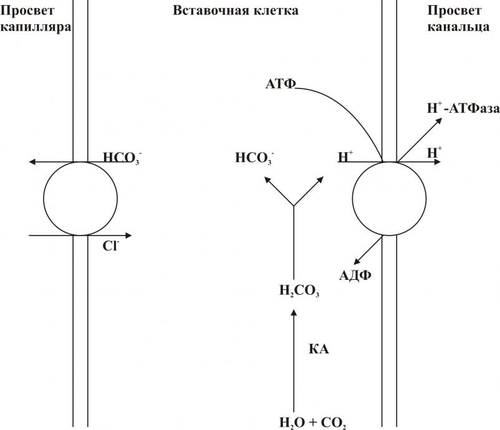 Рис. 13–2. Секреция H+ клетками канальцев и собирательных трубочек. КА — карбоангидраза. Количество секретируемого H+ эквивалентно его количеству, попадающему в кровь с нелетучими кислотами и H2CO3. Реабсорбированный из просвета канальцев в плазму крови Na+ участвует в регенерации плазменной гидрокарбонатной буферной системы (рис. 13–2). • Аммониогенез, как и ацидогенез, реализует эпителий канальцев нефрона и собирательных трубочек. Аммониогенез осуществляется путём окислительного дезаминирования аминокислот, преимущественно (примерно 2/3) — aeooaieiовой, в меньшей мере — аланина, аспарагина, лейцина, гистидина. Образующийся при этом аммиак диффундирует в просвет канальцев. Там NH3+ присоединяет ион H+ с образованием иона аммония (NH4+). Ионы NH4+ замещают Na+ в солях и выделяются преимущественно в виде NH4Cl и (NH4)2SO4. В кровь при этом поступает эквивалентное количество гидрокарбоната натрия, обеспечивающего регенерацию гидрокарбонатной буферной системы. • Секреция фосфатов осуществляется эпителием дистальных канальцев при участии фосфатной буферной системы: Na2HPO4 + H2CO3 ⇔ NaH2PO4 + NaHCO3 Образующийся гидрокарбонат натрия реабсорбируется в кровь и поддерживает гидрокарбонатный буфер, а NaH2PO4 выводится из организма с мочой. Таким образом, секреция H+ эпителием канальцев при реализации трёх описанных выше механизмов (ацидогенеза, аммониогенеза, секреции фосфатов) сопряжена с образованием гидрокарбоната и поступлением его в плазму крови. Это обеспечивает постоянное поддержание одной из наиболее важных, ёмких и мобильных буферных систем — гидрокарбонатной и как следствие — эффективное устранение или уменьшение опасных для организма сдвигов КЩР. • К+,Na+обменный механизм, реализуемый в дистальных отделах нефрона и начальных участках собирательных трубочек, обеспечивает обмен Na+ первичной мочи на K+, выводящийся в неё эпителиальными клетками. Реабсорбированный Na+ в жидких средах организма участвует в регенерации гидрокарбонатной буферной системы. K+,Na+обмен контролируется альдостероном. Кроме того, альдостерон регулирует (увеличивает) объём секреции и экскреции H+. Таким образом, почечные механизмы устранения или уменьшения сдвигов КЩР осуществляются путём экскреции H+ и восстановления резерва гидрокарбонатной буферной системы в жидких средах организма. ПЕЧЕНЬ Печень играет существенную роль в компенсации сдвигов КЩР. В ней действуют, с одной стороны, общие внутри и внеклеточные буферные системы (гидрокарбонатная, белковая и др.), с другой стороны, в гепатоцитах осуществляются различные реакции метаболизма, имеющие прямое отношение к устранению расстройств КЩР. • Синтез белков крови, входящих в белковую буферную систему. В печени образуются все альбумины, а также фибриноген, протромбин, проконвертин, проакцелерин, гепарин, ряд глобулинов и ферментов. • Образование аммиака, способного нейтрализовать кислоты как в самих гепатоцитах, так и в плазме крови и в межклеточной жидкости. • Синтез глюкозы из неуглеводных веществ — аминокислот, глицерина, лактата, пирувата. Включение этих органических нелетучих кислот при образовании глюкозы обеспечивает снижение их содержания в клетках и биологических жидкостях. Так, МК, которую многие органы и ткани не способны метаболизировать, в гепатоцитах примерно на 80% трансформируется в H2O и CO2, а оставшееся количество ресинтезируется в глюкозу. Таким образом, лактат превращается в нейтральные продукты. • Выведение из организма нелетучих кислот — глюкуроновой и серной при детоксикации продуктов метаболизма и ксенобиотиков. • Экскреция в кишечник кислых и основных веществ с жёлчью. ЖЕЛУДОК И КИШЕЧНИК Желудок участвует в демпфировании сдвигов КЩР, главным образом, путём изменения секреции соляной кислоты: при защелачивании жидких сред организма этот процесс тормозится, а при закислении — усиливается. Кишечник способствует уменьшению или устранению сдвигов КЩР посредством: • Секреции кишечного сока, содержащего большое количество гидрокарбоната. При этом в плазму крови поступает H+. • Изменения количества всасываемой жидкости. Это способствует нормализации водного и электролитного баланса в клетках, во внеклеточной и других биологических жидкостях и как следствие — — нормализации рН. • Реабсорбции компонентов буферных систем (Na+, K+, Ca2+, Cl–, HCO3–). Поджелудочная железа способствует компенсации сдвигов КЩР при помощи гидрокарбоната. Его секреция увеличивается при алкалозах и уменьшается в условиях ацидоза. ВИДЫ РАССТРОЙСТВ КИСЛОТНО-ЩЕЛОЧНОГО РАВНОВЕСИЯ Расстройства КЩР дифференцируют по нескольким критериям (Табл. 13–4). Таблица 13–4. Виды нарушений кислотнощелочного равновесия
АЦИДОЗ И АЛКАЛОЗ Ацидоз — типовая форма нарушения КЩР, характеризующаяся относительным или абсолютным избытком в организме кислот. В крови при ацидозе наблюдается абсолютное или относительное повышение [I+] и уменьшение рН ниже нормы (условно — ниже средней величины рН, принимаемой за 7,39). Алкалоз типовая форма нарушения КЩР, характеризующаяся относительным или абсолютным избытком в организме оснований. В крови при алкалозе отмечается абсолютное или относительное снижение [I+] или увеличение рН (условно — выше средней величины рН, принимаемой за 7,39). ЭНДО- И ЭКЗОГЕННЫЕ ПРИЧИНЫ АЦИДОЗЫ И АЛКАЛОЗЫ • Эндогенные причины сдвигов КЩР являются наиболее частыми и значимыми в клинической практике. Это объясняется тем, что при многих расстройствах жизнедеятельности различных органов и тканей нарушаются функции как химических буферных систем, так и физиологических механизмов поддержания оптимального КЩР в организме. • Экзогенные причины нарушений КЩР: избыточное поступление в организм веществ кислого или щелочного характера. † ЛС, применяемые с нарушением дозировки и/или схемы лечения (например, салицилаты; растворы для искусственного питания, включающие белки, содержащие кислые вещества: NH4Cl, аргинин·HCl, лизин·HCl, гистидин. При их катаболизме образуется H+). † Токсичные вещества, употребляемые случайно или осознанно (например, метанол, этиленгликоль, паральдегид, соляная кислота). † Продукты питания. Ацидоз нередко развивается у лиц, пользующихся синтетическими диетами (содержат аминокислоты с кислыми свойствами). Потребление в большом количестве щелочных минеральных вод и молока может привести к развитию алкалоза. КОМПЕНСИРОВАННЫЕ И НЕКОМПЕНСИРОВАННЫЕ НАРУШЕНИЯ КЩР Определяющим параметром степени компенсированности нарушений КЩР является величина рН. • Компенсированными сдвигами КЩР считаются такие, при которых рН крови не отклоняется за пределы диапазона нормы: 7,35–7,45. За «нейтральную» величину условно принимают 7,39. Отклонения рН в диапазонах: 7,38–7,35 — компенсированный ацидоз, 7,40–7,45 — компенсированный алкалоз. При компенсированных формах нарушений КЩР возможны изменения абсолютной концентрации компонентов гидрокарбонатной буферной системы (H2CO3 и NaHCO3). Однако, соотношение [Н2CO3]/[NaHCO3] сохраняется в диапазоне нормы (т.е. 20/1 ). • Некомпенсированными нарушениями КЩР называют такие, при которых рН крови выходит за диапазон нормы: При рН 7,34 и ниже — некомпенсированный ацидоз. При рН 7,46 и выше — некомпенсированный алкалоз. Некомпенсированные ацидозы и алкалозы характеризуются значительными отклонениями как абсолютной концентрации H2CO3 и NaHCO3, так и их соотношения. • Некоторые авторы выделяют так называемые субкомпенсированные ацидозы и алкалозы. рН 7,29 — субкомпенсированный ацидоз (ниже 7,29 — некомпенсированный ацидоз). рН 7,56 — субкомпенсированный алкалоз (выше 7,56 — некомпенсированный алкалоз). ГАЗОВЫЕ И НЕГАЗОВЫЕ РАССТРОЙСТВА КЩР По критерию «причины и механизмы развития» расстройства КЩР подразделяют на газовые, негазовые и на смешанные (комбинированные). ГАЗОВЫЕ РАССТРОЙСТВА КЩР Газовые (респираторные) расстройства КЩР (независимо от механизма развития) характеризуются первичным изменением содержания в организме CO2 и, как следствие — концентрации угольной кислоты в соотношении: [HCO3–]/[H2CO3]. При газовом ацидозе знаменатель соотношения (т.е. концентрация угольной кислоты) увеличивается, при газовом алкалозе — уменьшается. • Газовые ацидозы и алкалозы, как правило, длительное время остаются компенсированными. Это обусловлено как активацией физиологических механизмов компенсации (в основном благодаря мобильному уменьшению объёма альвеолярной вентиляции — увеличение при газовом ацидозе и снижение при газовом алкалозе), так и эффектами буферных систем. • Причины развития газовых расстройств КЩР: нарушения альвеолярной вентиляции. В результате этого объём вентиляции лёгких перестаёт соответствовать потребностям (он выше или ниже) газообмена организма за определённое время. Нарушения альвеолярной вентиляции † Снижение объёма альвеолярной вентиляции ведёт к развитию респираторного ацидоза Газовый (респираторный) ацидоз возникает вследствие накопления избытка CO2 в крови и последующего увеличения концентрации в ней угольной кислоты. Такое изменение — характерный признак респираторного ацидоза, наблюдающегося при обструкции дыхательных путей (при бронхиальной астме, бронхитах, эмфиземе лёгких, аспирации инородных тел), нарушении растяжимости лёгких (например, при пневмонии или гемотораксе, ателектазе, инфаркте лёгкого, парезе диафрагмы), увеличении функционального «мёртвого» пространства (например, при пневмосклерозе или гипоперфузии ткани лёгкого), нарушении регуляции дыхания (например, при энцефалитах, расстройствах мозгового кровообращения, полиомиелите). † Повышенное образование эндогенного CO2 приводит к развитию респираторного ацидоза Усиленная продукция СО2 в организме (не компенсированная вентиляцией лёгких) через некоторое время ведёт к развитию газового ацидоза. Такие изменения наблюдаются при активации катаболических процессов у пациентов с лихорадкой, сепсисом, длительными судорогами различного генеза, тепловом ударе, а также при парентеральном введении большого количества углеводов (например, глюкозы). Включение избытка углеводов в метаболизм также сопровождается повышенным образованием CO2. Таким образом, и в данной ситуации накопление в организме CO2 является результатом неадекватной (недостаточной) вентиляции лёгких. † Повышение эффективной альвеолярной вентиляции ведёт к развитию респираторного алкалоза При гипервентиляции (увеличенная эффективная альвеолярная вентиляция) объём вентиляции лёгких превышает необходимый для адекватного выведения CO2, образующегося в организме за данный промежуток времени. Гипервентиляция лёгких обусловливает гипокапнию (снижение pСО2 в крови), снижение уровня угольной кислоты в крови и развитие газового (респираторного) алкалоза. Газовый алкалоз развивается при высотной и горной болезнях; невротических и истерических состояниях; повреждении головного мозга (сотрясении, инсульте, новообразовании); заболеваниях лёгких (например, при пневмонии, астме), при гипертиреозе; выраженной лихорадочной реакции; интоксикации ЛС (например, салицилатами, симпатомиметиками, прогестагенами); почечной недостаточности; чрезмерном и длительном болевом или термическом раздражении; гипертермических и ряде других состояний. Кроме того, развитие газового алкалоза возможно при нарушении режима ИВЛ, приводящем к гипервентиляции. Избыточное поступление в организм углекислого газа ведёт к развитию респираторного ацидоза Избыточное поступление углекислого газа в организи (с последующим образованием угольной кислоты) наблюдается при подаче газовой смеси для дыхания с неадекватно повышенным содержанием CO2 (например, в скафандрах, подводных лодках, летательных аппаратах) или при нахождении большого количества людей в замкнутом пространстве (например, в шахте или небольшом помещении). НЕГАЗОВЫЕ НАРУШЕНИЯ КЩР Негазовые (нереспираторные) нарушения КЩР характеризуются первичным изменением содержания гидрокарбоната в соотношении: [HCO3–]/[H2CO3] При негазовых ацидозах числитель соотношения (т.е. концентрация гидрокарбонатов) уменьшается, а при негазовых алкалозах увеличивается. • Причины развития негазовых нарушений КЩР. † Расстройства обмена веществ, † Нарушения экскреции кислых и основных соединений почками. † Потеря кишечного сока. † Потеря желудочного сока. † Введение в организм экзогенных кислот или оснований. • Виды Негазовые нарушения КЩР характеризуются развитием трёх видов расстройств: метаболических, выделительных и экзогенных ацидозов и алкалозов. • Общая характеристика негазовых расстройств КЩР † Негазовые ацидозы Наиболее характерные проявления негазовых ацидозов ‡ Увеличение (компенсаторное) альвеолярной вентиляции. При тяжёлом ацидозе может регистрироваться глубокое и шумное дыхание — периодическое дыхание Куссмауля. Нередко его обозначают как «ацидотическое дыхание». Причина: увеличение содержания H+ в плазме крови (и других биологических жидкостях) — стимул для инспираторных нейронов дыхательного центра. Однако, по мере уменьшения рCO2 и нарастания степени повреждения нервной системы, возбудимость дыхательного центра снижается: развивается периодическое дыхание. ‡ Нарастающее угнетение нервной системы и ВНД. Это проявляется сонливостью, заторможенностью, сопором, комой (например, при ацидозе у пациентов с СД). Причины: нарушения энергетического обеспечения нейронов мозга, вызванные снижением его кровоснабжения; дисбалансом ионов, а также последующие изменения физикохимических и электрофизиологических свойств нейронов дыхательного центра, ведущие к снижению их возбудимости. ‡ Недостаточность кровообращения. Причины: снижение тонуса сосудов с развитием артериальной гипотензии (вызванная гипокапнией), вплоть до коллапса и уменьшение сердечного выброса. ‡ Снижение кровотока в мозге, миокарде и почках. Это усугубляет нарушение функций нервной системы, сердца, а также обусловливает олигурию (уменьшение диуреза). ‡ Гиперкалиемия. Причина: транспорт избытка ионов H+ в клетку в обмен на K+, выходящий в межклеточную жидкость и плазму крови. ‡ Гиперосмия. Этот признак при негазовом ацидозе обозначается как гиперосмолярный синдром. Причины: увеличение концентрации K+ в крови вследствие повреждения клеток и повышение содержания Na+ в плазме крови вследствие «вытеснения» ионов натрия из их связи с молекулами белков избытком H+. ‡ Отёки. Причины. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
