|
|
Поурочные. поурочные планы по химии А,С,2017. I. Периодический закон, периодическая система химических элементов в свете теории строения атомов
ПЛАН ЗАНЯТИЯ №19
Дата
|
Группа
|
|
С11ЭВМ
|
|
С11ПУ
|
|
СПМ
|
|
П11М
|
Предмет Химия
Тема занятие Проверка знаний по теме «Химические реакции и их закономерность протекания.» Контрольная работа.
Тип урока Урок закрепление. Цель занятия |
Учебная: повторить, систематизировать и обобщить знания
систематизировать знания учащихся о периодичности; научить школьников пользоваться Периодической таблицей; сформулировать общие закономерности, лежащие в основе таблицы.
| о классификации химических реакций, условиях их протекания; | протекания; скорости реакций и зависимости её |
от различных условий;
| Развивающая: развивать умение обобщать, выделять | главное, сравнивать, делать логические выводы, чётко |
отвечать на поставленный вопрос; уметь составлять краткие
|
конспекты;
|
Воспитательная: формировать умение работать
|
самостоятельно и в коллективе – в парах или в командах.
|
ОБЕСПЕЧЕНИЕ ЗАНЯТИЯ
А. Наглядные пособия Слайды с заданиями
Б. Раздаточные материалы Н. Н. Нурахметов, К.Бекишев, Н.А.Заграничная Химия 10 класс.
Содержание этапов урока (основные и необходимые методические пояснение и рекомендации)
|
I. Организационные вопросы
|
Организовать группу к занятии. Через дежурных проверить посещаемость
|
обучающихся.
|
II. Повторение пройденного материала
(виды контроля знаний)
|
III. Изложение нового материала (методика)
|
ІV. Закреплениев нового материала
(выполнение заданий, оценка знаний и др.)
|
Проверочная работа по теме
"Закономерности протекания химических реакций"
Вариант 1.
1. Охарактеризуйте реакцию, уравнение которой предложено, по 4-ем признакам (рассмотренным в теме "Классификация химических реакций"):
kat
3 H2 + N2 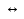 2 NH3 + Q. 2 NH3 + Q.
2. Укажите, от чего зависит скорость реакции в гомогенной среде.
3. Определите куда сместится химическое равновесие в реакции, уравнение которой 2 H2 (г) + O2 (г) 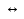 2 H2O (г) + Q 2 H2O (г) + Q
если: а) увеличится концентрация водорода; б) понизится температура;
в) повысится давление. (Ответ напишите словами или укажите направление смещения стрелкой).
4. Определите во сколько раз увеличится скорость химической реакции при повышении температуры на 40 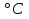 ( (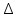 t = 40°), если температурный коэффициент ( t = 40°), если температурный коэффициент (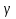 ) равна 2? ) равна 2?
Критерий оценки:
оценка"3"ставится за выполнение 50% работы - 2-ух заданий;
оценка"4"ставится за выполнение 75% работы - 3-ех заданий; оценка"5"ставится за выполнение 100% работы - 4-ех заданий.
Вариант 2.
1. Охарактеризуйте реакцию, уравнение которой предложено, по 4-ем признакам (рассмотренным в теме "Классификация химических реакций"):
kat
4 NH3 + 5 O2 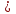 4 NO2+ 6 H2O. 4 NO2+ 6 H2O.
2. Укажите, от чего зависит скорость реакции в гетерогенной среде.
3. Определите куда сместится химическое равновесие в реакции, уравнение которой 2 NO2 (г) + Cl2 (г) 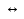 2 NOCl (г) ‒ Q 2 NOCl (г) ‒ Q
если: а) понизится концентрация хлора; б) понизится температура;
в) понизится давление. (Ответ напишите словами или укажите направление смещения стрелкой).
4. Определите во сколько раз увеличится скорость химической реакции при повышении температуры на 20 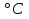 ( (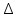 t = 20°), если температурный коэффициент ( t = 20°), если температурный коэффициент (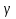 ) равна 3 ) равна 3
Критерий оценки:
оценка"3"ставится за выполнение 50% работы - 2-ух заданий;
оценка"4"ставится за выполнение 75% работы - 3-ех заданий;
оценка"5"ставится за выполнение 100% работы - 4-ех заданий.
Вариант 3.
1. Охарактеризуйте реакцию, уравнение которой предложено, по 4-ем признакам (рассмотренным в теме "Классификация химических реакций"):
CH4 + 4 S 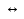 CS2 + 2 H2S + Q. CS2 + 2 H2S + Q.
2. Укажите, как влияет на скорость реакции природа реагирующих веществ и катализатор или ингибитор.
3. Определите куда сместится химическое равновесие в реакции, уравнение которой I2 (т) +5 CO2 (г) 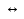 I2O5(г) + 5 CO(г) ‒ Q I2O5(г) + 5 CO(г) ‒ Q
если: а) увеличится концентрация оксида йода; б) повысится температура;
в) повысится давление. (Ответ напишите словами или укажите направление смещения стрелкой).
4. Определите во сколько раз увеличится скорость химической реакции при повышении температуры на 30 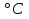 ( (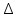 t = 30°), если температурный коэффициент ( t = 30°), если температурный коэффициент (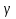 ) равна 4? ) равна 4?
Критерий оценки:
оценка"3"ставится за выполнение 50% работы - 2-ух заданий;
оценка"4"ставится за выполнение 75% работы - 3-ех заданий;
оценка"5"ставится за выполнение 100% работы - 4-ех заданий.
Вариант 4.
1. Охарактеризуйте реакцию, уравнение которой предложено, по 4-ем признакам (рассмотренным в теме "Классификация химических реакций"):
CO2 + C 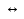 2 CO + Q. 2 CO + Q.
2. Укажите, как влияет на скорость реакции температура и поверхность реагирующих веществ.
3. Определите куда сместится химическое равновесие в реакции, уравнение которой kat
2 SO2 (г) + O2 (г) 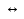 2 SO3 (г) + Q 2 SO3 (г) + Q
если: а) уменьшится концентрация кислорода; б) повысится температура;
в) понизится давление. (Ответ напишите словами или укажите направление смещения стрелкой).
4. Определите, как изменится скорость химической реакции при повышении температуры с 10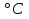 до 40 до 40 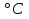 , если температурный коэффициент ( , если температурный коэффициент (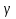 ) равна 3? ) равна 3?
Критерий оценки:
оценка"3"ставится за выполнение 50% работы - 2-ух заданий;
оценка"4"ставится за выполнение 75% работы - 3-ех заданий;
оценка"5"ставится за выполнение 100% работы - 4-ех заданий.
Ответы к проверочной работе по теме
"Закономерности протекания химических реакций"
Вариант 1.
1.Соединение, ОВР, экзотермическая, обратимая.
2.От изменения концентрации одного из вступивших в реакцию или образовавшихся в результате реакции веществ в единицу времени: = 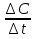 . .
3. а) → (в сторону прямой реакции); б) → (в сторону прямой реакции);
в) → (в сторону прямой реакции).
4. 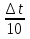 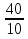
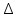 = =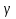 = 2 = 24 = 16, ответ: увеличится в 16 раз. = 2 = 24 = 16, ответ: увеличится в 16 раз.
Вариант 2.
1.Замещение, ОВР, экзотермическая, необратимая.
2.От изменения количества вещества (молей) одного из вступивших в реакцию или образовавшихся в результате реакции веществ в единицу времени: = 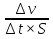 . .
3. а) ← (в сторону обратной реакции); б) ← (в сторону обратной реакции);
в) ← (в сторону обратной реакции).
4. 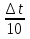 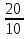
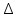 = =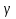 = 3 = 32 = 9, ответ: увеличится в 9 раз. = 3 = 32 = 9, ответ: увеличится в 9 раз.
Вариант 3.
1.Замещение, ОВР, экзотермическая, обратимая.
2.Катализатор - это вещество, которое увеличивает скорость реакции, а ингибитор - замедляет ее. Значение энергии активации (энергия, которую надо сообщить частицам, чтобы превратить их в активные) является тем фактором, посредством которого сказывается влияние природы реагирующих веществ на скорость реакции. Если энергия активации мала – скорость реакции большая, если энергия активации велика – скорость реакции мала.
3. а) → (в сторону прямой реакции); б) → (в сторону прямой реакции);
в) ← (в сторону обратной реакции).
4. 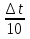 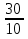
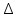 = =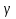 = 4 = 43 = 64, ответ: увеличится в 64 раз. = 4 = 43 = 64, ответ: увеличится в 64 раз.
Вариант 4.
1.Замещение, ОВР, экзотермическая, обратимая.
2.Температура: при повышении температуры на каждые 10o скорость реакции увеличивается в 2 - 4 раза (правило Вант - Гоффа). Поверхность соприкосновения реагирующих веществ (для твердых веществ). При растворении или измельчении веществ скорость реакции увеличивается.
3. а) ← (в сторону обратной реакции); б) ← (в сторону обратной реакции);
в) ← (в сторону обратной реакции).
4. 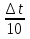 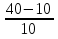 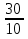
 = =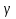 = 3 = 3 = 33 = 27, ответ: увеличится в 27 раз. = 3 = 3 = 33 = 27, ответ: увеличится в 27 раз.
|
V. Домашнее задание
|
Учебник Н. Н. Нурахметова «Химия» 10 класс, §4.1 – 4.5 повторить.
|
VI. Подведение итогов урока
(Выставление оценок с комментарием, выяснение положительных и отрицательных моментов урока)
|
1. Выставление оценок с комментарием,
|
2. Выяснение положительные и отрицательные моментов урока
|
Преподаватель_____________ А.С.Ингенбаева
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РЕСПУБЛИКИ КАЗАХСТАН
ТАЛДЫКОРГАНСКИЙ КОЛЛЕДЖ СЕРВИСА И ТЕХНОЛОГИИ
|
|
|
 Скачать 0.83 Mb.
Скачать 0.83 Mb.