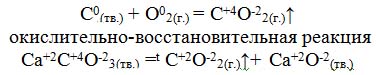|
|
Поурочные. поурочные планы по химии А,С,2017. I. Периодический закон, периодическая система химических элементов в свете теории строения атомов
ПЛАН ЗАНЯТИЯ №17
Дата
|
Группа
|
|
С11ЭВМ
|
|
С11ПУ
|
|
СПМ
|
|
П11М
|
Предмет Химия
Тема занятия Окислительно-восстановительные реакции.
Тип урока Комбинированный урок. Цель занятия |
Учебная: Знать окислительно-восстановительные
систематизировать знания учащихся о периодичности; научить школьников пользоваться Периодической таблицей; сформулировать общие закономерности, лежащие в основе таблицы.
| реакции. | Развивающая: уметь составлять уравнения реакции и | написать в виде электронного баланса. |
Воспитательная: воспитывать обучающихся работать
| группой, организованности, уметь пользоваться таблицами. |
ОБЕСПЕЧЕНИЕ ЗАНЯТИЯ
А. Наглядные пособия Слайды «Окислительно-восстановительные реакции.»
Б. Раздаточные материалы Н. Н. Нурахметов, К.Бекишев, Н.А.Заграничная Химия 10 класс.
Содержание этапов урока (основные и необходимые методические пояснение и рекомендации)
|
I. Организационные вопросы
|
Организовать группу к занятии. Через дежурных проверить посещаемость
|
обучающихся.
|
II. Повторение пройденного материала
(виды контроля знаний)
|
1. Фронтальная беседа с группой по вопросам.
|
- Основные типы химических реакции.
|
- Реакция разложения.
|
- Реакция обмена.
|
- Реакция присоединения.
|
- Рекция замещения.
|
III. Изложение нового материала (методика)
|
1.Раздать краткий курс лекций по теме.
2. Показать слайды и объяснять тему с словесным и деманстрационным методом.
3. Записать в тетрадях основные понятия.
Одним из свойств атомов является способность отдавать или принимать электроны, участвуя в образовании химической связи.
- Как называется условный заряд, который приобретают атомы отдавая или принимая электроны? Степень окисления.
- Какие значения может иметь степень окисления? +, 0, -. Предельное число электронов на внешнем энергетическом уровне 8.
- Каким образом элементы могут достичь этого состояния?
- Давайте вспомним с вами, что происходит с атомами химических элементов, когда они отдают или принимают электроны. Для этого рассмотрим строение электронных оболочек атомов. Тенденцию к отдаче электронов имеют атомы металлов, к приему электронов атомы неметаллов.
- Вспомните, как изменяются эти свойства в периоде, группе?

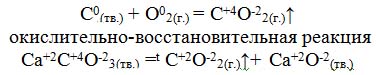
не окислительно – окислительная реакция
2Н20+ O20= 2Н+12O-2
Н20– 2е →2 Н+1– процесс окисления, молекула отдает 2 электрона,
Н20– восстановитель.
O20+4е →2О-2 – процесс восстановления, молекула принимает два электрона,
O20 – окислитель
Работа с терминами. Обучающиеся сами формулируют определения.
Окисление – это процесс отдачи электронов атомами, молекулами, ионами.
Восстановитель–это частица (атом, молекула или ион), которая отдает электроны.
Восстановление – процесс присоединения электронов атомами, молекулами, ионами
Окислитель– это частица (атом, молекула или ион), которая принимает электроны.
Обучающиеся смотрят определения в учебнике с. 229–231, сравнивают.
Окислительно-восстановительная реакция – это единство процессов окисления и восстановления.
|
ІV. Закреплениев нового материала
(выполнение заданий, оценка знаний и др.)
|
V. Домашнее задание
|
Учебник Н. Н. Нурахметова «Химия» 10 класс прочитать.
|
VI. Подведение итогов урока
(Выставление оценок с комментарием, выяснение положительных и отрицательных моментов урока)
|
1. Выставление оценок с комментарием,
|
2. Выяснение положительные и отрицательные моментов урока
|
Преподаватель_____________ А.С.Ингенбаева
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РЕСПУБЛИКИ КАЗАХСТАН
ТАЛДЫКОРГАНСКИЙ КОЛЛЕДЖ СЕРВИСА И ТЕХНОЛОГИИ
|
|
|
 Скачать 0.83 Mb.
Скачать 0.83 Mb.