|
Поурочные. поурочные планы по химии А,С,2017. I. Периодический закон, периодическая система химических элементов в свете теории строения атомов
ПЛАН ЗАНЯТИЯ №10
Дата
|
Группа
|
|
С11ЭВМ
|
|
С11ПУ
|
|
СПМ
|
|
П11М
|
Предмет Химия
Тема занятия Практическая работа №1 «Изготовление моделей молекул».
Тип урока Лабораторно-практическое занятие. Урок закрепление.
Цель занятия | Учебная: Знать изготовить модели молекул различных | атомов, собрать шаростерженевые и масштабные модели | молекул веществ, правила по технике безопасности при работе | работе в кабинете химиии. | Развивающая: Уметь практический построить моделей | используя детали готовых наборов или пластилин и палочки. |
Воспитательная: воспитывать обучающихся работать
| группой, организованности, уметь пользоваться таблицами. |
ОБЕСПЕЧЕНИЕ ЗАНЯТИЯ
А. Наглядные пособия Видеоопыты «Изготовление моделей молекул».
Б. Раздаточные материалы Н. Н. Нурахметов, К.Бекишев, Н.А.Заграничная Химия 10 класс, инструкции к выполнению практических работ.
Содержание этапов урока (основные и необходимые методические пояснение и рекомендации)
|
I. Организационные вопросы
|
Организовать группу к занятии. Через дежурных проверить посещаемость
|
обучающихся.
|
II. Повторение пройденного материала
(виды контроля знаний)
|
1. Фронтальная беседа с группой по вопросам.
|
- Какие связи мы называем ковалентной связью?
|
- Какие виды ковалентной связи бывают?
|
- Какие связи мы называем ковалентной неполярной связью?
|
- Какие связи мы называем ковалентной полярной связью?
|
- Какие связи мы называем водородной связью?
|
III. Изложение нового материала (методика)
|
Раздать инструкции к выполнению прктических работ.
- Что нам нужно для выполнения этой работы?
- Как мы будем делать эту работу?
2. Показать видеофильм «Изготовление моделей молекул».
3. Оформить практическую работу и сделать соответствующие выводы.
Практическая работа №1
«Изготовление моделей молекул».
Цель работы: Знать изготовить модели молекул различных атомов,
уметь собрать шаростерженевые и масштабные модели
молекул веществ, соблюдать правилу по технике безопасности
при работе в кабинете химиии.
Оборудование: пластилин и спичечные палочки.
Алгоритм проведения работы:
1. Постройте шаростерженевые и масштабные модели молекул.
2. Для построения моделей используйте детали готовых наборов или пластилин и палочки.
3. Для изготовления модели состоящих из разных атомов, используйте пластилин разных цветов.
4. Соберите шаростерженевые и масштабные модели молекул фтороводорода, хлороводорода, йодоводорода, воды, сероводорода.
5. Ответьте на такие вопросы: Какие связи между атомами этих веществ? Что означает одна палочка между атомами? Какие связи в их молекуле? Сделайте выводы.
Заключение: Обратите внимание на атомы: атомы металлов или неметаллы
Ход работы:
НҒ - фтороводород
+1Н 1ē 1S1
+9Ғ 2ē, 7ē ...2S22Р5
••
Н• + •Ғ: → Н: Ғ или Н— Ғ
••
В молекуле фтороводорода ковалентно-полярная связь, она имеет линейную форму, так как образуется за счет перекрывания s-орбитали атома водорода с р-орбиталью атома фтора.
НCl – хлороводород
+1Н 1ē 1S1
+17Cl 7ē ...3S23Р5
••
Н• + • Cl: → Н: Cl или Н— Cl
••
В молекуле хлороводорода ковалентно-полярная связь, она имеет линейную форму, так как образуется за счет перекрывания s-орбитали атома водорода с р-орбиталью атома хлора.
НІ – йодоводород
+1Н 1ē 1S1
+53І 7ē ...5S25Р5
••
Н• + •І: → Н: І или Н— І
••
В молекуле йодороводорода ковалентно-полярная связь, она имеет линейную форму, так как образуется за счет перекрывания s-орбитали атома водорода с р-орбиталью атома йода.
Н2О – вода
+1Н 1ē 1S1
+8О 6ē ...2S2 2Р4
••
Н• + •О• + •Н → Н: О: Н или О
•• ⁄ \
Н Н
В молекуле воды водородная связь, при образовании молекулы воды двух валентный атом кислорода с двумя валентными р-электронами образует с водородом угловую форму молекулы.
Н2S – сероводород
+1Н 1ē 1S1
+16S 6ē ...3S23Р4
••
Н• + • S • + •Н → Н: S: Н или S
•• ⁄ \
Н Н
В молекуле сероводорода ковалентно - полярная связь, при образовании молекулы сероводорода двух валентный атом кислорода с двумя валентными р-электронами образует с водородом угловую форму молекулы.
|
ІV. Закрепление нового материала
(выполнение заданий, оценка знаний и др.)
|
1 – задание
|
Отразите электронную конфигурацию атомов следующих молекул в квантовых ячейках: О2, Ғ2, НВr, N2, ОҒ2.
|
2 – задание
|
Определите возможные валентности следующих элементов исходя из валентных орбиталей их атомов: цезия, таллия, азота, фтора, селена, неона.
|
3 – задание
При полном сгорании неизвестного вещества массой 0,34г образуются 0,64г оксида серы (IV) 0,18г воды. Определите формулу соединения.
|
V. Домашнее задание
|
Учебник Н. Н. Нурахметова «Химия» 10 класс, 5-37стр. 160-176 прочитать,
|
Подготовиться к контрольной работе по теме «Периодический закон,
|
периодическая система химических элементов в свете теории строения
|
атомов».
|
VI. Подведение итогов урока
(Выставление оценок с комментарием, выяснение положительных и отрицательных моментов урока)
|
1. Выставление оценок с комментарием,
|
2. Выяснение положительные и отрицательные моментов урока
|
Преподаватель_____________ А.С.Ингенбаева
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РЕСПУБЛИКИ КАЗАХСТАН
ТАЛДЫКОРГАНСКИЙ КОЛЛЕДЖ СЕРВИСА И ТЕХНОЛОГИИ
ПЛАН ЗАНЯТИЯ №11
Дата
|
Группа
|
|
С11ЭВМ
|
|
С11ПУ
|
|
СПМ
|
|
П11М
|
Предмет Химия
Тема занятия Контрольная работа
Тип урока Урок закрепление.
Цель занятия | Учебная: проверить знаний по теме «Химическая связь и
|
и строение вещества.»
| Развивающая: Уметь составлять схемы образования | молекул веществ, написать образования связи в | электронном виде. |
Воспитательная: воспитывать обучающихся работать
| группой, организованности, уметь пользоваться таблицами. |
ОБЕСПЕЧЕНИЕ ЗАНЯТИЯ
А. Наглядные пособия Слайды с заданиями по теме.
Б. Раздаточные материалы Н. Н. Нурахметов, К.Бекишев, Н.А.Заграничная Химия 10 класс, задании контрольной работы.
Содержание этапов урока (основные и необходимые методические пояснение и рекомендации)
|
I. Организационные вопросы
|
Организовать группу к занятии. Через дежурных проверить посещаемость
|
обучающихся.
|
II. Повторение пройденного материала
(виды контроля знаний)
|
III. Изложение нового материала (методика)
|
ІV. Закрепление нового материала
(выполнение заданий, оценка знаний и др.)
|
Проверочная работа по теме «Химическая связь и строение вещества»
1 Вариант.
1. Металлы- это элементы, атомы которых всегда легко принимают электроны.
1) да 2) нет
2.В периодах слева направо постепенно усиливаются металлические свойства.
1) да 2) нет
3. У металлов электроотрицательность, как правило, меньше двух, а у неметаллов больше двух.
4. Химическая связь образуется в результате …….
5. Ковалентная химическая связь образуется между атомами…..одного вида называется …..
6. Из перечисленных ниже веществ выпишите формулы веществ с ковалентной полярной химической связью.
а) H2 б) HCl в) KCl г) N2O
7. Указать группу веществ только с ионной связью
а) KCl, H2O, N2 в)BaCl2,K2S,ZiF
б) J2, NH3, CaO г) H2O, CO2, PH3
8. Какой тип кристаллических решёток соответствует веществам.
формулы
|
кристаллическая решётка
|
а) Cu
б) H2O
в) KCl
г) C
|
1. ионная
2. молекулярная
3.атомная
4.металлическая
|
9. Из перечисленных ниже веществ выпишите формулы, в которых степень окисления хлора равна -1.
а) Cl 2 б)NaCl в) HClO г) Cl2O7
10. Какие из ниже приведённых уравнений химических реакций не являются окислительно-восстановительными:
а) ZnO + HCl в) KClO3
б) CaCO3 г) Al + S
2 Вариант.
1.Из формул веществ, формулы которых приведены ниже, выпишите формулы веществ, молекулы которых образованы ковалентной полярной связью
а) N ::: N в) K+ (:Вr:)-
б) H : Cl г) H:O:H
2. К какому виду связи относится связь между натрием и хлором в хлориде натрия?
а) ионная б) металлическая в) ковалентная полярная
3.В какой молекуле степень окисления равна нулю, а валентность – трём?
1) О2 2) BF3 3) N2 4) CO
4. Укажите номера оксидов, где связь ионная:
1) оксид хлора (V) 4) оксид цезия
2) оксид серы (VI) 5) оксид фосфора
3) оксид азота (II) 6)оксид кальция
5. В каком веществе образуется металлическая связь?
1) NH 2) CO2 3) H2O 4) Fe
6. В какой из данных молекул полярность связи выше?
1) HCl 2) HJ 3) HBr 4) HF
7. Какое из веществ имеет ионный тип связи:
1) NaCl 2) HCl 3) Cl2 4) HClO
8. В какой молекуле полярность связи выше?
1) NH3 2) AlH3 3) PH3 4) SвH3
9.В какой молекуле степень окисления элемента равна нулю, а валентность –единице?
1) Cl2 2) HCl 3) N2 4) NH3
10. Расположите номера соединний в порядке возрастания полярности с кислородом:
1) NaO2 2)B2O3 3) CO2 4) H2O 5) NO
|
V. Домашнее задание
|
Учебник Н. Н. Нурахметова «Химия» 10 класс, повторить § 3.1 -3.6
|
VI. Подведение итогов урока
(Выставление оценок с комментарием, выяснение положительных и отрицательных моментов урока)
|
1. Выставление оценок с комментарием,
|
2. Выяснение положительные и отрицательные моментов урока
|
Преподаватель_____________ А.С.Ингенбаева
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РЕСПУБЛИКИ КАЗАХСТАН
ТАЛДЫКОРГАНСКИЙ КОЛЛЕДЖ СЕРВИСА И ТЕХНОЛОГИИ
ПЛАН ЗАНЯТИЯ №12
Дата
|
Группа
|
|
С11ЭВМ
|
|
С11ПУ
|
|
СПМ
|
|
П11М
|
Предмет Химия
Тема занятие IІІ. Химические реакции и их закономерность протекания. Химические реакции, их классификация.
Тип урока Урок новых знаний. Цель занятия |
Учебная: Знать типы химических реакций, их классифика -
систематизировать знания учащихся о периодичности; научить школьников пользоваться Периодической таблицей; сформулировать общие закономерности, лежащие в основе таблицы.
| цию. | Развивающая: уметь составлять уравнений реакции и | определить тип реакции. |
Воспитательная: воспитывать обучающихся работать
| группой, организованности, уметь пользоваться таблицами. |
ОБЕСПЕЧЕНИЕ ЗАНЯТИЯ
А. Наглядные пособия Слайды «Химические реакции, их классификация.»
Б. Раздаточные материалы Н. Н. Нурахметов, К.Бекишев, Н.А.Заграничная Химия 10 класс.
Содержание этапов урока (основные и необходимые методические пояснение и рекомендации)
|
I. Организационные вопросы
|
Организовать группу к занятии. Через дежурных проверить посещаемость
|
обучающихся.
|
II. Повторение пройденного материала
(виды контроля знаний)
|
1. Фронтальная беседа с группой по вопросам.
|
- Какие типы химических реакции Вы знаете?
|
III. Изложение нового материала (методика)
|
1.Раздать краткий курс лекций по теме.
2. Показать слайды и объяснять тему с словесным и деманстрационным методом.
3. Записать в тетрадях основные понятия.
Логическое задание «третий лишний». (высвечивается через кодоскоп)
Найти закономерность по одному из 3-х признаков, определить какая из реакций в каждой из 3-х групп не вписывается в общую закономерность, и объяснить какую теорию выбрали.
2Na + S → Na2S Na2O + H2O → 2NaOH
2HgO → 2Hg + O2 Zn + 2HCl → ZnCl2 + H2
Mg + O2 → 2MgO CaCO3 →CaO +CO2
H2SO4(p) + BaCl2(p) → BaSO4↓ + 2HCl
H2SO4(p) + 2NaOH(p) → Na2SO4 + 2H2O
H2SO4(к) +2NaCl(т) → Na2SO4 + 2HCl
5. На столах задание (см. приложение 1) рассчитано для работы на 2-х уроках. На первом уроке мы заполняем только часть, классифицируем по 3-м основным признакам.
В первую графу таблицы типов реакций (см приложение 2), используя текст учебника выбираем и выписываем только те основные классификационные признаки, которые отвечают 3-м пунктам МКТ, т.е. руководствуемся позициями атомно-молекулярного учения, ТЭД и электронной теорией О.-В. процессов. Типы реакций во второй графе должны соответствовать этим признакам.
Предложенные 10 реакций распределить по группам в соответствии с признаком.
Проверить задание через кодоскоп. Обратить внимание обучащихся на допущенные ошибки. Обучающиеся выставляют себе первую оценку: задание без ошибок – 5; одна ошибка – «4»; 2 ошибки – «3»; более двух – оценка «2».
6. Работа с сигнальными карточками / «светофоры» - красный, зелёный/.
Рассматриваются конкретные реакции, с точки зрения различных признаков классификации. Уравнения реакций высвечиваются через кодоскоп или крепятся на магнитной доске. 1). 2KCl + H2SO4 → K2SO4 + 2HCl
2). Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O
3). N2 + O2 → 2NO2
4). 2KI + Pb(NO3)2 → 2KNO3 + PbI2↓
- 2 вопроса на каждую реакцию: является ли данная реакция
О.-В, реакцией замещения и т.д. Если обучающиеся согласны – поднимают зелёную карточку, нет – красную. При разногласии приводят аргументы доказывающие или опровергающие данное суждение. Каждыю верный ответ отмечают знаком «+».
Выставляется вторая оценка: восемь плюсов – «5»; 7 – «4»; 6 или 5 – «3»; менее 5 – «2».
7. Самостоятельная работа с индивидуальными карточками.
Обучающимся предлагается по 2 уравнения реакций (количество вариантов по числу учащихся в классе). Указать тип реакции по каждому из трёх классификационных признаков.
Примерные варианты заданий:
1. MgCO3 → MgO + CO2 10. 4CrO3 → 2Cr2O3 + 3O2
K2SO3 + H2SO4 → K2SO4 + H2O + SO2 K2S + CuCl2 → CuS↓ + 2KCl
2. CaO + CO2 → CaCO3 11. WO3 + 3H2 → W + 3H2O
Mg + 2HCl → MgCl2 + H2 2KClO3 → 2KCl + 3O2
3. 2HgO → 2Hg + O2 12. 2N2O → 2N2 + O2
2SO2 + O2 → 2SO3 Cl2 + 2NaBr → 2NaCl + Br2
4. 2AgNO3 → 2Ag + 2NO2 + O2 13. KOH + HCl → KCl + H2O
NaOH + HNO3 → NaNO3 + H2O F2 + 2KI → 2KF + I2
5. Fe + CuSO4 → FeSO4 + Cu 14. Cr2O3 + 2Al → Al2O3 + 2Cr
2HNO3 + Ba(OH)2 → Ba(NO3)2 + 2H2O 2KNO3 → 2KNO2 + O2
6. 6Li + N2 → 2Li3N 15. H2 + Cl2 → 2HCl
2KI + Pb(NO3)2 → PbI2↓ + 2KNO3 AgNO3 + NaCl → AgCl↓ +
NaNO3
7. MgO + CO2 → MgCO3 16. NH4NO3 → N2O + 2H2O
BaCl2 + K2SO4 → BaSO4↓ + 2KCl P2O3 + 3H2O → 2H3PO3
8. TiCl4 + 2Mg → Ti + 2MgCl2 17. MgO + 2HCl → MgCl2 + H2O
CuO + 2HCl → CuCl2 + H2O 2Fe(OH)3 → Fe2O3 + 3H2O
9. 2H2O2 → 2H2O + O2 18. 2CaH2 + Si → Ca2Si + 2H2
Na2CO3 + 2HCl → 2NaCl + CO2 + H2O CaO + H2SO4 → CaSO4 + H2O
|
ІV. Закреплениев нового материала
(выполнение заданий, оценка знаний и др.)
|
V. Домашнее задание
|
Учебник Н. Н. Нурахметова «Химия» 10 класс, стр. 102 прочитать.
|
VI. Подведение итогов урока
(Выставление оценок с комментарием, выяснение положительных и отрицательных моментов урока)
|
1. Выставление оценок с комментарием,
|
2. Выяснение положительные и отрицательные моментов урока
|
Преподаватель_____________ А.С.Ингенбаева
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РЕСПУБЛИКИ КАЗАХСТАН
ТАЛДЫКОРГАНСКИЙ КОЛЛЕДЖ СЕРВИСА И ТЕХНОЛОГИИ
ПЛАН ЗАНЯТИЯ №13
Дата
|
Группа
|
|
С11ЭВМ
|
|
С11ПУ
|
|
СПМ
|
|
П11М
|
Предмет Химия
Тема занятия Гидролиз солей.
Тип урока Комбинированный урок. Цель занятия |
Учебная: Знать гидролиз солей.
систематизировать знания учащихся о периодичности; научить школьников пользоваться Периодической таблицей; сформулировать общие закономерности, лежащие в основе таблицы.
| Уметь составлять уравнения. | Развивающая: развитие внимания и логического мышления |
Воспитательная: воспитывать обучающихся работать
| группой, организованности, уметь пользоваться таблицами. |
|
ОБЕСПЕЧЕНИЕ ЗАНЯТИЯ
А. Наглядные пособия Слайды «Гидролиз солей. Скорость химической реакции.»
Б. Раздаточные материалы Н. Н. Нурахметов, К.Бекишев, Н.А.Заграничная Химия 10 класс.
Содержание этапов урока (основные и необходимые методические пояснение и рекомендации)
|
I. Организационные вопросы
|
Организовать группу к занятии. Через дежурных проверить посещаемость
|
обучающихся.
|
II. Повторение пройденного материала
(виды контроля знаний)
|
1. Фронтальная беседа с группой по вопросам.
|
- Процесс окисление.
|
- Процесс восстановление.
|
- Окислитель.
|
- Восстановитель.
|
- Окислительно – восстановительные реакции.
|
III. Изложение нового материала (методика)
|
1.Раздать краткий курс лекций по теме.
2. Показать слайды и объяснять тему с словесным и деманстрационным методом.
3. Записать в тетрадях основные понятия.
Какие ионы окрашивают лакмус в красный цвет?
Какие ноны отвечают за цвет индикатора в щелочной среде?
Есть ли эти ионы в солях?
Является ли вода электролитом?
На какие ионы диссоциирует вода?
Вспомним, что вода – слабый электролит и в чистой воде происходит процесс: НОН ↔ Н+ + ОН- и существует равенство концентрации:
[H+] = [OH –] = 10 – 7 моль/л.
pH = 7
Вопрос: «Что же называется гидролизом? ».
«Гидро» - вода, «лизис» - разложение.
Делается вывод, что гидролиз – это взаимодействие между некоторыми солями и водой.
Запишем: гидролиз – это обратимое взаимодействие между некоторыми солями и водой.
Рассмотрим, что же происходит при взаимодействии соли с водой? Составим уравнение реакции: молекулярное, полное и сокращенное ионные.
AlCl3 + HOH ↔ HCl + AlOHCl2
Al3+ + 3Cl – + HOH ↔ H+ + Cl – + AlOH2+ + 2Cl –
Al3+ + HOH ↔ AlOH2++ H+
pH<7,
[H+] > [OH –].
Соль, образованная слабым основанием и сильной кислотой, имеет кислую реакцию, так как в растворе избыток ионов водорода.
Предлагаю одному из учащихся составить уравнение реакции гидролиза, записав его на доске:
Na2CO3 + HOH ↔ NaOH + NaHCO3
2Na+ + CO32 – + HOH ↔ Na+ + OH – + Na+ + HCO3–
CO32 – + HOH ↔ OH– + HCO3–
pH>7,
[H+] < [OH –].
Соль, образованная сильным основанием и слабой кислотой, имеет щелочную реакцию, так как в растворе избыток гидроксид-ионов.
Предлагаем одному из учащихся составить уравнение реакции гидролиза, записав его на доске:
NaCl + HOH ↔ NaOH + HCl
Na+ + Cl – + HOH ↔ Na+ + OH – + H+ + Cl –
HOH ↔ OH– + H+
pH=7,
[H+] = [OH –].
Обсудим следующие вопросы (фронтально, слайд 2):
Зачем нужны знания о скорости химических реакций?
Какими примерами можно подтвердить то, что химические реакции протекают с различными скоростями?
Как определяют скорость механического движения? Какова единица измерения этой скорости?
Как определяют скорость химической реакции?
Какие условия необходимо создать, чтобы началась химическая реакция?
Прогнозируемая деятельность обучающихся
На примерах обучающиеся судят о скорости реакций и делают соответствующие выводы. Запись на доске проделанных реакций (двое обучающихся).
В первой пробирке реакция произошла мгновенно, во второй – видимых изменений пока нет.
Составим уравнения реакций (два ученика записывают на доске уравнения):
CuSO4 + 2КOH = Cu(OH)2 + К2SO4 ; Cu2+ + 2OH- = Cu(OH)2
Fe + CuSO4 = FeSO4 + Cu ; Fe0 + Cu2+ = Fe2++ Cu0
- Какой вывод по проведённым реакциям мы можем сделать?
- Почему одна реакция идёт мгновенно, другая медленно? Для этого необходимо вспомнить, что есть химические реакции, которые протекают во всём объёме реакционного пространства (в газах или растворах), а есть другие, протекающие лишь на поверхности соприкосновения веществ (горение твёрдого тела в газе, взаимодействие металла с кислотой, солью менее активного металла).
Прогнозируемая деятельность обучающихся
По результатам демонстрированного эксперимента учащиеся делают вывод: реакция 1 – гомогенная, а реакция
2– гетерогенная.
Скорости этих реакций будут математически определяться по-разному.
Учение о скоростях и механизмах химических реакций называется химической кинетикой.
3. Усвоение новых знаний и способов действий(Слайд 3)
Скорость реакции определяется изменением количества вещества в единицу времени
В единице V
(для гомогенной)
На единице поверхности соприкосновения веществ S (для гетерогенной)

Очевидно, что при таком определении величина скорости реакции не зависит от объёма в гомогенной системе и от площади соприкосновения реагентов – в гетерогенной.
Прогнозируемая деятельность обучающихся
Активные действия обучающихся с объектом изучения. Занесение таблицы в тетрадь.
Из этого следуют два важных момента (слайд 4):
1) по приведённым формулам можно рассчитать лишь некоторую среднюю скорость данной реакции в выбранном интервале времени (ведь для большинства реакций скорость уменьшается по мере их протекания);
2) рассчитанная величина скорости будет зависеть от того, по какому веществу её определяют, а выбор последнего зависит от удобства и лёгкости измерения его количества.
Например, для реакции 2Н2 +О2 = 2Н2О:
υ (по Н2) = 2 υ (по О2) = υ (по Н2О)
Последнее заключение на основе экспериментальных исследований сделал в прошлом веке голландский физикохимик Я. Вант-Гофф (первый нобелевский лауреат по химии).
Число, показывающее, во сколько раз увеличивается скорость реакции при повышении температуры на 100С, называют температурным коэффициентом.
Правило Вант-Гоффа математически выражается следующей формулой:
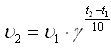 , ,
где υ2–скорость реакции при температуре t2, υ1– скорость реакции при температуре t1, γ – температурный коэффициент.
Решим задачу с использованием правила Вант – Гоффа.
Известно, чем больше концентрации реагирующих веществ, тем больше скорость химической реакции. Дайте этому объяснение.
Ответ. Непременным условием химического взаимодействия является столкновение частиц исходных веществ, чем больше концентрация, тем больше число столкновений, а среди них и эффективных соударений.
Уточняем. Термин «концентрация» обычно используется по отношению к растворам, но его можно применить и к газам. В этом случае о концентрации судят по давлению газов.
На основе большого экспериментального материала в 1867 г. норвежские учёные К. Гульдберг, и П Вааге и независимо от них в 1865 г. русский учёный Н.И. Бекетов сформулировали основной закон химической кинетики, устанавливающий зависимость скорости реакции от концентраций реагирующих веществ: скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степенях равных их коэффициентам в уравнении реакции. Этот закон ещё называют законом действующих масс(слайд 15).
По закону действующих масс скорость реакции, уравнение которой А+В=С может быть вычислена по формуле: v1= k1CACB, а скорость реакции, уравнение которой А+2В=D, может быть вычислена по формуле:
v2= k2CACB2.
В этих формулах: CAи CB – концентрации веществ А и В (моль/л), k1 и k2 – коэффициенты пропорциональности, называемые константами скоростей реакции. Эти формулы также называют кинетическими уравнениями.
Константа скорости реакции, конечно, зависит от температуры, ведь чем больше температура, тем больше скорость реакции при тех же самых концентрациях реагирующих веществ. Закон действующих масс учитывает лишь концентрации газообразных или растворённых веществ и не учитывает концентрации твёрдых веществ (так как они считаются постоянными).
|
ІV. Закреплениев нового материала
(выполнение заданий, оценка знаний и др.)
|
V. Домашнее задание
|
Учебник Н. Н. Нурахметова «Химия» 10 класс, 102 – 111 стр. прочитать, упр. 7, 8 на стр.111 выполнить в тетрадях.
|
VI. Подведение итогов урока
(Выставление оценок с комментарием, выяснение положительных и отрицательных моментов урока)
|
1. Выставление оценок с комментарием,
|
2. Выяснение положительные и отрицательные моментов урока
|
Преподаватель_____________ А.С.Ингенбаева
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РЕСПУБЛИКИ КАЗАХСТАН
ТАЛДЫКОРГАНСКИЙ КОЛЛЕДЖ СЕРВИСА И ТЕХНОЛОГИИ
ПЛАН ЗАНЯТИЯ №14
Дата
|
Группа
|
|
С11ЭВМ
|
|
С11ПУ
|
|
СПМ
|
|
П11М
|
Предмет Химия
Тема занятие Практическая работа №2. «Получение гидроксидов и изучение их свойств».
Тип урока Лабораторно-практическое занятие. Урок закрепление
Цель занятия | Учебная: Знать лабораторный способ получения гидроксидов |
и изучение их свойств, знать правилу по технике
| безопасности при работе с неорганическими веществами. | Развивающая: Уметь практический доказывать свойства | гидроксидов характерными реакциями. Уметь | составлять уравнения реакций, доказывающие свойства | гидроксидов, проводить наблюдения, делать выводы, | соблюдать правила по технике безопасности при работе в | кабинете химии. |
Воспитательная: воспитывать обучающихся работать
| группой, организованности, уметь пользоваться таблицами. |
ОБЕСПЕЧЕНИЕ ЗАНЯТИЯ
А. Наглядные пособия Видеоопыты «Получение гидроксидов и изучение их свойств».
Б. Раздаточные материалы Н. Н. Нурахметов, К.Бекишев, Н.А.Заграничная Химия 10 класс, инструкции к выполнению практических работ.
Содержание этапов урока (основные и необходимые методические пояснение и рекомендации)
|
I. Организационные вопросы
|
Организовать группу к занятии. Через дежурных проверить посещаемость
|
обучающихся.
|
II. Повторение пройденного материала
(виды контроля знаний)
|
1. Фронтальная беседа с группой по вопросам.
|
- Какие соединеия мы называем гидроксидами?
|
- Какому классу неорганических соединений они относятся?
|
- Какие основания мы называем шелочами?
|
- На какие группы делятся основании?
|
- Какие гидроксиды относятся к амфотерным гидроксидам?
|
III. Изложение нового материала (методика)
|
Раздать инструкции к выполнению прктических работ.
- Какие реактивы и оборудования нам нужны для выполнения этой работы?
- Как мы будем делать эту работу?
2. Показать видеофильм «Получение гидроксидов и изучение их свойств».
3. Оформить практическую работу и сделать соответствующие выводы.
Практическая работа №2
«Получение гидроксидов и изучение их свойств».
Цель работы: Знать лабораторный способ получения гидроксидов и
изучение свойств. Уметь практический доказывать свойства
гидроксидов характерными реакциями, проводить
наблюдения, делать выводы соблюдать правила по технике
безопасности при работе в кабинете химии.
Реактивы: Оксид кальция, вода, индикаторы, растворы кислот, гидроксид натрия, сульфат меди, хлорид цинка.
Оборудование: пробирки, стеклянная трубочка, спиртовка, спички.
Примечание: Серной и соляной кислотой, щелочами надо работать очень в
осторожно!
Алгоритм проведения работы:
І. Получение гидроксида кальция
1. В пробирку поместите 0,5г оксида кальция и налейте 3-4 мл воды. Полученный раствор разделите на три части и в каждую добавьте по одной капле различных индикаторов.
2. Растворы в двух пробирках нейтрализуйте растворами различных кислот.
3. Через раствор, находящейся в третьей пробирке, с помощью стеклянной трубочки продуйте воздух. Что происходит в каждой пробирке? Объясните наблюдаемые изменения и запишите уравнения протекающих реакций.
ІІ. Получение нерастворимого гидроксида меди (II)
1. В чистую пробирку налейте 1-2 мл гидроксида натрия и добавьте несколько капель сульфата меди до образования осадка.
2. Полученное основание разделите на две части. Проверьте, как ведут себя не растворимые в воде основания при добавлении раствора кислоты и при нагревании. Запишите уравнения реакций. Сравните химические свойства щелочей и нерастворимых в воде оснований.
ІІІ. Получение амфотерного гидроксида цинка
1. Налейте в пробирку 1 мл хлорида цинка и по каплям добавляйте раствор гидроксида натрия до образования студенистого осадка.
2. Полученное основание разделите на две части. К одной части добавьте раствор кислоты, а ко второй – раствор щелочи. Объясните наблюдаемые изменения и запишите уравнения протекающих реакций. Сделайте вывод о свойствах гидроксидов: щелочей, нерастворимых оснований, амфотерных гидроксидов и кислот.
Заключение: Обратите внимание на изменения, происходящие во всех этапах работы.
Ход работы:
Названия действия
|
Наблюдения
|
Уравнения реакций и выводы
|
1.Получение гидроксида кальция
|
Порошок белого цвета растворился в воде и образовался мутный раствор.
|
СаО + Н2О → Са(ОН)2
Кальций и его оксид реагирует с водой, при этом образуется гидроксид.
|
2. Взаимодей-
ствие гидроксида кальция на индикаторы
|
Цвет красного лакмуса изменился на синий, а фенолфта - леин на малиновый.
|
Растворы шелочей изменяют цвет индикаторов.
|
3. Взаймодействие гидроксида кальция с кислотами
|
В пробирке с синним цветом налили раствор соляной кислоты, а во вторую с малиновой окраской налили раствор серной кислоты произошло обесцвечивание.
|
Са(ОН)2 + 2НСl → СаСl2 + Н2О
Са(ОН)2 + H2SO4→ СаSO4+ 2Н2О
Растворы в обоих пробирках стали бесцветными, потому что нейтрализовались, в результате реакции образовалась соль и вода.
Для растворимых основании характерна основные свойства.
|
4. Получение нерастворимого гидроксида меди (II)
|
Образовался осадок голубого цвета.
|
СuСl2 +2NaOH→ Сu(ОН)2↓+2NaСl
Нерастворимые основания получаем при действий щелочей на растворы их солей
|
5.Изучение свойств гидроксида меди (II)
|
В первую часть пробирки налили
раствор соляной кислоты, осадок растворился,
образовался раствор голубого цвета.
Голубой осадок нагревали изменился на черный цвет.
|
Сu(ОН)2↓+ 2НСl→ СuСl2+ Н2О
Гидроксид меди (II) растворяется в кислотах.
Для нерастворимых основании характерна основные свойства.
Сu(ОН)2↓→СuО+ Н2О
При незначительном нагревании гидроксид меди (II) разлагается
|
6. Получение амфотерного гидроксида цинка
|
В раствор хлорида цинка капали щелочь, образовался белый студенистый осадок.
|
ZnСl2 +2NaOH→ Zn (ОН)2↓+2NaСl
Гидроксид цинка получаем при действии щелочей на растворы солей цинка
|
7. Изучение свойств гидроксида цинка
|
В первую часть пробирки налили
раствор соляной кислоты, осадок растворился, а во вторую часть осадка когда налили
раствор гидроксида натрия осадок растворился,
образовался бесцветный раствор.
|
Zn (ОН)2↓+2НСl→ ZnСl2+ 2Н2О
Zn (ОН)2↓+2NaOH→Na2[Zn(ОН)4]
Гидроксид цинка амфотерное соединение легко растворим в избытке щелочи, а также в кислотах.
Амфотерные гидроксиды показывают и основные, и кислотные свойства.
|
|
ІV. Закрепление нового материала
(выполнение заданий, оценка знаний и др.)
|
Выполнение упражнении по учебнику.
|
Решение задач.
|
V. Домашнее задание
|
Учебник Н. Н. Нурахметова «Химия» 10 класс, подготовиться к третьей
|
практческой работе на стр. 138.
|
VI. Подведение итогов урока
(Выставление оценок с комментарием, выяснение положительных и отрицательных моментов урока)
|
1. Выставление оценок с комментарием,
|
2. Выяснение положительные и отрицательные моментов урока
|
Преподаватель_____________ А.С.Ингенбаева
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РЕСПУБЛИКИ КАЗАХСТАН
КОЛЛЕДЖ СЕРВИСА И ТЕХНОЛОГИЙ
ПЛАН ЗАНЯТИЯ №16
Дата
|
Группа
|
|
С11ЭВМ
|
|
С11ПУ
|
|
СПМ
|
|
П11М
|
Предмет: Химия |
|
|
 Скачать 0.83 Mb.
Скачать 0.83 Mb.

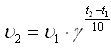 ,
,