|
|
Поурочные. поурочные планы по химии А,С,2017. I. Периодический закон, периодическая система химических элементов в свете теории строения атомов
ПЛАН ЗАНЯТИЯ №7
Дата
|
Группа
|
|
С11ЭВМ
|
|
С11ПУ
|
|
СПМ
|
|
П11М
|
Предмет Химия
Тема занятия IІ. Химическая связь и строение вещества. Виды химических связей. Ковалентная связь, механизм ковалентной связи.
Тип урока Урок новых знаний. Цель занятия |
Учебная: Знать виды химических связей, ковалентную связь,
систематизировать знания учащихся о периодичности; научить школьников пользоваться Периодической таблицей; сформулировать общие закономерности, лежащие в основе таблицы.
| механизм ковалентной связи. | Развивающая: уметь составлять схемы образования молекул | веществ, написать образования связи в электронном виде. |
Воспитательная: воспитывать обучающихся работать
| группой, организованности, уметь пользоваться таблицами. |
ОБЕСПЕЧЕНИЕ ЗАНЯТИЯ
А. Наглядные пособия Слайды «Виды химических связей. Ковалентная связь, механизм ковалентной связи.»
Б. Раздаточные материалы Н. Н. Нурахметов, К.Бекишев, Н.А.Заграничная Химия 10 класс.
Содержание этапов урока (основные и необходимые методические пояснение и рекомендации)
|
I. Организационные вопросы
|
Организовать группу к занятии. Через дежурных проверить посещаемость
|
обучающихся.
|
II. Повторение пройденного материала
(виды контроля знаний)
|
1. Фронтальная беседа с группой по вопросам.
|
- Какие виды химических связей Вы знаете?
|
III. Изложение нового материала (методика)
|
1.Раздать краткий курс лекций по теме.
2. Показать слайды и объяснять тему с словесным и деманстрационным методом.
3. Записать в тетрадях основные понятия.
Периодическое изменение свойств химических элементов и их соединений при увеличении заряда ядра атома объясняется тем, что периодически повторяется строение внешнего электронного слоя в атомах элементов.
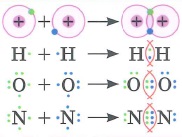
Ковалентная связь в химии: |
Ковалентная связь: это химическая связь, обусловленная созданием общих электронных пар.
|
|
Одинарная (двойная, тройная) ковалентная связь - это ковалентная связь, образованная одной (двумя, тремя соответственно) общими электронными парами.
|
При образовании общих электронных пар происходит перекрывание электронных орбиталей.
|
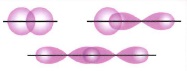
σ - связь образуется при перекрывании электронных орбиталей, идущих по линии, соединяющей центры атомов
|
|
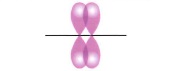
π- связьобразуется при перекрывании электронных орбиталей, вне линии, соединяющей центры атомов
|
|
Периодическое изменение свойств химических элементов и их соединений при увеличении заряда ядра атома объясняется тем, что периодически повторяется строение внешнего электронного слоя в атомах элементов.
| | | Ковалентная неполярная связь: |
Ковалентная неполярная связь- это связь между атомами с одинаковой электроотрицательностью
|
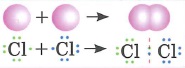
| Ковалентная полярная связь: |
Ковалентная полярная связь- это связь между атомами, электроотрицательность которых отличается незначительно
|
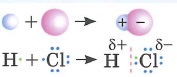
|
Общие электронные пары смещены в сторону атома более электроотрицательного элемента
| Характеристики ковалентной связи: |
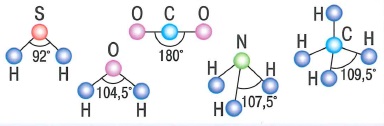
| Механизмы образования ковалентной связи: |
Обменный механизм образования ковалентной связи: это когда при образовании общей электронной пары каждый из атомов предоставляет в совместное пользование по одному электрону
|
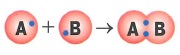
|
Донорно-акцепторный механизм образования ковалентной связи: это когда при образовании общей электронной один из атомов (донор)дает в общее пользование электронную пару, а другой (акцептор) предоставляет свободную орбиталь
|
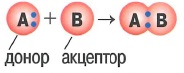
|
|
ІV. Закреплениев нового материала
(выполнение заданий, оценка знаний и др.)
|
V. Домашнее задание
|
Учебник Н. Н. Нурахметова «Химия» 10 класс, стр. 85 - 94 прочитать, упр. 3, 5 на стр.50 выполнить в тетрадях.
|
VI. Подведение итогов урока
(Выставление оценок с комментарием, выяснение положительных и отрицательных моментов урока)
|
1. Выставление оценок с комментарием,
|
2. Выяснение положительные и отрицательные моментов урока
|
Преподаватель_____________ А.С.Ингенбаева
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РЕСПУБЛИКИ КАЗАХСТАН
ТАЛДЫКОРГАНСКИЙ КОЛЛЕДЖ СЕРВИСА И ТЕХНОЛОГИИ
|
|
|
 Скачать 0.83 Mb.
Скачать 0.83 Mb.







