|
|
Поурочные. поурочные планы по химии А,С,2017. I. Периодический закон, периодическая система химических элементов в свете теории строения атомов
ОБЕСПЕЧЕНИЕ ЗАНЯТИЯ
А. Наглядные пособия Слайды «Электроотрицательность, радиоактивность, валентность и степень окисления химических элементов».
Б. Раздаточные материалы Н. Н. Нурахметов Химия 10 класс, Задании по теме «Электроотрицательность, радиоактивность, валентность и степень окисления химических элементов».
Содержание этапов урока (основные и необходимые методические пояснение и рекомендации)
|
I. Организационные вопросы
|
Организовать группу к занятии. Через дежурных проверить посещаемость
|
обучающихся.
|
II. Повторение пройденного материала
(виды контроля знаний)
|
Проверка домашнего задания.
Так как изучение нового материала занимает много времени, то проверку подготовки обучащихся к уроку провожу в форме графического диктанта, используя прием «Лови ошибку»
На основании сходства характерных свойств, элементы можно разделить на металлы и неметаллы. (Да)
Металлы образуют простые вещества, существующие в разных агрегатных состояниях – твердом, жидком и газообразном. (Нет)
Все неметаллы имеют характерный металлический блеск. (Нет)
Амфотерность – это проявление двойственных свойств. (Да)
Элементы, проявляющие двойственные свойства, нельзя отнести ни к типичным металлам, ни к типичным неметаллам. (Да)
Естественные семейства объединяют элементы со сходными физическими и химическими свойствами. (Да)
Щелочные металлы находятся в 1 группе ПСХЭ. (Да)
Валентность щелочных металлов в соединениях равна нулю. (Нет)
Инертные элементы, в переводе с греческого, «рождающие соли». (Нет)
Щелочные металлы хранят под слоем керосина, т.к. они быстро окисляются кислородом воздуха. (Да)
Гелий – это щелочной металл. (Нет)
Галогены легко вступают в реакции с водородом и металлами. (Да)
Инертные элементы находятся в 7 группе ПСХЭ. (Нет)
Иод – это твердое кристаллическое вещество с характерным блеском. (Да)
Щелочные металлы используются в иллюминации, т.к. при пропускании через них электрического тока, они светятся разными цветами. (Нет)
|
1. Фронтальная беседа с группой по вопросам.
|
- Какие качества характерны для химического элемента?
|
- Что такое валентность?
|
- Что такое степень окисления?
|
III. Изложение нового материала (методика)
|
1.Раздать краткий курс лекций по теме.
2. Показать слайды и объяснять тему с словесным и деманстрационным методом.
3. Записать в тетрадях основные понятия.
Электроотрицательность.
Атомы разных элементов имеют различное электронное строение, содержат разное число электронов на внешнем уровне, поэтому обладают различной способностью к притягиванию «чужих» электронов. Атомы одних элементов сильнее притягивают электроны, атомы других- слабее. Эта способность атомов химических элементов притягивать к себе общие электронные пары называется электроотрицательностью. Чем она больше, тем сильнее атом данного элемента оттягивает на себя общие электронные пары. Чем ЭО меньше, тем слабее атом данного элемента притягивает к себе общие электронные пары.
Объясняем ребятам, что поскольку ЭО мера неметалличности элемента, то она изменяется вместе с нею, имеет те же закономерности в изменении свойств в группах и в периодах. В периодах неметалличесие свойства усиливаются, следовательно ЭО тоже возрастает. Сказанное представим в виде схемы:
Ряд электроотрицательности:
Cs – K– Na– Ca –Mg– Al– Si– H– C– P– S– Br– Cl– N– O– F
ЭО возрастает
В периодах ЭО возрастает
В главных ЭО уменьшается
Электроотрицательность- это свойство атома притягивать связующее электронное облако.
Предлагаем определить направление смещения общих электронных пар в соединениях: НCl и НF и сравнить полярность химической связи.
Для формирования представлений о валентности можно предложить школьникам составить схемы строения атома водорода и атома хлора
Н+1 ( общая пара)
Сl +17
Н- Сl
По этому рисунку учащиеся делают вывод о наличии неспаренных электронов у атома водорода и атома хлора. Важно подчеркнуть, что эти неспаренные электроны при сближении атомов образуют общую электронную пару между атомами водорода и хлора.
Затем формулируем определение валентности.
Валентность – это способность атома к образованию химических связей. За единицу валентности принимают химическую связь, образованную за счет одной электронной пары.
По числу черточек в уже знакомых нам формулах нескольких молекул видно, что водород и хлор одновалентны, кислород - двухвалентен, а азот - трехвалентен.
Н2, Сl2, Н2О, NH3, N2
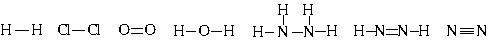
Поскольку в химической связи участвуют только электроны внешних оболочек, такие электроны называют валентными.
Структурные формулы наглядно показывают последовательность связывания атомов в молекуле и валентность элементов.
Степень окисления (с.о.) –это условный, формальный заряд, который приписывают атомам в электронейтральной молекуле или многоатомном ионе.
Степень окисления может быть положительной, отрицательной или равняться нулю, что зависит от природы соответствующих соединений. Положительную или отрицательную степень окисления элемент получает в том случае, если электронные плотности химических связей полностью смещены к атомам элемента с более высоким значением ЭО. Это относится к веществам с ионной связью. Одни элементы имеют постоянные степени окисления, другие- переменные.
Например, к элементам с постоянной положительной с.о. относят щелочные металлы: Li+1 Na+1 K+1 Rb +1 Cs+1 Fr +1,
следующие элементы 2 группы ПСХЭ: Be +2 Mg+2 Ca +2 Ba +2 Zn +2.
А также Al +3 и другие.
Металлы в соединениях всегда имеют положительную с.о.
Из неметаллов постоянную отрицательную с.о. ( -1) имеет F.
В простых веществах, образованных атомами металлов или неметаллов, с.о. элементов равны 0, напримере Na0, Al0, F20, P0, S0, Br2 0, Cl2 0, N20.
Для водорода характерны с.о.: +1(Н2О), -1 (NaН).
Дл кислорода характерны с.о.: -2 (Н2О), -1(Н2О2), 0 (О2, FО Cl), +1 (F2О2),
+2 (О F2).
Следует помнить, что в целом молекула электронейтральна, поэтому в любой молекуле алгебраическая сумма степеней окисления равна 0.
Сумма с.о. атомов многоатомного иона по знаку и величине равна заряду этого иона.
|
ІV. Закреплениев нового материала
(выполнение заданий, оценка знаний и др.)
|
Задание: Найдите с.о. марганца в соединении, формула которого МnO2.
Задание.
Значения высшей и низшей степени окисления серы, соответственно, равны:
+2 и -6
+6 и -2
+6 и -3
+5 и -2
|
V. Домашнее задание
|
Учебник Н. Н. Нурахметова «Химия» 10 класс, стр. 76 - 80 прочитать, упр. 4, 7, 8 на стр. 79 выполнить в тетрадях.
|
VI. Подведение итогов урока
(Выставление оценок с комментарием, выяснение положительных и отрицательных моментов урока)
|
1. Выставление оценок с комментарием,
|
2. Выяснение положительные и отрицательные моментов урока
|
Преподаватель_____________ А.С.Ингенбаева
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РЕСПУБЛИКИ КАЗАХСТАН
ТАЛДЫКОРГАНСКИЙ КОЛЛЕДЖ СЕРВИСА И ТЕХНОЛОГИИ
|
|
|
 Скачать 0.83 Mb.
Скачать 0.83 Mb.