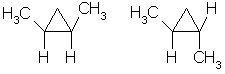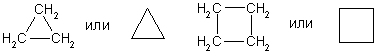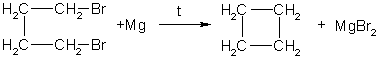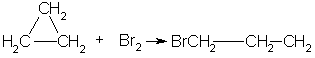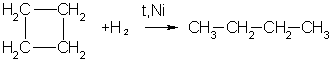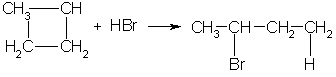|
|
Поурочные. поурочные планы по химии А,С,2017. I. Периодический закон, периодическая система химических элементов в свете теории строения атомов
ПЛАН ЗАНЯТИЯ №42-43-44-45
Дата
|
Группа
|
|
С11ЭВМ
|
|
С11ПУ
|
|
СПМ
|
|
П11М
|
Предмет Химия
Тема занятия «Предельные углеводороды – Алканы, Гомологический ряд, изомеры, химические свойства и получение. Циклоалканы, Гомологический ряд, изомеры, химические свойства и получение. »
Тип урока Урок сообщений новых знаний Цель занятия |
Учебная: Раскрыть физические свойства предельных
научить школьников пользоваться Периодической таблицей; сформулировать общие закономерности, лежащие в основе таблицы.
систематизировать знания учащихся о периодичности; научить школьников пользоваться Периодической таблицей; сформулировать общие закономерности, лежащие в основе таблицы.
| углеводородов. Дать понятие о свойствах алкана. Раскрыть | химические свойства предельных углеводородов. Познакомить | учашихся с гомологическим рядом метана. Научить учащихся | составлять изомеры | Развивающая: развить у обучающихся такие | интеллектуальные умения и навыки, как сравнение, |
сопоставление, обобщение и анализ.
|
Воспитательная: Воспитывать коллективизм, эстетические нормы,
| умение высказывать свои взгляды, суждения, понимание значимости о | обучения, формировать мировоззренческие понятия о познаваемости |
Природы
|
ОБЕСПЕЧЕНИЕ ЗАНЯТИЯ
А. Наглядные пособия Оборудование урока: Презентации-слайды, карточки
Б. Раздаточные материалы Н. Н. Нурахметов, К.Бекишев, Н.А.Заграничная Химия 11 класс.
Содержание этапов урока (основные и необходимые методические пояснение и рекомендации)
|
I. Организационные вопросы
|
Организовать группу к занятии. Через дежурных проверить посещаемость
|
обучающихся.
|
II. Повторение пройденного материала
(Вопрос-ответ)
|
Какое явление называют изомерией?
|
Какие формулы называют структурными?
|
Что такое радикал? Изобразите структурные формулы углеводородных радикалов: -С2Н5, -С3Н7, -С4Н9
|
III. Изложение нового материала (методика)
|
Углеводороды - простейшие органические соединения, состоящие из двух элементов: углерода и водорода. Предельными углеводородами, или алканами (международное название), называются соединения, состав которых выражается общей формулой СnН2n+2, где n - число атомов углерода. В молекулах предельных углеводородов атомы углерода связаны между собой простой (одинарной) связью, а все остальные валентности насыщены атомами водорода. Алканы называют также насыщенными углеводородами или парафинами (Термин «парафины» означает «имеющие малое сродство»). Насыщенными называются СН-ды, в молекулах которых все атомы С-да, максимально до предела насыщенны Н-ом, т.е. неспособны к присоединению других атомов, а связи между ними простые. Названия первых десяти членов ряда предельных углеводородов уже даны. Первым членом гомологического ряда алканов является метан СН4. Окончание -ан является характерным для названий предельных углеводородов. Далее следует этан С2Н6, пропан С3Н8, бутан С4Н10. Начиная с пятого углеводорода, название образуется из греческого числительного, указывающего число углеродных атомов в молекуле, и окончания -ан. Это пентан С5Н12 гексан С6Н14, гептан С7Н16, октан С8Н18, нонан С9Н20, декан С10Н22 и т. д. Алканы, начиная с четвертого члена ряда (бутана), имеют изомеры .Все алканы насыщены водородом до предела (максимально). Их атомы углерода находятся в состоянии sp 3 —гибридизации, а значит, имеют простые (одинарные) связи. При отрыве атома водорода от молекулы алкана образуются одновалетные частицы, называемые углеводородными радикалами (сокращенно обозначаются буквой R). Названия одновалентных радикалов производятся от названий соответствующих углеводородов с заменой окончания –ан на –ил (алкил). Состав которых выражается общей формулой СnН2n+1
Углеводороды
|
Метан
|
CH 4
|
Гексан
|
C 6 H 14
|
Этан
|
C 2 H 6
|
Гептан
|
C 7 H 16
|
Пропан
|
C 3 H 8
|
Октан
|
C 8 H 18
|
Бутан
|
C 4 H 10
|
Нонан
|
C 9 H 20
|
Пентан
|
C 5 H 12
|
Декан
|
C 10 H 22
|
Одновалентные радикалы
|
Метил
|
CH 3 -
|
Гексил
|
C 6 H 13 -
|
Этил
|
C 2 H 5 -
|
Гептил
|
C 7 H 15 -
|
Пропил
|
C 3 H 7 -
|
Октил
|
C 8 H 17 -
|
Бутил
|
C 4 H 9 -
|
Нонил
|
C 9 H 19 -
|
Пентил (амил)
|
C 5 H 11 -
|
Децил
|
C 10 H 21 -
|
Физические свойства. В обычных условиях первые четыре члена гомологического ряда алканов (С1 — С4) — газы. Нормальные алканы от пентана до гептадекана (C5 — C17) — жидкости, начиная с С18 и выше — твердые вещества. Все насыщенные углеводороды не растворяются в воде, они растворяются в органических растворителях. По мере увеличения числа атомов углерода в цепи, т.е. с ростом относительной молекулярной массы, возрастают температуры кипения и плавления алканов. При одинаковом числе атомов углерода в молекуле алканы с разветвленным строением имеют более низкие температуры кипения, чем нормальные алканы. Основные природные источники алканов — нефть и природный газ. Различные фракции нефти содержат алканы от C5H12 до С30Н62. Природный газ состоит из метана (95%) с примесью этана и пропана.
По заместительной номенклатуре основой для названия служит одна углеродная цепь, а все другие фрагменты молекулы рассматриваются как заместители. В этом случае выбирают наиболее длинную цепь углеродных атомов и атомы цепи нумеруют с того конца, к которому ближе стоит углеводородный радикал. Затем называют: 1) номер углеродного атома, с которым связан радикал (начиная с простейшего радикала); 2) углеводород, которому соответствует длинная цепь. Если в формуле содержится несколько одинаковых радикалов, то перед их названием указывают число прописью (ди-, три-, тетра- и т. д.), а номера радикалов разделяют запятыми. Вот как по этой номенклатуре следует назвать изомеры гексана:
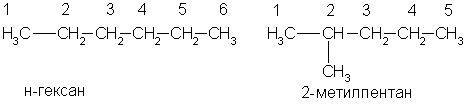
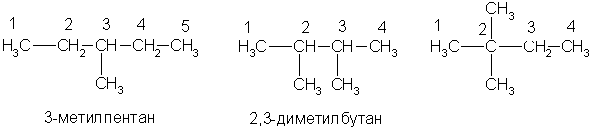
А вот более сложный пример:
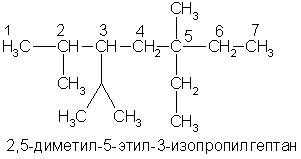 1.Получение из ненасыщенных углеводородов. Взаимодействие алкенов или алкинов с водородом ("гидрирование") происходит в присутствии металлических катализаторов (Ni, Pd) при 1.Получение из ненасыщенных углеводородов. Взаимодействие алкенов или алкинов с водородом ("гидрирование") происходит в присутствии металлических катализаторов (Ni, Pd) при
нагревании:
СН3-СН=СН2 + Н2
|
→
|
СН3-СН2-СН3,
|
СНз -C≡СН + 2Н2 → СН3-СН2-СН3.
2.Получение метана. В электрической дуге, горящей в атмосфере водорода, образуется значительное количество метана:
С + 2Н2 → СН4.
Химические свойства. В обычных условиях алканы химически инертны. Они устойчивы к действию многих реагентов: не взаимодействуют с концентрированными серной и азотной кислотами, с концентрированными и расплавленными щелочами, не окисляются сильными окислителями - перманганатом калия KMnО4 и т.п.
1. Галогенирование. При взаимодействии алканов с галогенами (хлором и бромом) под действием УФ-излучения или высокой температуры образуется смесь продуктов от моно- до поли галогензамещенных алканов. Общая схема этой реакции показана на примере метана:
|
Сl2
|
|
Сl2
|
|
Сl2
|
|
Сl2
|
|
|
|
СН4
|
→
|
СН3Сl
|
→
|
СН2Сl2
|
→
|
СНСl3
|
→
|
ССl4
|
|
(*)
|
<>
|
-HCl
|
|
-HCl
|
|
-НСl <>
|
|
-HCl
|
|
|
|
Реакция образования хлорметана протекает по цепному механизму, который характеризуется следующими стадиями: а) инициирование цепи:
б) Рост цепи. Радикал хлора отнимает у молекулы алкана атом водорода:
Cl+ СН4→НСl + СН3
При этом образуется алкильный радикал, который отнимает атом хлора у молекулы хлора:
СН3 + Сl2→СН3Сl + Сl
Эти реакции повторяются до тех пор, пока не произойдет обрыв цепи по одной из реакций:
Cl + Cl → Сl2, СН3 + СН3 → С2Н6, СН3 + Cl → СН3Сl
Суммарное уравнение реакции:
|
hv
|
|
СН4 + Сl2
|
→
|
СН3Сl + НСl.
|
Образующийся хлорметан может подвергаться дальнейшему хлорированию, давая смесь продуктов CH2Cl2, CHCl3, ССl4 по схеме (*).
Развитие теории цепных свободнорадикальных реакций тесно связано с именем выдающегося русского ученого, лауреата Нобелевской премии Н.И. Семенова (1896-1986).
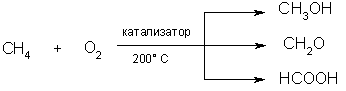
2.Окисление. При мягком окислении метана кислородом воздуха в присутствии различных катализаторов могут быть получены метиловый спирт, формальдегид, муравьиная кислота:
3.Горение. При горении алканов выделяется большое количества тепла и образуется углекислый газ и вода:
С 3Н 8 +5О 2 →3СО 2+4Н 2О+Q
4.При взаимодействии с водой образуется оксид углерода и водород.
СН4 +Н2О –Ni,800-850С СО+3Н2
5. Реакция разложения – Алканы разлагаются при сильном нагревании в отсутствии воздуха:
СН4 1000С→ С+ Н2
6. Дегидрирование ( выделяется водород и образуется Алкены):
СН3 – СН3 →СН2 = СН2 + Н2
«Циклопарафины»
Циклоалканы - это предельные циклические углеводороды. Простейшие представители этого ряда:

циклопропан циклобутан
Общая формула гомологического ряда циклоалканов CnH2n. Точно такой же формулой описывается гомологический ряд алкенов. Из чего следует, что каждому циклоалкану изомерен соответствующий алкен. Это пример так называемой "межклассовой" изомерии . Строение. Каждый атом углерода в циклоалканах находится в состоянии sp3-гибридизации и образует четыре -связи С-С и С-Н. Углы между связями зависят от размера цикла. В простейших циклах С3 и С4 углы между связями С-С сильно отличаются от гетраэдрического угла 109,5°, что создает в молекулах напряжение и обеспечивает их высокую реакционную способность. Свободное вращение вокруг связей С-С, образующих цикл, невозможно.
Изомерия и номенклатура.
1) Для циклоалканов как и для всех классов органических соединений, характерна изомерия углеродного скелета (структурная изомерия). Структурная изомерия для циклоалканов, во-первых, обусловлена размером цикла. Так, существует два циклоалкана формулы С4Н8: циклобутан и метилциклопропан. Во-вторых, такая изомерия обусловливается положением заместителей в цикле (например, 1,1 и 1,2-диметилбутан).
2) Отсутствие свободного вращения вокруг связей С-С в цикле создает предпосылки для существования пространственных изомеров у некоторых замещенных циклоалканов. Например, в молекуле 1,2-диметилциклопропана две группы СН3 могут находиться по одну сторону от плоскости цикла (цис-изомер) или по разные стороны (транс-изомер):
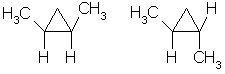
цис-изомер транс-изомер
По размеру цикла циклоалканы делятся на ряд групп, из которых мы рассмотрим малые (С3, С4) и обычные (С5-С7) циклы.
Названия циклоалканов строятся путем добавления приставки цикло- к названию алкана с соответствующим числом атомов углерода. Нумерацию в цикле производят таким образом, чтобы заместители получили наименьшие номера.
Структурные формулы циклоалканов обычно записывают в сокращенном виде, используя геометрическую форму цикла и опуская символы атомов углерода и водорода.
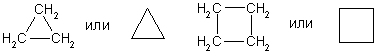
Физические свойства. При обычных условиях первые два члена ряда (С3 - С4) — газы, (С5 - С16) — жидкости, начиная с C17 — твердые вещества. Температуры кипения и плавления циклоалканов выше, чем у соответствующих алканов.
Получение:
1.Основной способ получения циклоалканов - отщепление двух атомов галогена от дигалогеналканов:
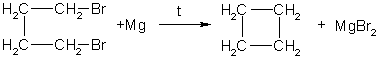
Циклобутан
2. При каталитическом гидрировании ароматических углеводородов образуются циклогексан или его производные:
t°,P,Ni
C6H6 + 3H2 → C6H12.
Химические свойства:
По химическим свойствам малые и обычные циклы существенно различаются между собою. Циклопропан и циклобутан склонны к реакциям присоединения, т.е. сходны в этом отношении с алкенами. Циклопентан и циклогексан по своему химическому поведению близки к алканам, так как вступают в реакции замещения.
1. Так, например, циклопропан и циклобутан способны присоединять бром (хотя реакция и идет труднее, чем с пропеном или бутеном):
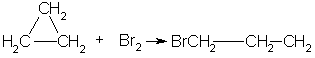
2. Циклопропан, циклобутан и даже циклопентан могут присоединять водород, давая соответствующие нормальные алканы.
Присоединение происходит при нагревании в присутствии никелевого катализатора:
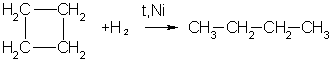
3. В реакцию присоединения с галогеноводородами опять же вступают только малые циклы. Присоединение к гомологам циклопропана происходит по правилу Марковникова:
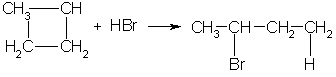
4. Горение:
5. Реакция замещения:
Применение: при сгорании алканов выделяется огромное количество энергии, которая находит широкое применение в быту. Алканы являются не только дешевым и доступным топливом, но и служат основным химическим сырьем в промышленности для получения различных веществ. Циклоалканы используются в органическом синтезе.
|
ІV. Закреплениев нового материала
(выполнение заданий, оценка знаний и др.)
|
V. Домашнее задание
|
Составить 5 формул с изомерами
Пар. №6
|
VI. Подведение итогов урока
(Выставление оценок с комментарием, выяснение положительных и отрицательных моментов урока)
|
1. Выставление оценок с комментарием,
|
2. Выяснение положительные и отрицательные моментов урока
|
Преподаватель_____________ А.С.Ингенбаева
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РЕСПУБЛИКИ КАЗАХСТАН
ТАЛДЫКОРГАНСКИЙ КОЛЛЕДЖ СЕРВИСА И ТЕХНОЛОГИИ
|
|
|
 Скачать 0.83 Mb.
Скачать 0.83 Mb.
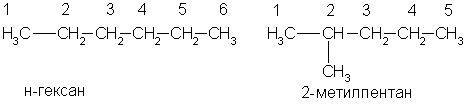
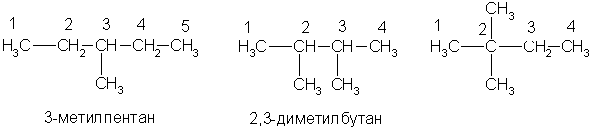
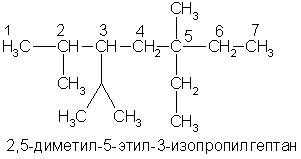 1.Получение из ненасыщенных углеводородов. Взаимодействие алкенов или алкинов с водородом ("гидрирование") происходит в присутствии металлических катализаторов (Ni, Pd) при
1.Получение из ненасыщенных углеводородов. Взаимодействие алкенов или алкинов с водородом ("гидрирование") происходит в присутствии металлических катализаторов (Ni, Pd) при