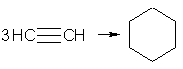|
Поурочные. поурочные планы по химии А,С,2017. I. Периодический закон, периодическая система химических элементов в свете теории строения атомов
Тема занятия «Ацетиленовые углеводороды – Алкины », Гомологический ряд, изомеры, химические свойства и получение.
Тип урока Урок сообщений новых знаний
Цель занятия |
Учебная: Раскрыть физические свойства ацетиленовых
систематизировать знания учащихся о периодичности; научить школьников пользоваться Периодической таблицей; сформулировать общие закономерности, лежащие в основе таблицы.
| углеводородов. Дать понятие о свойствах алкинов. Раскрыть | химические свойства ацетиленовых углеводородов. | Познакомить учашихся с гомологическим рядом ацетилена | Научить учащихся состовлять изомеры. |
Развивающая: Развивать логическое мышления, умение
|
пользоваться приемами сравнения и обобщения, выделять
|
существенное, делать выводы. Продолжить формирование
|
знаний химического языка и умение его применять при
|
характеристики химической реакций .
|
Воспитательная: Воспитывать коллективизм, эстетические
| нормы, умение высказывать свои взгляды, суждения, | понимание значимости обучения, формировать |
мировоззренческие понятия о познаваемости природы
|
ОБЕСПЕЧЕНИЕ ЗАНЯТИЯ
А. Наглядные пособия Оборудование урока: интерактивная доска, презетаций-слайды, видео-лаб.работы
Б. Раздаточные материалы Н. Н. Нурахметов, К.Бекишев, Н.А.Заграничная Химия 11 класс.
Содержание этапов урока (основные и необходимые методические пояснение и рекомендации)
|
I. Организационные вопросы
|
Организовать группу к занятии. Через дежурных проверить посещаемость
|
обучающихся.
|
II. Повторение пройденного материала
(Вопрос-ответ)
|
Читают доклад на тему «Происхождение каучука
| | |
III. Изложение нового материала
|
Алкинами называются непредельные углеводороды, молекулы которых содержат одну тройную связь. Первый представитель этого класса — ацетилен НС ≡ СН, в связи с чем алкины также называют ацетиленовыми углеводородами. Ближайшие гомологи ацетилена:
СН3-С ≡ СН
|
СН3-СН2-C ≡ СН
|
СН3-С ≡ С-СН3
|
пропин
|
бутин-1
|
бутин-2
|
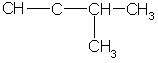
Простейший алкин с разветвленным углеродным скелетом:
З-метилбутин-1
 Общая формула гомологического ряда алкинов СnН2n-2. Она совпадает с общей формулой алкадиенов, поэтому алкины и алкадиены являются межклассовыми изомерами. Общая формула гомологического ряда алкинов СnН2n-2. Она совпадает с общей формулой алкадиенов, поэтому алкины и алкадиены являются межклассовыми изомерами.
Строение. Атомы углерода при тройной связи находятся в состоянии sp-гибридизации. Две -связи, образованные гибридными орбиталями, располагаются по одной линии под углом 180° друг к другу; две -связи образованы при перекрывании двух пар негибридных 2p-орбиталей соседних атомов углерода. Дополнительное связывание двух атомов углерода приводит к тому, что расстояние между ядрами уменьшается, поскольку тройная связь является сочетанием одной - и двух -связей. Длина тройной связи С ≡ С составляет 0,120 нм, что меньше длины как одинарной, так и двойной связи. Энергия тройной связи составляет 828 кДж/моль. Структурная изомерия алкинов обусловлена изомерией углеродного скелета (например, 3-метилбутин-1 и пентин-1) и изомерией положения тройной связи (бутин-1 и бутин-2). Пространственная изомерия для алкинов не характерна.
Номенклатура. В алкинах с неразветвленной углеродной цепью нумерацию начинают с того конца, ближе к которому находится тройная связь. В названии соответствующего алкана окончание -ан заменяется на -ин. В разветвленных алкинах выбирают главную цепь так, чтобы она содержала тройную связь, даже если она при этом и не будет самой длинной. Перед названием главной цепи указывают номер атома углерода, при котором находится заместитель, и название этого заместителя. Номер после названия главной цепи указывает положение тройной связи, например:
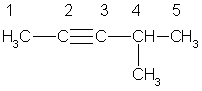
4-метилпентин-2
Физические свойства алкинов похожи на свойства алканов и алкенов. При обычных условиях (С2 – С4) — газы, (C5 – C16) — жидкости, начиная с C17 — твердые вещества. Температуры кипения алкинов выше, чем у соответствующих алкенов. Так, этилен имеет tкип = -103 °С, ацетилен кипит при -83,6 °С; пропен и пропин соответственно при -47 °С и -23 °С. Растворимость низших алкинов в воде несколько выше, чем алкенов и алканов, однако она все же очень мала. Алкины хорошо растворимы в неполярных органических растворителях.
Получение: 1.Ацетилен получают в промышленности путем высокотемпературного крекинга метана:
|
1500°С
|
Ацителен
|
2СН4
|
→
|
CH ≡ CH + ЗН2
|
2.В лабораторных условиях ацетилен получают гидролизом карбида кальция:
СаС2 + 2Н2О = Са(ОН)2 + С2Н2 ↑
Химические свойства алкинов обусловлены наличием в их молекулах тройной связи. Типичными реакциями для ацетилена и его гомологов являются реакции электрофильного присоединения АE. Отличие алкинов от алкенов заключается в том, что реакции присоединения могут протекать в две стадии. На первой стадии идет присоединение к тройной связи с образованием двойной связи, а на второй стадии — присоединение к двойной связи. Реакции присоединения для алкинов протекают медленнее, чем для алкенов. Это объясняется тем, что -электронная плотность тройной связи расположена более компактно, чем в алкенах, и поэтому менее доступна для взаимодействия с различными реагентами.
1. Галогенирование. Галогены присоединяются к алкинам в две стадии. Например, присоединение брома к ацетилену приводит к образованию дибромэтена, который, в свою очередь, реагирует с избытком брома с образованием тетрабромэтана:
|
Вr2
|
1,2-дибромэтен
|
Вr2
|
1,1,2,2-тетрабромэтан
|
СН ≡ СН
|
→
|
СНВr = СНВr
|
→
|
СНВr 2- СНВr2
|
Алкины, так же, как и алкены, обесцвечивают бромную виду.
2. Гидрогалогенирование. Галогеноводороды присоединяются к тройной связи труднее, чем к двойной. Для активации галогеноводорода используют АlСl3 — сильную кислоту Льюиса. Из ацетилена при этом можно получить винилхлорид (хлорэтен), который используется для получения важного полимера поливинилхлорида.
|
АlСl3
|
|
СН ≡ СН + HCI
|
→
|
СН2 = СНСl
|
В случае избытка галогеноводорода происходит полное гидрогалогенирование, причем для несимметричных алкинов на каждой стадии присоединение идет по правилу Марковникова, например:
<>
|
Аl Вr3
|
|
СН3 - С ≡ СН + 2НВr
|
→
|
СН3 - СВr2 - СН3 .
|
3. Гидратация. Присоединение воды к алкинам катализируется солями ртути (II)'
|
|
|
Hg2+. H+
|
|
|
|
CH
|
≡
|
СН + Н2О
|
→
|
[СН2 = СН - ОН]
|
≡
|
СН3 – СН = О
|
На первой стадии реакции образуется непредельный спирт, в котором гидроксильная группа находится непосредственно у атома углерода при двойной связи. Такие спирты принято называть виниловыми или енолами. Отличительной чертой енолов является их неустойчивость. В момент образования они изомеризуются в более стабильные карбонильные соединения (альдегиды или кетоны) за счет переноса протона от гидроксильной группы к соседнему атому углерода при двойной связи. При этом -связь между атомами углерода разрывается, и образуется -связь между атомом углерода и атомом кислорода. Причиной изомеризации является большая прочность двойной связи С = О по сравнению с двойной связью С = С.В результате реакции гидратации только ацетилен превращается в альдегид; гидратация гомологов ацетилена протекает по правилу Марковникова;, и образующиеся енолы изомеризуются в кетоны. Так, например, пропин превращается в ацетон:
|
Hg2+
|
|
СН3 – СН ≡ СН + Н2О
|
→
|
[СН3 - С(ОН) = СН2] → СН3 – СО - СН3.
|
Реакция гидратации алкинов была открыта М.Г. Кучеровым (1881 г.) и носит название реакции Кучерова.
4. В обычных условиях Ац.СН-ды только димеризуются и тримеризуются. Винилацетилен обладает большой реакционной способностью; присоединяя хлороводород, он образует хлоропрен, используемый для получения искусственного каучука:
2СН –СН → СН2 = СН-С = СН винилацетилен
При пропускании ацетилена над активированным углем при 600 °С происходит тримеризация ацетилена с образованием бензола:
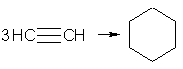
5.Горение (выделяется большое количества тепла):
С2Н2+5О2 → 4СО2 +2Н2О+2600кДж
Применение. На основе ацетилена развились многие отрасли промышленности органического синтеза. Выше уже отмечена возможность получения уксусного альдегида из ацетилена и различных кетонов из гомологов ацетилена по реакции Кучерова. в свою очередь, большой интерес представляют реакции алкинов с кетонами. Например, реакцией ацетилена с ацетоном можно получить изопрен — исходный продукт для получения синтетического каучука. Хлоропрен также получают из винилаиетилена. Ацетилен используется для сварки (кислородноацетиленовая сварка) металлов, поскольку при его горении развивается высокая температура.Его часто иср. Для сварки и резки металлов.
|
ІV. Закреплениев нового материала
(выполнение заданий, оценка знаний и др.)
|
В молекулах ацетиленовых углеводородов имеется тройная связь. Для них характерна реакция присоединения, эта реакция протекает ступенчато. В отличие от других СН-ов атом водорода в ацетилене проявляет кислотные свойства. Ацетилен взаимодействует с измельченными металлами и солями тяжелых металлов и образует ацетилениды. В обычных условиях в реакции полимеризации не вступает, а только димеризуется и тримеризуется
|
V. Домашнее задание
|
|
Составить 5 формул с изомерами (диеновых СН-ов)
Пар. №9
|
VI. Подведение итогов урока
(Выставление оценок с комментарием, выяснение положительных и отрицательных моментов урока)
|
Преподаватель_____________ А.С.Ингенбаева
Задача 1. Напишите структурные формулы изомерных ацетиленовых углеводородов состава С7Н12, главная цепь которых состоит из пяти углеродных атомов, и назовите их.
Решение. Тройная связь в главной цепи может находиться в положениях 1 и 2:
С – С – С – С ≡ С С – С – О ≡ С - С
В первом случае возможны четыре структурных изомера (две группы -СН3 в положениях 3,3; 3,4; 4,4 или одна группа -С2Н5 в положении 3):
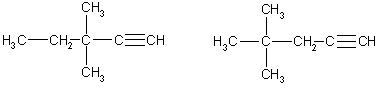
3,3-диметилпентин-1 4,4-диметилпентин-1
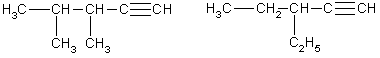
3.4-диметилпентин-1 3-этилпентин-1
Во втором случае возможен единственный изомер, когда две метильные группы находятся в положении 4:
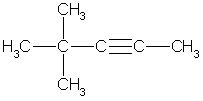
4,4-диметилпентин-2
Ответ. 5 изомеров.
Задача 2. При пропускании смеси пропана и ацетилена через склянку с бромной водой масса склянки увеличилась на 1,3 г. При полном сгорании такого же количества исходной смеси углеводородов выделилось 14 л (н.у.) оксида углерода (IV). Определите массовую долю пропана в исходной смеси.
Решение. Ацетилен поглощается бромной водой:
НC ≡ СH + 2Вr2 → НСВr2 -СНВr2 .
1,3 г - это масса ацетилена. v(C2H2) = 1,3/26 = 0,05 моль. При сгорании этого количества ацетилена по уравнению
2С2Н2 + 5О2 = 4СО2 + 2Н2О
выделилось 2-0,05 = 0,1 моль СО2. Общее количество СО2 равно 14/22,4 = 0,625 моль. При сгорании пропана по уравнению
С3Н8 + 5О2 = ЗСO2 + 4Н2О
выделилось 0,625 - 0,1 = 0,525 моль СО2, при этом в реакцию вступило 0,525/3 = 0,175 моль С3Н8 массой 0,175 - 44 = 7,7 г.
Общая масса смеси углеводородов равна 1,3+7,7 = 9,0 г, а массовая доля пропана составляет: (С3Н8) = 7,7/9,0 = 0,856, или 85,6%.
Ответ. 85,6% пропана.
Задача 3. Как химическим путем выделить бутин-2 из его смеси с бутином-1?
Решение. Смесь следует пропустить через аммиачный раствор оксида серебра. При этом бутин-1 поглотится за счет реакции
СН3 - СН2 - С ≡СН + [Ag(NH3)2]OH → CH3 - CH2 - C ≡CAg↓ + 2NH3 + Н2О.
Бутин-2 не реагирует с [Ag(NH3)2]OH и улетучится в чистом виде.
Задача 4. Эквимолярная смесь ацетилена и формальдегида полностью прореагировала с 69,6 г оксида серебра (аммиачный раствор). Определите состав смеси (в % по массе).
Решение. Оксид серебра реагирует с обоими веществами в смеси:
НС ≡ СН + Аg2О → AgC ≡ CAg↓ + Н2О,
СН2О + 2Аg2О → 4Аg↓ + СО2 + Н2О.
(Уравнения реакции записаны в упрощенном виде).
Пусть в смеси содержалось по х моль С2Н2 и СН2О. Эта смесь прореагировала с 69,6 г оксида серебра, что составляет 69,6/232 = 0,3 моль. В первую реакцию вступило х моль Аg2О, во вторую — 2х моль Аg2О, всего — 0,3 моль, откуда следует, что х = 0,1.
m(C2H2) = 0,1 - 26 = 2,6 г; m(CH2O) = 0,1-30 = 3,0 г; общая масса смеси равна 2,6+3,0 = 5,6 г. Массовые доли компонентов в смеси равны: (С2Н2) = 2,6/5,6 = 0,464, или 46,4%; (СН2О) = 3,0/5,6 = 0,536, или 53,6%.
Ответ. 46,4% ацетилена, 53,4% формальдегида.
Задача 5. Дихлоралкан, в котором атомы хлора находятся у соседних атомов углерода, обработали избытком спиртового раствора щелочи. Масса выделившегося газа оказалась в 2,825 раза меньше массы исходного дихлоралкана. Установите строение исходного соединения и продукта реакции.
Решение. При обработке дихлоралкана избытком спиртового раствора щелочи отщепляются две молекулы хлороводорода и образуется алкин:
С2Н5ОН
CnH2nCl2 + 2KOH → CnH2n-2↑ + 2KCl + 2Н2О.
Согласно уравнению реакции, из 1 моль СnН2nСl2 массой (14n + 71) г выделяется 1 моль СnН2n-2 массой (14n-2) г. По условию,
(14n - 2) • 2,825 = 14n + 71,
откуда n = 3. Искомый алкин — пропин, СН3 – С ≡ СН, он образуется из 1,2-дихлорпропана:
|
С2Н5ОН
|
|
СН3СНСl - СН2Сl + 2КОН
|
→
|
CH3C ≡ CH ↑ + 2KCl + 2Н2О
|
Ответ. 1,2-дихлорпропан; пропин.
Карточка №1
1. Дайте определения ацетиленовым углеводородам и назовите их общую формулу
2. Составьте уравнения реакций, при помощи которых можно осуществить следующие превращения: (назовите вещество А)
СаС2→С2Н2→А→С2Н5CL
3. Область применение ацетиленовых углеводородов и их гомологов
Карточка №2
1. Составьте структурные формулы трех алкинов, которые изомерны 2-метилбутадиену1,3. Дайте им названия.
2. Напишите уравнения реакций: а) горения ацетилена в кислороде, б) гидратации ацетилена прсутствии катализатора; в) гидрирования пропина. Назовите продукты реакций .
Карточка №3
1.Напишите структурные формулы соединений по их названиям: а) 4-метилпентин-2; б) бутин-2; в) 3,3-диметилбутин-1; г) 2,5-диметилгексин-3.
2.Составьте уравнения реакций, при помощи которых можно осуществить следующие превращения: СН4→С2Н2→х→С2Н4Br2 (Назовите вещество х).
3.Напишите структурные формулы первых пяти веществ, составляющих гомологический ряд ацетиленовых углеводородов. Назовите их.
Карточка №4
1. С какими из нижеперечисленнных веществ реагировать ацетилен: бром, метан, водород, хлороводород. Напишите уравнения возможных реакций, укажите условия их протеания и назовите образующиеся вещества.
2. Напишите реакцию гидратация или же реакция Кучерова.
3.Напишите формулы следующих соединений: 2-метил,4-бутилпентин-3; 2,3-триоктил, 4,5-дипентил, нонин-6.
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РЕСПУБЛИКИ КАЗАХСТАН
ТАЛДЫКОРГАНСКИЙ КОЛЛЕДЖ СЕРВИСА И ТЕХНОЛОГИИ
ПЛАН ЗАНЯТИЯ №52-53
Дата
|
Группа
|
|
С11ЭВМ
|
|
С11ПУ
|
|
СПМ
|
|
П11М
|
Предмет Химия |
|
|
 Скачать 0.83 Mb.
Скачать 0.83 Mb.
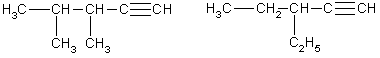


 Общая формула гомологического ряда алкинов СnН2n-2. Она совпадает с общей формулой алкадиенов, поэтому алкины и алкадиены являются межклассовыми изомерами.
Общая формула гомологического ряда алкинов СnН2n-2. Она совпадает с общей формулой алкадиенов, поэтому алкины и алкадиены являются межклассовыми изомерами.