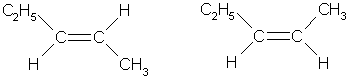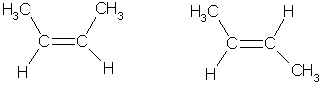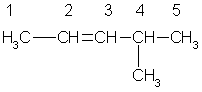|
Поурочные. поурочные планы по химии А,С,2017. I. Периодический закон, периодическая система химических элементов в свете теории строения атомов
ПЛАН ЗАНЯТИЯ №47-48
Дата
|
Группа
|
|
С11ЭВМ
|
|
С11ПУ
|
|
СПМ
|
|
П11М
|
Предмет Химия
Тема занятия «Непредельные углеводороды – Алкены », Гомологический ряд, изомеры, химические свойства и получение.
Тип урока Урок сообщений новых знаний
Цель занятия |
Учебная: Раскрыть физические свойства непредельных учашихся
систематизировать знания учащихся о периодичности; научить школьников пользоваться Периодической таблицей; сформулировать общие закономерности, лежащие в основе таблицы.
| углеводородов. Дать понятие о свойствах алкена. Раскрыть | химические свойства непредельных углеводородов. Познакомить | с гомологическим рядом этилена . Научить учащихся составлять | изомеры. |
Развивающая: Развивать логическое мышления, умение
| пользоваться приемами сравнения и обобщения, выделять |
существенное, делать выводы. Продолжить формирование знаний
|
химического языка и умение его применять при характеристике
|
химических реакций .
|
Воспитательная: Воспитывать коллективизм, эстетические
| нормы, умение высказывать свои взгляды, суждения, | понимание значимости обучения, формировать |
мировоззренческие понятия о познаваемости природы
|
ОБЕСПЕЧЕНИЕ ЗАНЯТИЯ
А. Наглядные пособия Оборудование урока: Презентации-слайды, карточки
Б. Раздаточные материалы Н. Н. Нурахметов, К.Бекишев, Н.А.Заграничная Химия 11 класс.
Содержание этапов урока (основные и необходимые методические пояснение и рекомендации)
|
I. Организационные вопросы
|
Организовать группу к занятии. Через дежурных проверить посещаемость
|
обучающихся.
|
II. Повторение пройденного материала
(Вопрос-ответ)
|
Что такое предельные углеводороды?
| | | | |
К каким химичеким реакциям они подвергаются, приведите пример?
|
Общая формула циклопарафинов и разница между алканами?
| | |
III. Изложение нового материала
|
Простейшими непредельными (ненасыщенными) соединениями являются углеводороды, содержащие одну или несколько двойных связей. Алкены, содержащие две двойные связи, называются диенами, содержащие три двойные связи — триенами и т.д. Соединения с несколькими двойными связями имеют общее название полиены.
Алкенами называются непредельные углеводороды, молекулы которых содержат одну двойную связь. Первый представитель этого класса — этилен СН2 = СН2, в связи с чем алкены также называют этиленовыми углеводородами. Ближайшие гомологи этилена:
СН3-СН=СН2
|
СН3-СН2-СН=СН2
|
СН3-СН=СН-СН3
|
пропилен
|
бутен-1
|
бутен-2
|
Простейший алкен с разветвленным углеродным скелетом:
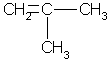
2-метил пропен. Общая формула гомологического ряда алкенов СnН2n. Она совпадает с общей формулой циклоалкана, поэтому алкены и циклоалканы являются межклассовыми изомерами. При отщеплении атома водорода от молекул алкенов образуются непредельные радикалы обшей формулы CnH2n-1, простейшие из которых — винил (этенил) и аллил (пропенил):
СН2=СН-
|
СН2=СН-СН2-
|
винил
|
аллил
|
Атомы углерода при двойной связи находятся в состоянии sp2-гибридизации. Три -связи, образованные гибридными орбиталями, располагаются в одной плоскости под углом 120° друг к другу; -связь образована при перекрывании негибридных 2р-орбиталей соседних атомов углерода. При этом атомные р-орбитали перекрываются не в межъядерном пространстве, а вне его. Поэтому такое "боковое" перекрывание менее эффективно, чем осевое, и, следовательно, -связь является менее прочной, чем -связь. Дополнительное -связывание двух атомов углерода приводит к тому, что уменьшается расстояние между ядрами, поскольку двойная связь является сочетанием - и -связей. Длина двойной связи С=С составляет 0.133 нм, что существенно меньше длины одинарной связи (0,154 нм). Энергия двойной связи (606 кДж/моль) меньше удвоенного значения энергии одинарной связи (347-2 = 694 кДж/моль); это обусловлено меньшей энергией -связи.Структурная изомерия алкенов обусловлена изомерией углеродного скелета (например, бутен-1 и 2-метилпропен) и изомерией положения двойной связи. Пространственная, или цис-транс-изомерия обусловлена различным положением заместителей относительно плоскости двойной связи. Если каждый из атомов углерода при связи С=С связан с двумя разными заместителями, то эти заместители могут располагаться по одну сторону от плоскости двойной связи (цис-изомер) или по разные стороны (транс-изомер), например: цис-бутен-2 транс-бутен-2
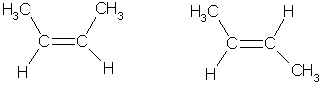
Эти два изомера нельзя перевести друг в друга без вращения вокруг двойной связи С=С, а это вращение требует разрыва -связи и затраты большого количества энергии. Поэтому цис- и транс-изомеры представляют собой разные индивидуальные вещества, которые отличаются друг от друга физическими и химическими свойствами. Алкены, у которых хотя бы один из атомов углерода при связи С=С имеет два одинаковых заместителя, не имеют цис-транс-изомеров. В алкенах с неразветвленной углеродной цепью нумерацию начинают с того конца, ближе к которому находится двойная связь. В названии соответствующего алкана окончание -ан заменяется на -ен. В разветвленных алкенах выбирают главную цепь так, чтобы она содержала двойную связь, даже если она при этом и не будет самой длинной. Перед названием главной цепи указывают номер атома углерода, при котором находится заместитель, и название этого заместителя. Номер после названия главной цепи указывает положение двойной связи, например:
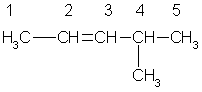
4метилпентен -2
Физические свойства алкенов похожи на свойства алканов, хотя все они имеют несколько более низкие температуры плавления и кипения, чем соответствующие алканы. Например, пентан имеет температуру кипения 36 °С, а пентен-1 — 30 °С. При обычных условиях алкены С2 - С4 — газы. С5 – С15 — жидкости, начиная с C16 — твердые вещества. Алкены не растворимы в воде, хорошо растворимы в органических растворителях. В природе алкены встречаются редко. Поскольку алкены являются ценным сырьем для промышленного органического синтеза, разработаны многие способы их получения.
1. Основным промышленным источником алкенов служит крекинг алканов, входящих в состав нефти:
Крекинг протекает по свободнорадикальному механизму при высоких температурах (400-700 °С).
2. Другой промышленный способ получения алкенов - дегидрирование алканов:
|
t, Cr2O3
|
Пропен-1
|
СН3-СН2-СН3
|
→
|
СН3-СН=СН2 + Н2
|
3. В лаборатории. Дегидратация спиртов происходит при их нагревании с водоотнимающими средствами, например с серной кислотой при температуре выше 170-180 °С:
|
H2SO4
|
Этен
|
СН3-СН2-ОН
|
→
|
СН2=СН2 + Н2О
|
Химические свойства алкенов определяются наличием в их молекулах двойной связи.
1.Горение.(полное окисление). Этиленовые углеводороды горят в кислороде с образованием СО2 и Н2О:
СН2=СН2 + О2 → 2СО2 + 2Н2О
2. Гидратация. При взаимодействии алкенов с водой в присутствии минеральных кислот (серной, фосфорной) образуются спирты. Минеральные кислоты выполняют роль катализаторов и являются источниками протонов. Присоединение воды также идет по правилу Марковникова:
СН3-СН=СН2 + НОН → СН3-СН(ОН)-СН3.
3. Галогенирование. Алкены обесцвечивают бромную воду:
СН2=СН2 + Вr2 → ВrСН2-СН2Вr. (дибромэтан)
Эта реакция является качественной на двойную связь.
4.Гидрирование. Присоединение водорода происходит под действием металлических катализаторов:
СН3-СН=СН2 + Н2 t, Ni → СН3-СН2-СН3
Пропен-1 пропан
5.Полимеризация алкенов и их производных в присутствии кислот протекает по свободнорадикальному механизму АE:
nCH2=CH2 УФ-лучи→(-CH2-CH2-) n
Применение: Полимеризация различных производных алкенов дает ценные промышленные продукты: полиэтилен, полипропилен, поливинилхлорид и другие. Низшие алкены — важные исходные вещества для промышленного органического синтеза. Из этилена получают этиловый спирт, полиэтилен, полистирол. Пропен используют для синтеза полипропилена, фенола, ацетона, глицерина. Из них получают различные растворители, лекарственные препараты, спирт, полимеры и др. С целью ускорения созревания овощей и фруктов этилен вводят в воздух закрытых овощехранилищ.
|
ІV. Закреплениев нового материала
(выполнение заданий, оценка знаний и др.)
|
В молекулах ненасыщенных углеводородов имеется одна двойная связь. Для них характерна реакция присоединения. Реакция присоединения протекает через образование. Присоединение галогенводородов происходит по правилу Марковникова. (Выполните задания)
|
V. Домашнее задание
|
Составить 5 формул с изомерами
Пар. №7
|
VI. Подведение итогов урока
(Выставление оценок с комментарием, выяснение положительных и отрицательных моментов урока)
|
Преподаватель_____________ А.С.Ингенбаева
Задача 1. С помощью каких химических реакций можно очистить пропан от примеси пропена?
Решение. Пропен можно поглотить бромной водой:
СН3-СН=СН2 + Вr2 → СН3-СНВr-СН2Вr
или водным раствором перманганата калия:
СН3-СН=СН2 + [О] + Н2О → СН3-СН(ОН)-СН2ОН.
Пропан с этими веществами не реагирует и улетучивается.
Задача 2. Этиленовый углеводород массой 7,0 г присоединяет 2,24 л (н.у.) бромоводорода. Определите молярную массу и строение этого углеводорода, если известно, что он является цис-изомером.
Решение. Этиленовые углеводороды присоединяют бромоводород по уравнению:
CnH2n + HBr → CnH2n+1Br.
v(HBr) = 2,24/22,4 = 0,1 моль. v(CnH2n) = v(HBr) = 0,1 моль. M(CnH2n) = 7,0/0,1 = 70 г/моль, следовательно, n = 5. Существует 5 структурных изомеров этиленовых углеводородов состава С5Н10:
СН3-СН2-СН2-СН=СН2 СН3-СН2-СН=СН-СН3
пентен-1 пентен-2
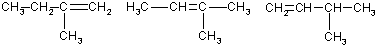
2-метилбутен-1 2-метнлбутен-2 З-метилбутен-1
Из этих веществ только пентен-2 имеет цис-транс-нзомеры:
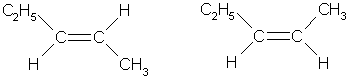
транс-пентен-2 цис-пентен-2
Ответ. Цис-пентен-2.
Задача 3. Сколько существует индивидуальных веществ состава С3Н5Сl. обесцвечивающих бромную воду? Приведите структурные формулы молекул этих веществ.
Решение. С3Н5Сl - это монохлорпроизводное от углеводорода С3Н6. Это вещество обесцвечивает бромную воду, следовательно, имеет в своем составе двойную связь. Три атома углерода могут образовать только неразветвленный углеродный скелет с концевой двойной связью:
С-С = С.
Структурная изомерия возможна только за счет положения атома хлора относительно двойной связи:
СН3-СН = СНСl СН3-ССl = СН2 Сl-СН2-СН = СН2
1-хлорпропен 2-хлорпропен 3-хлорпропен
1-хлорпропен может существовать в виде цис-транс-изомеров:

транс-1 –хлорпропен цис -1-хлорпропен
Ответ. 4 изомера.
Задача 4. При взаимодействии 11,2 л (н.у.) смеси изомерных углеводородов, представляющих собой газы с плотностью по водороду 21, с бромной водой получено 40,4 г соответствующего дибромпроизводного. Определите строение этих углеводородов и содержание каждого из них в смеси (в % по объему).
Решение. Молярная масса изомерных углеводородов равна: M(СхНу) = 21*2 = 42 г/моль, следовательно, углеводороды имеют формулу С3Н6. Такую молекулярную формулу имеют два вещества - пропен и циклопропан. Пропен реагирует с бромной водой:
СН3 - СН = СН2 + Вr2 → СН3 – СНВr - СН2Вr.
Молярная масса дибром производного равна: М(С3Н6Вr2) = 202 г/моль, а его количество: v(C3H6Br2) = 40,4/202 = 0,2 моль. Следовательно, в исходной смеси было 0,2 моль пропена. Общее количество углеводородов в смеси было равно 11,2/22,4 = 0,5 моль; оставшиеся 0,3 моль приходятся на долю циклопропана, который не взаимодействует с бромной водой.
Объемные доли газов в смеси равны их мольным долям: ( пропена) = 0,2/0,5 = 0,4, или 40%, (циклопропана) = 0,6, или 60%,
Ответ. 40% пропена, 60% циклопропана.
Задача 5. При пропускании алкена через избыток раствора перманганата калия масса выпавшего осадка оказалась в 2,07 раза больше массы алкена. Установите формулу алкена.
Решение. Алкены окисляются водным раствором перманганата калия по общему уравнению:
ЗСnН2n + 2KМnO4 + 4Н2O = 3CnH2n(OH)2 + 2MnO2↓ + 2KOH.
Из 3 моль алкена (массой 3-(12n+2n) = 42n) образуется 2 моль МnО2 (массой 2*87 = 174 г). По условию задачи
42n –2,07= 174,откуда n = 2. Искомый алкен — этилен. С2Н4. Ответ. С2Н4
Карточка №1
1. Название алкенов по систематической номенклатуре и их общая формула (непредельные углеводороды).
2. Дайте определение непредельным углеводородам и назовите первый представитель их гомологического ряда.
3. Физические свойства и применение непредельных углеводородов и их производных.
Карточка №2
1. Напишите структурные формулы двух гомологов бутена-1и назовите их
2. Дайте названия следующим углеводородам по систематической номенклатуре:

Карточка №3
1. Напишите общую формулу углеводородов гомологического ряда этилена и формулы первых пяти гомолгов. Укажите их названия .
2. Напишите струтурные формулы соединений: 2-метилбутен-1; 3-метилпентен-1; 2-метилгексен-2.
3.Напишите уравнения реакций взаимодействия бутена-1 с водородом, бромом, бромводородом. Какие вещества образовались?
Карточка №4
1. Как получают этилен? Напишите два уравнения соответствующих реакций и укажите условия их протекания.
2. Напишите уравнения реакций: а) пропена-1 с хлороводородом; б) бутена-2 с водородом; в) горения этилена в кислороде; пентана-1 с бромом. Какие вещества образовались?
3. Напишите уравнения реакций при помощи которыхможно осуществиь следующие ревращения: С2Н4 →С2Н6 →С2Н5CL→ С2Н4 →СО2
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РЕСПУБЛИКИ КАЗАХСТАН
ТАЛДЫКОРГАНСКИЙ КОЛЛЕДЖ СЕРВИСА И ТЕХНОЛОГИИ
ПЛАН ЗАНЯТИЯ №50-51
Дата
|
Группа
|
|
С11ЭВМ
|
|
С11ПУ
|
|
СПМ
|
|
П11М
|
Предмет Химия
Тема занятия «Диеновые углеводороды – Алкадиены», Гомологический ряд, изомеры, химические свойства и получение.
Тип урока Урок сообщений новых знаний
Цель занятия |
Учебная: Раскрыть физические свойства диеновых
систематизировать знания учащихся о периодичности; научить школьников пользоваться Периодической таблицей; сформулировать общие закономерности, лежащие в основе таблицы.
| углеводородов. Дать понятие о свойствах алкадиена. Раскрыть | химические свойства диеновых углеводородов. Познакомить | учашихся с гомологическим рядом метана. Научить учащихся |
состовлять изомеры.
|
Развивающая: Развивать логическое мышления, умение
|
пользоваться приемами сравнения и обобщения, выделять
|
существенное, делать выводы. Продолжить формирование
|
знаний химического языка и умение его применять при
|
характеристики химической реакций .
|
Воспитательная: Воспитывать коллективизм, эстетические
| нормы, умение высказывать свои взгляды, суждения, | понимание значимости обучения, формировать |
мировоззренческие понятия о познаваемости природы
|
ОБЕСПЕЧЕНИЕ ЗАНЯТИЯ
А. Наглядные пособия Оборудование урока: Презентации-слайды, интерактивная доска.
Б. Раздаточные материалы Н. Н. Нурахметов, К.Бекишев, Н.А.Заграничная Химия 11 класс.
Содержание этапов урока (основные и необходимые методические пояснение и рекомендации)
|
I. Организационные вопросы
|
Организовать группу к занятии. Через дежурных проверить посещаемость
|
обучающихся.
|
II. Повторение пройденного материала
(Вопрос-ответ)
|
Что такое непредельные углеводороды?
| | |
На общую формулу какого ряда углеводородов похожа общая формула алкенов?
|
Расскажите о химических свойствах алкенов?
|
Работа с интерактивной доской
|
III. Изложение нового материала
|
Алкадиены — непредельные углеводороды, содержащие две двойные связи. Общая формула алкадиенов СnН2n-2. Если двойные связи разделены в углеродной цепи двумя или более одинарными связями (например, пентадиен-1,4), то такие двойные связи называются изолированными(одинарными). Двойные связи могут чередоваться, могут располагаться подряд. Если в молекулах алкадиенов двойные связи чередуются одинарными связями, то они называются сопряженными диеновыми углеводородами.
СН2 = С= СН –СН3 бутадиен-1,2
СН2 = СН-СН = СН2 бутадиен-1,3(дивинил)
СН2 = СН-СН2-СН =СН2 пентадиен-1,4
Для алкадиенов характерны те же виды изомерии, что и для алкенов:
1) изомерия углеродного скелета.
2) изомерия положения двойных связей
3) цис-транс-изомерия
Номенклатура. Главную цепь в диенах выбирают так, чтобы она содержала обе двойные связи, и нумеруют с того конца, при котором сумма номеров положений двойных связей минимальна. В названии соответствующего алкана окончание -ан заменяется на -диен.
Физические свойства. Бутадиен-1,3 — легко сжижающийся газ с неприятным запахом. Изопрен — жидкость с tкип 34 С.
Получение. Основной промышленный способ получения диенов — дегидрирование алканов. Бутадиен-1,3 (дивинил) получают из бутана:
СН3-СН2-СН2-СН3 t,Сr2О3→ СН2=СН-СН=СН2 + 2Н2
Бутадиен-1,3 можно также получать по реакции С.В. Лебедева путем одновременного дегидрирования и дегидратации этанола:
|
t, ZnO, Al2O3
|
Бутадиен-1,3
|
2С2Н5ОН
|
→
|
СН2=СН-СН=СН2 + Н2 + 2Н2О.
|
Химические свойства. Для алкадиенов характерны обычные реакции электрофильного присоединения АE, свойственные алкенам. Особенность сопряженных диенов состоит в том, что две двойные связи в их молекулах функционируют как единое целое, поэтому реакции присоединения могут протекать в двух направлениях: а) к одной из двойных связей (1,2-присоединение) или б) в крайние положения сопряженной системы с образованием новой двойной связи в центре системы (1,4-присоединение). Так, присоединение брома к бутадиену может привести к двум продуктам:
|
1,2
|
|
СН2=СН-СН=СН2 + Вr2
|
→
|
СН2=СН-СНВr-СН2Вr
|
Или
|
1,4
|
|
СН2=СН-СН=СН2 + Вr2
|
→
|
ВrСН2-СН=СН-СН2Вr
|
Важнейшее свойство диенов — их способность к полимеризации, которая используется для получения синтетических каучуков. При бутадиеновый полимеризации бутадиена-1,3, которая протекает как 1,4-присоединение, получают каучук:
nСН2=СН-СН=СН2 → (-СН2-СН=СН-СН2-)n.
2.Гидрирование (Присоединение водорода протекает стадийно)
СН2 = СН-СН = СН2 +Н2 → Н3С-НС =СН-СН3
бутадиен-1,3(дивинил) Бутен-2
Н3С-НС =СН-СН3 + Н2 → Н3С- Н2С- СН2 -СН3
Бутен-2 Бутан
Применение. Основная область применения алкадиенов - синтез каучуков.
Вулканизацией называется процесс нагревания каучука с серой, в результате которого получают резину. Впервые эффективный способ получения полибутадиенового каучука был предложен русским химиком С.В.Лебедевым.
|
ІV. Закреплениев нового материала
(выполнение заданий, оценка знаний и др.)
|
Какие СН-ды наз. Диеновыми?
|
Каково строение диеновых СН-ов
|
Что такое процесс вулканизация и кем он был получен впервые?
|
Напишите формулы 5 диеновых СН-ов
|
V. Домашнее задание
|
|
Составить 5 формул с изомерами (диеновых СН-ов)
Пар. №8
|
VI. Подведение итогов урока
(Выставление оценок с комментарием, выяснение положительных и отрицательных моментов урока)
|
Преподаватель_____________ А.С.Ингенбаева
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РЕСПУБЛИКИ КАЗАХСТАН
ТАЛДЫКОРГАНСКИЙ КОЛЛЕДЖ СЕРВИСА И ТЕХНОЛОГИИ
ПЛАН ЗАНЯТИЯ №52-53
Дата
|
Группа
|
|
С11ЭВМ
|
|
С11ПУ
|
|
СПМ
|
|
П11М
|
Предмет Химия |
|
|
 Скачать 0.83 Mb.
Скачать 0.83 Mb.