Оформление лаборат. работ по химии. Инструкция по технике безопасности при работе студентов в лаборатории химии Формы отчётов по лабораторным работам
 Скачать 0.65 Mb. Скачать 0.65 Mb.
|
|
Вывод: (каким методом определили молярную массу эквивалента карбоната кальция, о чем говорят результаты расчета ошибок)________________________________________________________________ ___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________. Нарисуйте схематично химическую посуду, используемую в лаборатории. МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ ФГБОУ ВПО «Уфимский государственный нефтяной технический университет» Кафедра «Прикладная химия и физика» Дисциплина «Химия» ОТЧЕТ по лабораторной работе № ___ на тему: «Химическая кинетика. Катализ» Выполнил студент группы__________ ______________ И.О. Фамилия (Подпись, дата) Принял преподаватель кафедры ПХиФ ______________ И.О. Фамилия (Подпись, дата) Цель работы: - изучить влияние концентрации, поверхности реагирующих веществ, присутствия катализаторов на скорость химической реакции; - оценить каталитическую активность катализатора. Теоретическая часть Химическая кинетика – это раздел химии, изучающий ____________________________ ______________________________________. Скоростью химической реакции называют ___________________________________________________________________________________ ____________________________________________________________________________________.Скорость гомогенной реакции выражается формулой: Vгомог.= _____________________ Скорость реакции зависит от различных факторов. Зависимость скорости химической реакции от концентрации выражается законом действия масс: ________________________________________________________________________________ _______________________________________________________________________________________________________________________________________________________________________. Например, для реакции ___________________________________________________________________________________ где Данная система является гомогенной, так как _______________________________________ ___________________________________________________________________________________. Особенность гетерогенных процессов заключается в том, что они____________________________ ____________________________________________________________________. Поэтому скорость химических реакций в гетерогенных системах при постоянной температуре зависит и от _______________________________________________________. Скорость гетерогенной реакции выражается формулой: Vгетер.= _____________________ С ростом температуры скорость химической реакции резко возрастает. Зависимость скорости реакции от температуры выражается правилом ____________________________: _______________________________________________________________________________________________________________________________________________________________________________________________________________________________________ и выражается формулой: ______________________________ где V(T1), V(Т2) - ____________________________________________; Лишь определенная часть общего числа соударений молекул реагирующих веществ приводит к химическому взаимодействию. Такие соударения называются _____________________. Энергия активации – это _________________________________________________________ _______________________________________________________________________________________________________________________________________________________________________. Одним из методов ускорения химической реакции является катализ, который, осуществляется при помощи катализаторов – веществ, ________________________________ _____________________________________________. Механизм действия катализатора сводится к _________________________________________________________________________________. Вещества, снижающие скорость химической реакции, называются _____________________. Автокатализ – это ______________________________________________________________ _______________________________________________________________________________________________________________________________________________________________________. Экспериментальная часть Опыт 1. Зависимость скорости гомогенной реакции от концентрации исходных реагентов Напишите уравнение реакции: _____________________________________________________________________________________ 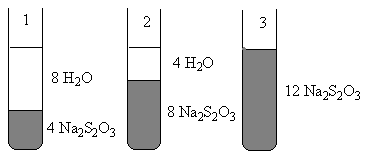 Условная молярная концентрация тиосульфата натрия в пробирке № 1 – «с», № 2 – «2с», № 3 – «3с». Напишите выражение скорости для данной реакции по закону действующих масс: V = __________________________ Занесите полученные результаты в таблицу:
Начертите график зависимости скорости химической реакции от концентрации реагирующих веществ. 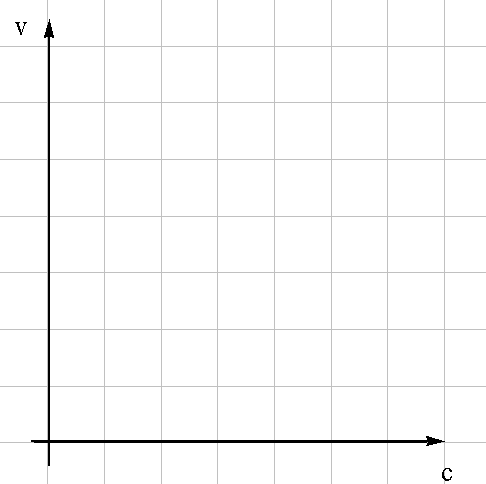 Рисунок – Зависимость скорости химической реакции от концентрации реагирующих веществ Вывод (какой линией выражается найденная зависимость скорости реакции от концентрации реагирующих веществ, должна ли проходить линия через начало координат, почему?): ________________________________ ___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________. Опыт 2. Влияние поверхности реагирующих веществ на скорость реакции в гетерогенной системе Напишите уравнение реакции: __________________________________________________________________________________ Запишите математическое выражение закона действующих масс: _________________________________________________________________________________ Запишите время протекания реакции: 1. (порошок)_________________________________________________________________________ 2. (кусок) ____________________________________________________________________________ Рассчитайте относительную скорость в обоих случаях( 1. __________________________________________________________________________________ 2. _________________________________________________________________________________ Вывод: (как влияет поверхность реагирующих веществ на скорость реакции) _____________________ ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________. Опыт 3. Качественное определение активности различных катализаторов на примере разложения пероксида водорода Запишите наблюдения в обоих случаях: 1. ___________________________________________________________________________________ 2. __________________________________________________________________________________. Запишите уравнения реакций с различными катализаторами: 1. __________________________________________________________________________________ 2. __________________________________________________________________________________. Вывод: (как определили скорость разложения пероксида водорода; какой из катализаторов эффективнее; как доказали, что в обеих пробирках выделяется кислород): __________________________________________________ ___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________. Опыт 4. Автокатализ Запишите наблюдения реакции с катализатором и без участия катализатора и отметьте время протекания реакции в каждом случае: 1. ___________________________________________________________________________________ 2. ___________________________________________________________________________________ Запишите уравнения реакций: 1. ___________________________________________________________________________________ 2. ___________________________________________________________________________________ Рассчитайте относительную скорость в обоих случаях ( 1. ___________________________________________________________________________________ 2. ___________________________________________________________________________________ Вывод: (в каком случае реакция протекает быстрее и почему) ______________________________________ ___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________. МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ ФГБОУ ВПО «Уфимский государственный нефтяной технический университет» Кафедра «Прикладная химия и физика» Дисциплина «Химия» ОТЧЕТ по лабораторной работе № ___ на тему: «Химическое равновесие» Выполнил студент группы__________ ______________ И.О. Фамилия (Подпись, дата) Принял преподаватель кафедры ПХиФ ______________ И.О. Фамилия (Подпись, дата) Цель работы: - изучить влияние концентрации реагирующих веществ и продуктов реакции на смещение химического равновесия. Теоретическая часть Понятие "химическое равновесие" применимо, только к ____________________ реакциям. Химическое равновесие – ________________________________________________________ ________________________________________________________________________________________________________________________________________________________________________. Кинетическое условие химического равновесия: _____________________________________________________________________________________ Константа химического равновесия для обратимой реакции mA+nB =pC+dD имеет вид Кх.р.= _________________________ Константа равновесия зависит от ___________________________________________, ______________________, и не зависит от _______________________________________________. Если Кх.р>1, то в системе преобладает _____________________________________________. Если Кх.р<1, то в системе преобладает ____________________________________________ Если Кх.р=0, то система ________________________________________________________. Константа равновесия связана со стандартной энергией Гиббса данной реакции ( ΔG= _________________________ Направление смещения равновесия определяется принципом Ле Шателье: _______________ _____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________. При повышении концентрации продуктов реакции химическое равновесие смещается в сторону___________________________________________________________________________. При повышении температуры химическое равновесие смещается в сторону _________________________________________________________________________________. При повышении давления химическое равновесие смещается в сторону _________________________________________________________________________________. Экспериментальная часть Опыт 1. Влияние концентрации реагирующих веществ на химическое равновесие Запишите уравнение реакции: __________________________________________________________________________________ Запишите выражение константы химического равновесия для данной реакции: Кх.р.= _____________________________ Заполните таблицу:
Вывод:___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________. МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ ФГБОУ ВПО «Уфимский государственный нефтяной технический университет» Кафедра «Прикладная химия и физика» Дисциплина «Химия» | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
