Оформление лаборат. работ по химии. Инструкция по технике безопасности при работе студентов в лаборатории химии Формы отчётов по лабораторным работам
 Скачать 0.65 Mb. Скачать 0.65 Mb.
|
|
ОТЧЕТ по лабораторной работе № ___ на тему: «Электролитическая диссоциация» Выполнил студент группы__________ ______________И.О. Фамилия (Подпись, дата) Принял преподаватель кафедры ПХиФ __________________И.О. Фамилия (Подпись, дата) Цель работы: -изучить электрическую проводимость растворов электролитов и зависимость её от различных факторов; - научиться предсказывать направление обменной реакции в растворах электролитов. Теоретическая часть Электролиты - __________________________________________________________________ ____________________________________________________________________________________. Процесс распада молекул вещества на ионы под действием растворителя называется___________________________________________________________________________. Основания – это электролиты, которые при диссоциации образуют только один вид анионов – ___________________________________ NaOH ______________________________________ NH4OH _____________________________________. Кислоты – это электролиты, которые при диссоциации образуют только один вид катионов – ___________________________________________ HCl _______________________________________ HNO3 ______________________________________ H2SO4 _____________________________________ H3PO4 _____________________________________. Амфотерные гидроксиды диссоциируют в водном растворе как по типу кислоты, так и по типу основания. При их диссоциации одновременно образуются ионы:_____________________ ____________________________________________________________________________________. К ним относятся гидроксиды цинка Zn(OH)2, алюминия Al(OH)3, хрома (III) Cr(OH)3, свинца (II) Pb(OH)2 и др.. Например, при диссоциации Zn(OH)2 в водном растворе одновременно присутствуют: ___________⇄ H2ZnO2 Zn(OH)2 ⇄ _____________. Средние соли – это электролиты, при диссоциации которых в водных растворах образуются ионы ________________________________________________________________________________ Na2SO4 _____________________________ Ca3(PO)4 ___________________________. Кислые соли при растворении в воде образуют ионы_________________________________ KHSO3 _____________________________,сложный анион диссоциирует частично: HSO3 ________________________ Основные соли при диссоциации образуют анионы_______________________и сложные катионы, состоящие и_________________________________________: Al(OH)2Cl ___________________________,Сложный катион диссоциирует частично: Al(OH)2+ _____________________________ AlOH2+ _______________________________. Двойные соли диссоциируют на два катиона__________________________и анион ________________________________: KAl(SO4)2 _____________________________ Na2NH4PO4 ___________________________. Сложные соли диссоциируют на катион ________________и анионы_________________ ZnClNO3 = ______________________________ AlSO4Cl = _______________________________. Степень диссоциации () показывает_______________________________________________ ____________________________________________________________________________________. Степень диссоциации зависит от различных факторов:_______________________________ _____________________________________________________________________________________ ____________________________________________________________________________________. Для сильных электролитов > 30%, для средних электролитов _______, для слабых электролитов _________. Константа диссоциации для равновесия, которое устанавливается в растворе слабого электролита: AmBn ⇄ m An+ + n Bm ___________________________________________. Равновесия в слабых электролитах подчиняются закону _____________________________. ___________________________________________. Между ионами электролитов в растворе действуют силы_____________________________. В связи с этим состояние ионов описывают активностью условной (эффективной) концентрацией ионов: а = ______________________________. Экспериментальная часть Опыт 1. Изучение электрической проводимости растворов А. Запишите наблюдения, отмечая степень накала лампы:____________________________ ____________________________________________________________________________________. Напишите уравнение диссоциации воды: H2O _______________________________________________________________________________. Б. Запишите наблюдения, отмечая степень накала лампы: 1.___________________________________________________________________________________ 2.___________________________________________________________________________________ 3. __________________________________________________________________________________ 4.___________________________________________________________________________________ 5. ___________________________________________________________________________________ 6. __________________________________________________________________________________. Напишите уравнения диссоциации электролитов: 1. CH3COOH _________________________________________________________________________ 2. NH4OH ____________________________________________________________________________ 3. HNO3 _____________________________________________________________________________ 4. HCl _______________________________________________________________________________ 5. NaOH _____________________________________________________________________________ 6. KOH ____________________________________________________________________________. Вывод: (по степени накала лампы определить сильным или слабым электролитом являются вышеприведённые вещества)________________________________________________________________ ___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________. В. Напишите уравнения реакций в молекулярной и ионной формах: 1. HCl + NaOH _______________________________________________________________________ __________________________________________________________________________________________________________________________________________________________________________ 2. CH3COOH + NH4OH _______________________________________________________________. _________________________________________________________________________________________________________________________________________________________________________. Смешайте равные объёмы растворов и запишите наблюдения: 1.___________________________________________________________________________________ 2.___________________________________________________________________________________, Вывод: (какова электрическая проводимость полученных растворов)_________________________ ____________________________________________________________________________________ ___________________________________________________________________________________ ________________________________________________________________________________________________________________________________________________________________________. Опыт 2. Зависимость электрической проводимости раствора (степени диссоциации электролита) от разбавления При добавлении дистиллированной воды к концентрированной кислоте степень накала лампы ______________________________________________________________________________. При добавлении дистиллированной воды к концентрированному раствору аммиака степень накала лампы ________________________________________________________________________. Вывод: (как изменяется электрическая проводимость растворов от разбавления)____________________ ___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________. Опыт 3. Изменение электрической проводимости раствора в результате смещения ионного равновесия Напишите уравнение диссоциации серной кислоты: H2SO4 _______________________________________________________________________________ Степень накала лампы 0,02 М раствора серной кислоты ____________________________________. Напишите уравнение диссоциации гидроксида бария: Ba(OH)2 ____________________________________________________________________________. Степень накала лампы 0,02 М раствора гидроксида бария______________________________ При добавлении фенолфталеина к раствору гидроксида бария раствор окрашивается в___________________цвет. При добавлении серной кислоты к гидроксиду бария цвет раствора_______________________, а степень накала лампы_________________________. В момент исчезновения окраски индикатора (в точке эквивалентности) электрическая проводимость раствора_________________________________________________________ . Напишите ионообменную реакцию в молекулярной и ионной формах: H2SO4 + Ba(OH)2_________________________________________________________________ _____________________________________________________________________________________ ____________________________________________________________________________________. При добавлении к раствору избытка серной кислоты электрическая проводимость раствора_______________________________________________________________________. Вывод: (как изменяется электрическая проводимость при связывании ионов)______________________ __________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________. Опыт 4. Влияние одноименного иона на степень диссоциации слабого электролита (смещение равновесия диссоциации) А. Напишите уравнения диссоциации: NH4OH ______________________________________________________________________________ NH4Cl _____________________________________________________________________________________ КД (NH4OH) = ______________________________. При добавлении фенолфталеина к раствору аммиака наблюдается _______________________окрашивание. В присутствии хлорида аммония цвет раствора __________________________. Вывод: (как изменяется степень диссоциации слабого электролита исходя из принципа Ле Шателье и константы диссоциации)__________________________________________________________________ _______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ ____________________________________________________________________________________. Б. Напишите уравнения диссоциации CH3COOH ___________________________________________________________________________ CH3COONa __________________________________________________________________________ КД (CH3COOH) = _____________________________________________________ При добавлении метилового оранжевого к раствору уксусной кислоты наблюдается _______________окрашивание. В присутствии ацетата натрия цвет раствора ___________________ ___________________________________________________________________________________. Вывод: (как изменяется степень диссоциации слабого электролита исходя из принципа Ле Шателье и константы диссоциации)___________________________________________________________________ __________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________. МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ ФГБОУ ВПО «Уфимский государственный нефтяной технический университет» Кафедра «Прикладная химия и физика» Дисциплина «Химия» ОТЧЕТ по лабораторной работе № ___ на тему: «Приготовление водных растворов» Выполнил студент группы__________ ______________ И.О. Фамилия (Подпись, дата) Принял преподаватель кафедры ПХиФ ______________ И.О. Фамилия (Подпись, дата) Цель работы: - освоить навыки приготовления растворов заданной концентрации и методики их количественного анализа. Теоретическая часть Количественный состав растворов выражается концентрацией. Концентрацией раствора называется___________________________________________________________________________ _________________________________________________________________________________________________________________________________________________________________________. Массовая доля растворённого вещества – ___________________________________________ ___________________________________________________________________________________ где ω (Х) – ____________________________________________________________________ m(X) –______________________________________________________________________________ m – ________________________________________________________________________________. Молярная концентрация ________________________________________________________ ____________________________________________________________________________________ где n2 – _________________________________________________________________________ V − ________________________________________________________________________________. Нормальная концентрация _____________________________________________________ _____________________________________________________________________________________ 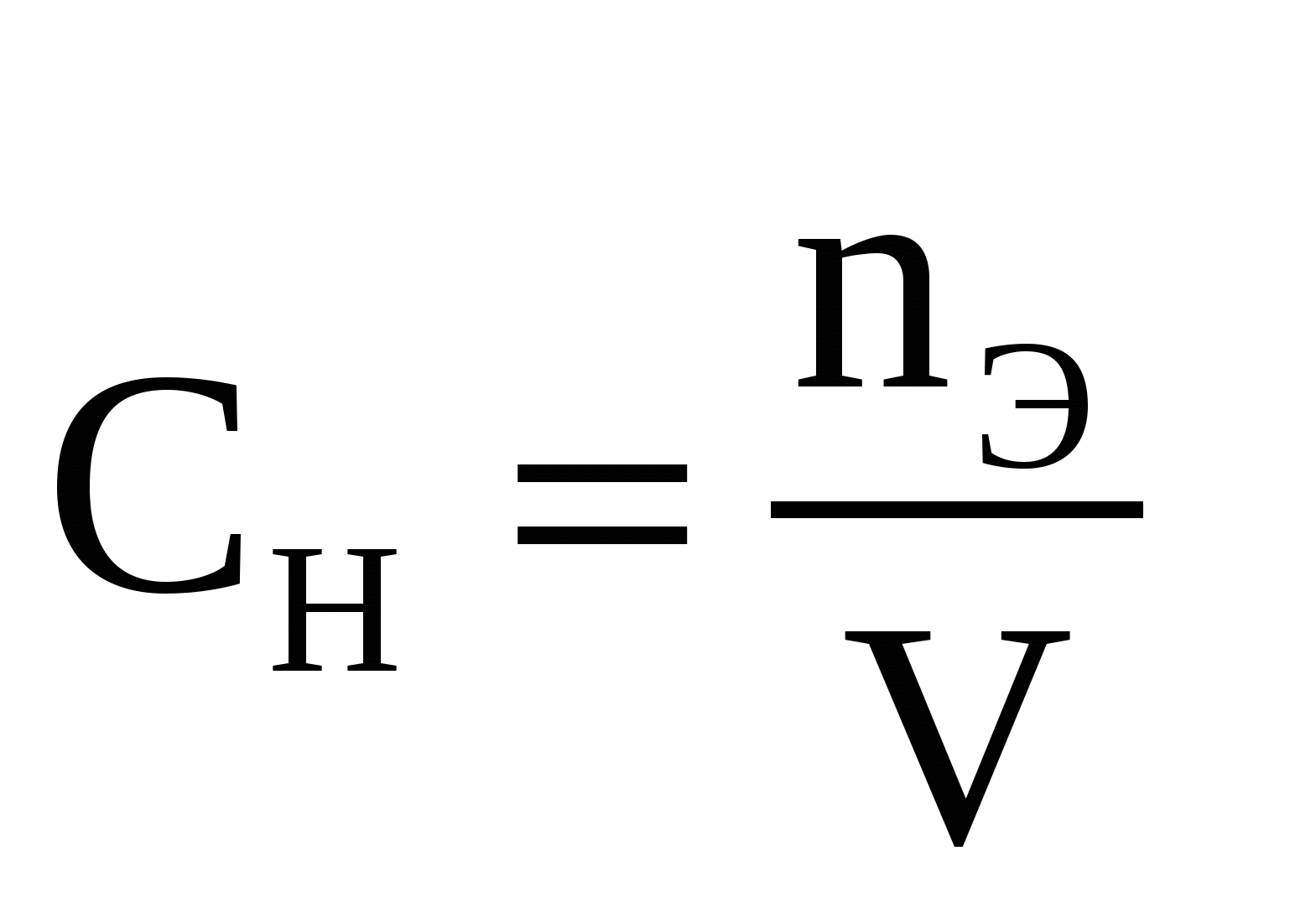 где nЭ – _________________________________________________________________________ V − ________________________________________________________________________________. Моляльная концентрация – _______________________________________________________ _____________________________________________________________________________________ где n2 – __________________________________________________________________________ mраствора − ____________________________________________________________________________. Мольная доля – ______________________________________________________________ _________________________________________________________________________________________________________________________________________________________________________ Экспериментальная часть Опыт 1. Приготовление раствора заданной концентрации Приготовьте 250 мл________________ % раствора хлорида натрия из концентрированного раствора и воды. Ход работы:
____________________________________________________________________________________.
_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________. 3. Определите плотность приготовляемого_________% раствора хлорида натрия по таблице: ___________________________________________________________________________________. 4. Вычислите вес приготовляемого раствора крестом:   ______ ( _____ - 0 ) ______ ( _____ - 0 ) …. ….0  _____ ( ______ - ____) _____ ( ______ - ____)5. Рассчитайте, какое весовое количество исходного раствора хлорида калия нужно для приготовления заданного раствора: ________________________________________________________________________________ ________________________________________________________________________________. 6. Пересчитайте полученную величину навески на объем: _______________________________________________________________________________. 7. Рассчитайте нужный объем воды: _______________________________________________________________________________. 8. Отмерьте мерным цилиндром вычисленные объёмы концентрированного раствора и воды, слейте их, тщательно перемешайте жидкость и определите ареометром плотность полученного раствора: ____________________________________________________________________________________ Определите расхождение найденной и заданной плотностей в процентах: _____________________________________________________________________________________ |
